Christoph Stephan, Frankfurt
HIV-Positiv, unerkannt, spät-diagnostiziert Herausforderungen während der Behandlung
Warum sagen wir heute “Late Diagnosed” und nicht mehr “Late Presenter”? Im Grundsatz geht’s um das gleiche Kollektiv: Menschen, die mit HIV leben und die HIV-Diagnose erst spät im Verlauf ihrer Infektion gestellt wird und die somit erst mit einer CD4-Zellzahl von höchstens 350/mm3 in die spezialisierte HIV-Versorgung und -Therapie eintreten.1,2 Der Grund, sich mit der Frage zu beschäftigen, ist wichtig. Diese Menschen sind oder werden schwer krank und stellen für die Medizin eine große Herausforderung dar.3 Die individuelle Analyse zeigt, dass Menschen, die nichts von ihrer HIV-Infektion wissen, häufig medizinische Notaufnahmen und Einrichtungen wegen HIV-assoziierten Gesundheitsstörungen aufsuchen, ohne dass ihnen ein HIV-Test angeboten wird. Auf dem Weg zur „Spätdiagnose“ liegen unterwegs meist viele „verpasste Gelegenheiten“ für eine frühere HIV-Diagnosestellung – mit fatalen Folgen und zwar epidemiologisch aufgrund jahrelanger HIV-Weiterverbreitung seitens der spät diagnostizierten Person (nur wer von der Infektion weiß, verhindert die Weitergabe effektiv) und auch individuell, denn eine hohe Morbidität erfordert enorme (intensivmedizinische) Anstrengungen. Patient*innen jenseits eines “point of no return” haben zudem eine hohe Mortalität. Der Begriff „Late-Diagnosed“ spiegelt den Weg der Patient*innen besser wieder. Für die Situation verantwortlich sind nicht die, die mit HIV leben, sondern Mängel im Gesundheitssystem.
Der klinische Fall
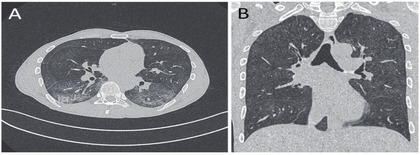
Abb. 1 A+B CT-Thoraxaufnahmen eines spät diagnostizierten Menschen mit HIV: atypische Pneumonie beidseits, mit milchglasartigen Infiltraten (A + B), vor Diagnose und Therapie einer Pneumocystis jiroveci-Infektion
Ein 42jähriger Mann mit akademischem Bildungshintergrund, der Sex mit Männern hat, stellt sich mit Luftnot vor, die initial mit 5 L/Min Sauerstoff über Reservoirmaske behandelt wird. Nach Auffälligkeiten in der Thorax-Bildgebung erfolgt eine Computertomographie (CT), die den Befund eines bi-pulmonalen Milchglas-Infiltrats (Abb. 1, A+B) erbringt.
Der HIV-Test ist positiv und es zeigt sich im Labor eine stark erniedrigte CD4-Zellzahl (87/µL) sowie eine hohe HIV-RNA (455.000 cop/mL). In der broncho-aveolären Lavage (BAL) gelingt der mikroskopische Nachweis von Pneumocystis jiroveci (Grocott-Färbung), woraufhin eine intravenöse Therapie des Patienten mit hochdosiertem Cotrimoxazol beginnt (gewichtsadaptiert, hier: 3x 5 Ampullen à 480 mg), begleitet von Steroiden (initial 2x 40 mg Prednisolon).
Frage 1: Wann sollte bei diesen Pat. die antiretrovirale Therapie (ART) begonnen werden?
- bis zum 7. Tag nach Start Cotrim?
- Tag 8-21 nach Start Cotrim?
- erst nach Ende des 21-tägigen Therapiezyklus mit hochdosiertem Cotrim?
Diskussion Frage 1:
Neuere Therapiekonzepte verfolgen die Strategie, baldmöglichst nach Therapiebeginn der opportunistischen Infektion (OI) mit der ART zu beginnen, dazu gibt es sogar Studiendaten, die einen signifikanten klinischen Vorteil für früh behandelte (<16 Tage nach OI-Therapiestart) erbrachte.4 Auch aus einer deutschen Arbeitsgruppe liegen Daten zu dieser Fragestellung vor.5 Dennoch kann die sich (häufig) manifestierende Allergie gegen das eingesetzte Cotrimoxazol, die oft um Tag 11 herum auftritt, zum Absetzen sowohl von Cotrims als auch der ART führen, wenn Unsicherheit über das Allergie-auslösende Agens besteht und dann individuell wiederum Folgekomplikationen/Nachteile für Betroffene im Verlauf darstellen. Im hier dargestellten Fall sollte mit der ART am Tag 10 nach Beginn Cotrim begonnen werden, nachdem bereits der Sauerstoffbedarf deutlich rückläufig war (1 L/Min nasal).
Frage 2: Welche ART-Kombination ist am besten?
- Bictegravir/Tenofovir Alafenamid/Emtricitabin – als Eintablettenregime in Standarddosis?
- Darunavir/Cobicistat/Tenofovir Alafenamid/Emtricitabin – als Eintablettenregime (Standarddosis)?
- Tenofovir Disoproxil/Emtricitabin/Efavirenz – als Eintablettenregime (Standarddosis)?
- Tenofovir Alafenamid/Emtricitabin + Dolutegravir – zwei-Tablettenregime (Standarddosis)?
- Dolutegravir/Lamivudin – als Eintablettenregime (Standarddosis)?
Diskussion Frage 2:
Bei der Beantwortung dieser Frage gibt es kein „falsch“ oder richtig – alle Antworten stellen mittlerweile veritable therapeutische Optionen dar. Allerdings wird die Kombination mit Efavirenz heute kaum mehr verwendet, sie wird in Leitlinien in Mitteleuropa nicht mehr empfohlen aufgrund zentralnervöser Nebenwirkungen. Generell wird den Eintablettenregimen der Vorzug gegeben aufgrund von Adhärenz-Vorteilen. Traditionell wurde bei schweren OI-Komplikationen bei Spätdiagnostizierten auf robuste und verlässliche geboosterte Protease-Inhibitor-basierte Kombinationen gebaut, doch mittlerweile haben die modernen Integrase-Inhibitor „2.0“ (Bictegravir, Dolutegravir)-haltigen Kombinationen in der Behandlungs-Sicherheit gleichgezogen. Duale Konzepte als Initialtherapie sind bei schweren OI noch wenig evaluiert.
Der erste prospektive head-to-head-Studienvergleich zwischen zwei Eintablettenregimen als Initialtherapie bei sehr spät diagnostizierten Personen, die mit HIV leben, ist die LAPTOP-Studie 6, die vom europäischen Studien-Netzwerk „NEAT-ID“ durchgeführt wird. Mit Ergebnissen ist Ende 2024 zu rechnen (Abb. 2).
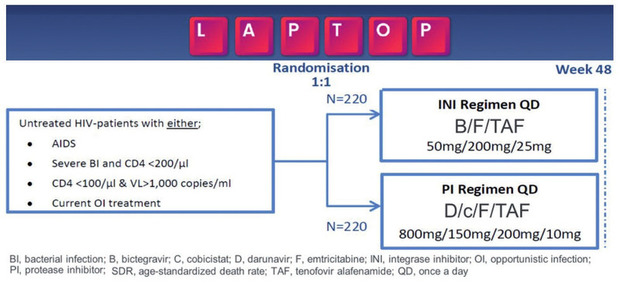
Abb. 2 Studiendesign der LAPTOP-Studie: erster multizentrischer head-to-head-Vergleich zwischen Integrase-Inhibitor- und geboosteter Protease-Inhibitor-basierter ART
Wie geht es weiter?
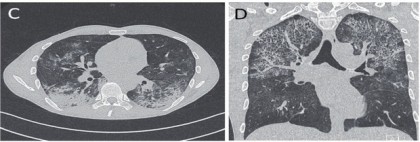
Abb. 3 C+D CT-Thoraxaufnahmen eines spät diagnostizierten Menschen mit HIV, am Tag 18 nach Beginn der Therapie einer Pneumocystis jiroveci-Pneumonie und Tag 8 nach ART-Start und bei nun erneuter klinischer Beschwerdesymptomatik: neue diffuse beidseitige Oberfeld-Infiltrate (C + D)
Die Pneumocystis-Pneumonie wurde mit hochdosiertem Cotrim behandelt. Nach initialer klinischer Besserung der Dyspnoe wurde am Tag 10 nach Start von Cotrim mit der antiretroviralen Therapie begonnen und zwar mit der Eintabletten-Kombination Bictegravir/Tenofovir Alafenamid/Emtricitabin in Standarddosierung. Ab Tag 18 kam es zum Rückfall der Dyspnoe und neu: Fieber! In der erneut durchgeführten BAL gelingt mikroskopisch weiterhin der Nachweis von Pneumocystis jiroveci, nicht aber für Cytomegalievirus oder typisch bakterielle Erreger (kulturell). Eine erneut durchgeführte CT zeigte neue pulmonale Infiltrate, dieses Mal apikal beidseits betont (Abb. 3 C+D).
Im Labor findet sich ein deutlicher Abfall der HIV-RNA auf nur noch 9.300 K/mL sowie ein Anstieg der CD4-Zellzahl auf 207/µl (Tag 20 nach Cotrim-Start). Damit ist die Erkrankung nun zu klassifizieren und erfüllt die Kriterien nach French7 für ein „IRIS“.
Was ist IRIS?
Das IRIS (Immun-Rekonstitutions-Inflammations-Syndrom) stellt eine „Regelverletzung“ dar. Ein Dogma in der Medizin lautet: Auf den Beginn der spezifischen, adäquaten Therapie folgt die klinische Verbesserung. Übersetzt in die HIV-Medizin heißt das: Nach Beginn der ART erholt sich der Mensch, HIV-assoziierte Symptome enden. Im Fall eines IRIS ist es umgekehrt. Aufgrund zunehmender HIV-Replikationskontrolle und nachfolgender Erstarkung des Immunsystems (messbar anhand des CD4-Zell-Anstiegs!), bekommt der Spätdiagnostizierte Probleme. Das Immunsystem wehrt sich erstmals aktiv gegen opportunistische Infektionserreger.
Zwei Arten von IRIS
Man unterscheidet zwei Typen von IRIS:
1. „demaskierendes IRIS“: Das Pathogen ist bereits im Körper aktiv, aber noch nicht diagnostiziert und behandelt, was nun aufgrund neuer Symptome möglich wird, und
2. „paradoxes IRIS“: Das Pathogen ist bereits diagnostiziert und behandelt, aber bisher wenig symptomatisch. Aufgrund des immunrekonstitutionsbedingten neuformierenden Angriffs auf vorhandene Targets beginnt eine transiente Verschlechterung des klinischen Zustands.
Typische Beispiele für (paradoxes) IRIS sind Kryptokokkenmeningitis oder Tuberkulose, aufgrund derer sogar der ART-Beginn in Therapieleitlinien verzögert empfohlen wird. Aber auch für heute seltener gewordene AIDS-Manifestationen ist IRIS beschrieben, z.B. die progressive multifokale Leukenzephalopathie (PML) oder sogar opportunistische Tumore, wie im Fall des Kaposi-Sarkoms. Für die Pneumocystis-Pneumonie wurde auch vor kurzem ein klinisches IRIS erstmals beschrieben.8
Welche Therapie jetzt?
Der klinische Zustand des Patienten hat sich verschlechtert. Er hat ein IRIS entwickelt.
Frage 3: Was ist zu tun?
- Steroidtherapie gegen das IRIS: Prednisolon 80 mg, anschließend ausschleichen?
- ART beenden, um einen Lungenschaden durch IRIS zu verhindern?
- Wechsel der ART (INSTIs vermeiden: zu schneller Viruslastabfall befördert IRIS)?
- Wechsel der Pneumocystis-Therapie (weil sie versagt) → Pentamidine +/- Clindamycin?
- Mehr Diagnostik erforderlich – irgendetwas geht da vor sich, was wir nicht verstehen
Diskussion Frage 3:
Steroide stellen die Behandlung des IRIS dar, aber… Vor Beginn einer zusätzlich immunsupprimierenden Steroid-Therapie sollte weitere Diagnostik klären, welche Form von IRIS hier vorliegt (paradox oder demaskierend). Ein Versagen der Pneumocystis-Therapie ist kaum zu konstatieren. Der mikroskopische oder molekularbiologische Nachweis von Pneumocystis jiroveci auch vor Ende der hochdosierten Cotrimtherapie ist nicht ungewöhnlich. Tatsächlich ist unter INSTIs ein schnellerer HI-Viruslastabfall als unter Protease-Inhibitor- oder nicht-nukleosidalen Reverse-Transkriptase-Inhibitor-basierten Kombinationen zu verzeichnen. Dass sich dieser Unterschied in eine erhöhte Inzidenz von IRIS übersetzt – das ist nicht bekannt. Ebenso unbekannt ist die Strategie, mit frühem Absetzen der ART, die autoimmunologische Schädigung von Lungenparenchym aufgrund von IRIS zu vermeiden.
Welcher Typ IRIS ?
Den Fieberverlauf ist in Abbildung 4 dargestellt. Kontinua, mit Spitzen bis 39.5°C, immer wieder unterbrochen durch fiebersenkende Maßnahmen, bei stabilen Kreislaufverhältnissen (normwertige Blutdruckmessungen), eine typisch-bakterielle Sepsis liegt nicht vor.
Weitere klinische Symptome sind trockener, nicht-produktiver Husten, allgemeine Schwäche (Malaise) und Gewichtsverlust (5 kg in 4 Wochen). Die weitere Diagnostik erbrachte folgende Befunde:
- Lymphknotenvergrößerung perihilär, davon wurde eine Biopsie genommen (ultraschall-gesteuert von endobronchial). Die Histopathologie schließt ein Lymphom aus. Der Befund lautet: “Floride granulocytische und Epithelioidzell-Inflammation”.
- übliche Blutkulturen blieben steril, aber in mehreren Citrat-Blutkulturen fand sich kulturelles Wachstum von Mycobacterium avium intracellulare (MAI).
![Abb. 4 Ausschnitt Fieberkurve des spät diagnostizierten Menschen mit HIV, ab Tag 18 nach Therapiebeginn der Pneumocystis jiroveci-Pneumonie sowie Tag 8 nach ART-Start. Skalierungen: links – Körpertemperatur (blaue Kurve) in [°Celsius], mitte – Pulsfrequenz (rote Kurve) in [Schläge/Minute], rechts – Blutdruck (schwarze doppelendende Pfeile) in [mmHg nach Riva-Rocci]](images/Infect-m_April24_HIV_FoBi_CStephan_Iris-009.jpg)
Abb. 4 Ausschnitt Fieberkurve des spät diagnostizierten Menschen mit HIV, ab Tag 18 nach Therapiebeginn der Pneumocystis jiroveci-Pneumonie sowie Tag 8 nach ART-Start. Skalierungen: links – Körpertemperatur (blaue Kurve) in [°Celsius], mitte – Pulsfrequenz (rote Kurve) in [Schläge/Minute], rechts – Blutdruck (schwarze doppelendende Pfeile) in [mmHg nach Riva-Rocci]
Frage 4: Und jetzt?
Die Befunde sprechen für ein demaskierendes IRIS aufgrund einer invasiven Infektion mit MAI. Was ist zu tun?
- Fortsetzung der ART (B/F/TAF) sowie Beginn der Therapie gegen nicht-tuberkulöse Mykobakterien (NTM) mit Ethambutol (EMB) und Azithromycin (AZI) plus Steroide?
- Fortsetzung der ART (B/F/TAF), Beginn der NTM-Therapie mit Rifabutin (RBT, Standarddosis 300 mg täglich) und AZI plus Steroide?
- Beenden der alten ART (B/F/TAF) und Beginn einer neuen ART (DRV/c/F/TAF) sowie Beginn der NTM-Therapie mit RBT (in reduzierter Dosis: 150 mg tägl.), EMB und AZI plus Steroide?
- Fortsetzung der ART (B/F/TAF) ohne Beginn NTM-Therapie ohne Steroide (= „aussitzen“)?
Diskussion Frage 4:
Folgende Diagnose lässt sich stellen: Disseminierte, nicht-tuberkulöse Mykobakterieninfektion als AIDS-Manifestation, histologisch nachgewiesen aus infracarinalem Lymphknoten mit symptomatischer Lungenbeteiligung (CT) und atypische, pneumogene NTM-Sepsis. Die Wahl einer maximalen Therapie erscheint rational und erfordert den Einsatz einer antimykobakteriellen Therapie. Wichtigste Komponente ist a.e. das Makrolid (AZI), aber die kompromisslose Kombinationstherapie erscheint angezeigt – und diese schließt neben EMB auch ein Rifamycinderivat mit ein. Eher noch als Rifampicin ist bei AIDS für die NTM-Therapie RBT etabliert. Dies erfordert einen Interaktions-Check. Üblich ist hier die Eingabe in die Liverpooler Online-Datenbank „HIV-Drug-Interaction-Checker“.9 Demnach ist die Co-Administration von Rifabutin mit B/F/TAF nicht empfohlen und macht somit einen ART-Wechsel erforderlich. Als Eintabletten-ART-Regime erscheint D/c/F/TAF mit RBT trotz „potentiell klinisch-relevanten Wechselwirkungen“ kombinierbar, vorbehaltlich erforderlicher zusätzlicher Kontrollen unter ggf. Einsatz therapeutischen Drug-Monitorings („TDM“ = Spiegelkontrollen) und/oder Anpassung der Einnahmezeitpunkte.
Wie weiter?
Steroide wurden insgesamt 6 Wochen verabreicht und ausgeschlichen. Die NTM-Therapie wurde über 6 Monate verabreicht (RBT/EMB/AZI). Nach prompter Entfieberung dauerten die klinischen Beschwerden (Husten und Schwäche) insgesamt noch 4 Wochen an und sistierten dann, begleitet von moderater Gewichtszunahme. Im Labor zeigte sich nach 3 Monaten ein Anstieg der CD4-Zellzahl (211/µL) und weiterer Abfall der HIV-RNA (106 cop/mL), nach 4 Monaten komplette Virussuppression. Als einziges weiteres klinisches Ereignis manifestierte sich ein oraler Soor mit Kultur-Nachweis von Candida albicans, der prompt auf Fluconazol über 14 Tage ansprach.
1 Antinori A, Coenen T, Costagiola D, et al.; European Late Presenter Consensus Working Group. Late presentation of HIV infection: a consensus definition. HIV Med. 2011 Jan;12(1):61-4
2 Puła J, Kowalska J, Paciorek M, Bednarska A, Skrzat-Klapaczyńska A, Horban A. Is the definition of late diagnosis correct? HIV Med. 2023 May;24(5):616-619
3 Stephan C, Schleenvoigt BT. Welche Diagnosen führen HIV-Infizierte in die Klinik? MMW Fortschr Med. 2023 Jun;165(Suppl 2):36-38
4 Zolopa AR, Andersen J, Komarow L, Sanne I, Sanchez A, et al. (2009) Early Antiretroviral Therapy Reduces AIDS Progression/Death in Individuals with Acute Opportunistic Infections: A Multicenter Randomized Strategy Trial. PLoS ONE 4(5): e5575
5 Schäfer G, Hoffmann C, Arasteh K, et al; IDEAL study group. Immediate versus deferred antiretroviral therapy in HIV-infected patients pre-senting with acute AIDS-defining events (toxoplasmosis, Pneumocystis jirovecii-pneumonia): a prospective, randomized, open-label multicenter study (IDEAL-study). AIDS Res Ther. 2019 Nov 15;16(1):34
6 ClinicalTrials.gov Identifier: NCT03696160
7 French MA, Price P, Stone SF (2004) Immune restoration diseases after antiretroviral therapy. AIDS 18(12): 1615–27
8 Kann G, Wetzstein N, Bielke H, et al. Risk factors for IRIS in HIV-associated pneumocystis-pneumonia following ART initiation. J Infect. 2021 Sep;83(3):347-53
9 Siehe online unter https://www.hiv-druginteractions.org/checker [Zugriff am 02.03.2024]