Johanna Koehler und Julia Slotta-huspenina, München und Weitere*
Lepra
Die Lepra ist eine der ältesten bakteriellen Infektionskrankheiten, die bereits in der Antike beschrieben wurde. Sie wird durch das Bakterium Mycobacterium leprae verursacht und manifestiert sich klinisch vor allem durch charakteristische Hautläsionen.
Zwischen 2019 und 2022 wurden gemäß Robert Koch-Institut in Deutschland sechs dokumentierte, mutmaßlich importierte Leprainfektionen gemeldet.1 Weltweit erkrankten 2022 jedoch 174.000 Menschen neu an Lepra, vorrangig in Indien, Indonesien und – wie bei unserem Patienten – in Brasilien.2 Bei Mycobacterium leprae handelt es sich um ein nicht-bewegliches, säurefestes Stäbchen, welches in-vitro nicht kultivierbar ist, sondern lediglich in der Tierkultur wächst.3
Transmission
Auf welchem Weg der Erreger in den menschlichen Organismus gelangt, gilt bisher als nicht ausreichend gesichert. Mutmaßlich handelt es sich um eine klassische Tröpfcheninfektion. Ein Übertragungsrisiko besteht insbesondere bei engem Kontakt über mehrere Monate mit einem therapienaiven Lepraerkrankten. So können lebensfähige Leprabakterien in der Umwelt des Infizierten, beispielsweise in Erde oder Staub, persistieren. Eine Übertragung durch kurze Expositionen wie Händeschütteln, Umarmen, nebeneinandersitzen oder gemeinsames Essen ist hingegen unwahrscheinlich. In Südamerika und in den USA spielt die Übertragung über Gürteltiere eine nicht unwichtige Rolle. Die Inkubationszeit beträgt im Durchschnitt drei bis fünf Jahre.
Prävention
Nach Einleitung einer effektiven Behandlung von Mycobacterium leprae nimmt die Bakterienlast rasch ab, was zu einer deutlichen Verringerung der Infektiosität führt.4 Zudem besteht für enge Kontaktpersonen wie Familienmitglieder die Möglichkeit einer effektiven Postexpositionsprophylaxe, die aus einer Einmalgabe von Rifampicin 600 mg besteht. Trotz dieser Möglichkeiten erleben Patienten mit Lepra wegen ihres markanten klinischen Erscheinungsbildes und des geschichtlichen Hintergrunds oft Stigmatisierung in der Gesellschaft.
Klinik und Formen der Lepra
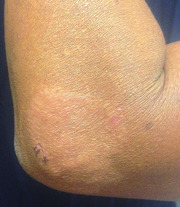
Abb. 1 Paucibacilläre Lepra
© WIKIMEDIA COMMONS
Mycobacterium
leprae
kann sich zu Beginn im Stadium der indeterminierten Lepra als
einzelne hypopigmentierte Maculae
äußern. Klinisch präsentieren sich diese Flecken als blass,
unscharf begrenzt und ohne Inflammation oder neurologische Ausfälle
(Abb. 1). Ein vermindertes
Schmerz- oder Temperaturempfinden bzw. verminderte Schweißbildung an
den entsprechenden Hautläsionen können hier das Ende des bis zu
fünf Jahren andauernden Stadiums andeuten. Eine frühzeitige
Therapieeinleitung kann hier jedoch ein Fortschreiten der
Erkrankung
und bleibende neurologische Defizite verhindern.
Bleibt die Erkrankung unbehandelt, kommt es zu einem Übergang in die determinierte Lepra, welche klinisch je nach Immunitätslage durch die WHO-Klassifikation in eine paucibazilläre (≤5 Hautläsionen) oder multibazilläre (>5 Hautläsionen oder Mononeuritis multiplex) Lepra eingeteilt wird. Alternativ kann die Lepraerkrankung auch gemäß der Ridley-Jopling-Klassifikation in die Verlaufsformen tuberkuloid, lepromatös sowie in einem Zwischenstadium als Borderline-Typ, je nach Größe, Oberflächenbeschaffenheit, Anzahl und Befund des Skinsmears, unterteilt werden.
Bei der Lepra vom tuberkuloiden Typ treten primär einzelnstehende Papeln und Plaques mit scharfer Berandung, zentraler Hypopigmentierung und asymmetrischem, Extremitäten betontem Verteilungsmuster auf. Die Kontagiösität ist entsprechend ihrer paucibazillären Erregerlast gering. Bei der multibazillären Lepra (lepromatöser Typ) liegt in der Regel eine eingeschränkte T-Zell Immunität vor. Der Hautbefund ist durch rotbraune, knotige Leprome oder einfache makulöse Läsionen am Stamm oder an den Extremitäten charakterisiert. Typischerweise sind auch Gesicht und Ohrmuscheln betroffen, was in extremen Fällen als „facies leonina“ beschrieben wird. Zudem können Schleimhäute und Augen beeinträchtigt sein.3
Immunologische Reaktionen
Weiterhin kann es spontan oder unter Therapie zu Exazerbation der Erkrankung kommen. Hier werden bei der Lepra zwei unterschiedliche immunologische Reaktionen unterschieden. Bei der Typ-1-Reaktion handelt es sich um eine zellvermittelte Immunantwort im Sinne einer TYP IV Allergiereaktion vom Spättyp. Klinisch beschränkt sich die Typ-1-Reaktion auf die bereits bestehenden Hautläsionen, die sich dann vermehrt erythematös sowie ödematös präsentieren. Unser Patient entwickelte eine Typ-2-Reaktion (Erythema nodosum leprosum), wie in Abbildung 1 Kasuistik dargestellt, die klinisch ähnlich dem Erscheinungsbild eines Sweet-Syndroms imponieren kann.5 Pathophysiologisch handelt es sich bei der Typ-2 Reaktion um eine Immunkomplex-vermittelte Vaskulitis, entsprechend einer Typ-III-Reaktion nach Coombs und Gell. Diese tritt besonders häufig bei Patienten auf, die eine hohe Erregerlast aufweisen, wie es beispielsweise bei der multibazillären, lepromatösen Lepra der Fall ist. Im Gegensatz zur Typ-1-Reaktion handelt es sich hierbei um eine systemische Reaktion, die mit Fieber, Lymphadenopathie sowie dem Auftreten neuer Hautläsionen am gesamten Körper einhergeht, die im Verlauf ulzerieren können.
Diagnostik
Gemäß WHO Empfehlung erfolgt die Diagnose einer Lepra auf Basis der klinischen Untersuchung bei z.B. deutlicher Hyposensibilität in einer hypopigmentierten oder rötlichen typischen Hautläsion oder einer Verdickung eines peripheren Nerv mit Hyposensibilität oder Schwäche der von diesem Nerv versorgten Muskeln und mittels Nachweises von säurefesten Bakterien in Skin Smears oder in einer Biopsie. Der mikroskopische Nachweis von säurefesten Stäbchen gelingt häufig nur bei der multibazillären Lepra.6 Aus diesem Grund stellt die Diagnostik der paucibazillären Lepra weiterhin eine Herausforderung dar. Eine höhere Sensitivität für den Nachweis von M. leprae weist die PCR auf.3 Serologisch können Antikörper gegen ein Zellwandprotein des Bakteriums – das PGL-1 – bestimmt werden, bei Vorliegen gelingt jedoch meist auch ein mikroskopischer Nachweis, dies eignet sich auch zum Monitoring des Therapieerfolgs. Eine kulturelle Aufzucht von M. leprae ist nur in-vivo möglich und wird daher nicht routinemäßig praktiziert.
Therapie
Die WHO-Leitlinie empfiehlt als Standard eine Triplebehandlung bestehend aus Rifampicin, Clofazimin sowie Dapson.6 Eine paucibazilläre Lepra sollte 6 Monate, eine multibazilläre Lepra mindestens 12 Monate behandelt werden.7 Bei Unverträglichkeit oder Resistenz gegenüber einem oder mehreren der drei Standardtherapeutika kann alternativ auch Ofloxacin, Minocyclin, Clarithromycin oder Bedaquilin verwendet werden (Tab. 1).
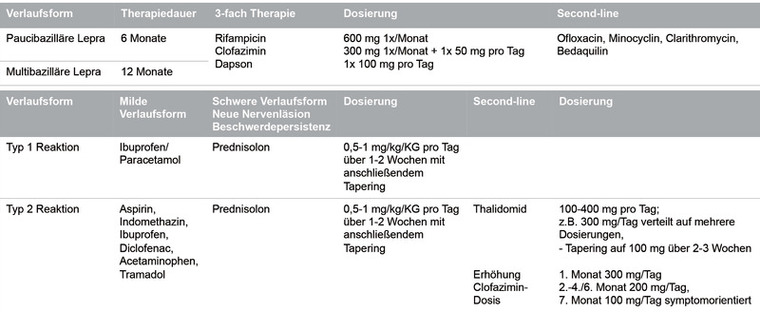
Tab. 1
Die Behandlung der Leprareaktion vom Typ 1 und Typ 2 erfolgt gewöhnlich systemisch mit Glukokortikoiden.8 Die besondere Herausforderung bei unserem Patienten stellte die steroidrefraktäre Typ-2-Reaktion dar, die in der Regel sehr gut auf Thalidomid (300 mg für eine Woche mit anschließendem Tapering auf eine Erhaltungsdosis) anspricht.9 Ergänzend hierzu kann auch eine Dosiserhöhung des ebenfalls immunmodulatorisch wirkenden Clofazimins angestrebt werden.
Molekulare Quantifizierung der Bakterienlast und serologische Verfahren, wie beispielsweise der Nachweis von Antikörpern gegen das phenolische Glycolipid-1 (PGL-1), können als Therapiemonitoring eingesetzt werden. In der Regel sollte es unter adäquater Therapie zu einem deutlichen Abfall der Bakterienlast und des PGL-1-Titers kommen.
Resistenz
Bei Verdacht auf Resistenzbildung oder Therapieversagen kann zur weiteren Abklärung eine molekular-genetische Viabilitätstestung oder Resistenztestung durchgeführt werden. Die RLEP/16S rRNA RT qPCR ist eine Methode zur Bestimmung der Viabilität von Mycobacterium leprae. Hierfür können Skin Smears, Abstriche aus den Nasenvorhöfen oder Hautbiopsien verwendet werden. Eine positive Amplifikation weist darauf hin, dass lebensfähige Mycobacterium leprae Erreger in der ursprünglichen Probe vorhanden sind. Ein negatives Ergebnis deutet darauf hin, dass die lebensfähigen Erreger möglicherweise nicht in ausreichender Menge vorhanden sind bzw. nicht mehr replikationsfähig sind. Ergänzend hierzu kann in Speziallabors eine molekulargenetische Resistenztestung zum Beispiel zum Nachweis einer Resistenz gegenüber Rifampicin erfolgen.
1 Epidemiologisches Bulletin 46/2023. November 2023.
2 Global leprosy (Hansen disease) update, 2022: new paradigm – control to elimination
3 Fischer M. Lepra – Ein Überblick über Klinik, Diagnose und Therapie. J Dtsch Dermatol Ges 2017;15:801-829.
4 Beissner M, Woestemeier A, Saar M, Badziklou K, Maman I, Amedifou C, Wagner M, Wiedemann FX, Amekuse K, Kobara B, Herbinger K-H, Kere AB, Löscher T, Bretzel G. Development of a combined RLEP/16S rRNA (RT) qPCR assay for the detection of viable M. leprae from nasal swab samples. BMC Infect Dis 2019;19:753.
5 Suryawati N, Saputra H. Erythema Nodosum Leprosum Presenting as Sweet’s Syndrome-Like Reaction in a Borderline Lepromatous Leprosy Patient. The International Journal of Mycobacteriology 2018;7:191.
6 Guidelines for the diagnosis, treatment and prevention of leprosy. New Delhi: World Health Organization, Regional Office for South-East Asia; 2017. Licence: CC BY-NC-SA 3.0 IGO.
7 Rao PN, Suneetha S, Pratap DVS. Comparative study of uniform-MDT and WHO MDT in Pauci and Multi bacillary leprosy patients over 24 months of observation. Lepr Rev 2009;80:143-155.
8 Leprosy/Hansen Disease: Management of reactions and prevention of disabilities. Technical guidance. New Delhi: World Health Organization, Regional Office for South-East Asia; 2017. Licence: CC BY-NC-SA 3.0 IGO.
9 Kaur I, Dogra S, Narang T, De D. Comparative efficacy of thalidomide and prednisolone in the treatment of moderate to severe erythema nodosum leprosum: a randomized study. Australas J Dermatol 2009;50:181-185.
Kasuistik
Sweet’s
like Syndrom als Erstmanifestation einer multibazillären,
lepromatösen Lepra mit begleitender Typ-2-Reaktion
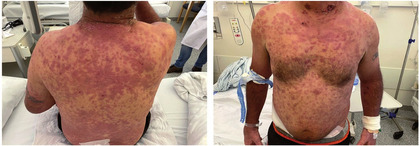
Abb. 1 Hautmanifestation bei Erstvorstellung: Papeln und erythematöse, ödematöse Plaques am Rumpf
Im September 2021 wurde ein 51-jähriger Mann von einer externen Klinik zur weiteren Abklärung einer seit drei Wochen bestehenden Fiebersymptomatik mit Nachtschweiß, schmerzhafter inguinaler und axillärer Lymphknotenvergrößerung und auffälligem Hautexanthem in unsere Klinik verlegt. Das Exanthem bestand am gesamten Rumpf und den Extremitäten in Form von lividen, erythematösen, feuchten Plaques mit partieller Blasenbildung am Hals (Abb. 1). Vorerkrankungen waren keine bekannt. Er war kurz zuvor von Brasilien nach Deutschland gezogen.
Laborbefund
Im Labor wurde eine signifikante Leukozytose von 24,29 G/l mit einem hohen Neutrophilenanteil von 92% festgestellt. Das C-reaktive Protein betrug 24,8 mg/dl. Zusätzlich zeigte sich ein grenzwertig erhöhtes Procalcitonin von 0,5 ng/ml, eine LDH von 330 U/l und Gamma-GT von 101 U/l. Hinweise für eine HIV-Infektion lagen nicht vor. Die Blutkulturen verblieben steril. Die PCR einer bronchoalveolären Lavage war negativ für Mycobacterium tuberculosis.
Diagnostik
Computertomographisch zeigte sich neben einer pathologischen axillären und inguinalen Lymphknotenvergrößerung eine Kaverne im rechten Lungenunterlappen.
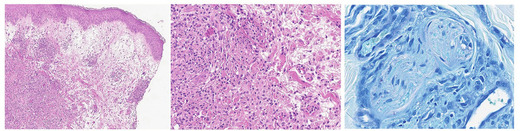
Abb. 2a, b, c Die Hautbiopsie zeigt ein ausgeprägtes Ödem der papillären Dermis mit oberflächlichen und tiefen entzündlichen Infiltraten, die reich an Histiozyten und Neutrophilen sind (Hämatoxylin und Eosin, 4x, 100x), sowie einzelne säurefeste Stäbchen um einen Nerven (Ziehl-Neelsen-Färbung 400x)
Zur weiteren Abklärung wurde eine Hautbiopsie einer exanthematösen Läsion in der Leiste entnommen, welche histologisch den Befund eines oberflächlichen dermalen Ödems mit dermaler Infiltration durch neutrophile Granulozyten, Histiozyten und Lymphozyten erbrachte (Abb. 2a, b, c). Die Zusammenschau von Morphologie und Klinik erbrachte somit den Verdacht auf eine akute febrile neutrophile Dermatose (Sweet-Syndrom). Es wurde eine immunmodulatorische Behandlung bestehend aus Prednisolon (1 mg/kg) initiiert, worunter der Patient afebril wurde und die Hautläsionen innerhalb weniger Tage abblassten. Zur weiterführenden Abklärung der zugrundeliegenden Genese des Sweet-Syndroms erfolgte eine Knochenmarkspunktion mit unauffälligem histopathologischem Befund, speziell ergab sich kein Hinweis auf eine hämatologische Neoplasie.
Histologe
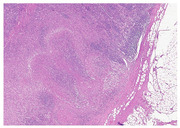
Abb. 3 Granulomatöse nekrotisierende Lympha- denitis (Hämatoxylin und Eosin, 4x)
Die
Untersuchung eines exstirpierten inguinalen Lymphknotens hingegen
erwies sich als ätiologisch richtungsweisend mit dem Befund einer
granulomatösen nekrotisierenden Lymphadenitis (Abb. 3) mit Nachweis
von
Mykobakterien. Während die PCR für Mycobacterium
tuberculosis-Komplex negativ war, zeigte sich ein positives Ergebnis
für nicht-tuberkulöse Mykobakterien. Die Sequenzierungsanalyse
erbrachte eine 100% Übereinstimmung mit Mycobacterium leprae. Mit
der Frage nach einer kutanen Beteiligung der Lepra wurde das
Hautbiopsat nachträglich mittels Ziehl-Neelsen-Färbung untersucht
und hierbei einzelne säurefeste Bakterien, u.a. in Assoziation zu
einem peripheren Nerven, nachgewiesen (Abb. 2c). In Zusammenschau war
somit von einer Typ-2-Reaktion bei lepromatöser Lepra auszugehen.
Die
immunmodulatorischen Behandlung der Typ-2-Reaktion mit Prednisolon
(60 mg täglich, entsprechend
1 mg/kg/Tag) wurde daraufhin
durch eine Lepra-spezifische Tripletherapie ergänzend, bestehend aus
Rifampicin (600 mg 1x pro Monat), Clofazimin (300 mg 1x pro Monat und
50 mg täglich) und Dapson (100 mg täglich).
Angesichts der hohen Erregerlast und des ausgeprägten klinischen Befundes bestanden die von uns ergriffenen hygienischen Maßnahmen bei unserem Patienten darin, während der ersten Therapiewoche einen Mund-Nasenschutz zu tragen.
Zur Abklärung einer Nervenbeteiligung erfolgte eine konsiliarische Vorstellung in der Neurologie, wobei klinisch keine Neuropathie festgestellt werden konnte. Nach 10-tägiger stationärer Behandlung wurde der Patient in deutlich gebessertem Allgemeinzustand in die ambulante Weiterbehandlung entlassen mit der Empfehlung, die Lepra-Therapie sowie Prednisolon unverändert weiter einzunehmen.
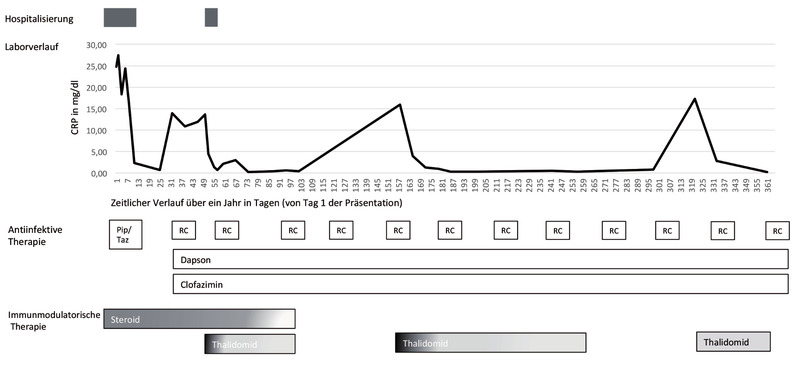
Abb. 4 Schematische Darstellung der ersten 365 Tage ab Erstvorstellung mit CRP- und Therapieverlauf; CRP: C-reactives Protein; R/C: Rifampicin/Clofazimin 1x/Monat; Pip/Taz: Piperacillin/Tazobacta
Weiterer Verlauf
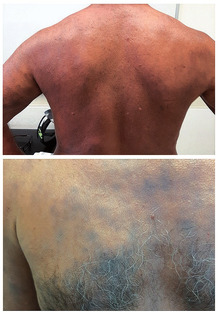
Abb. 5 Patient nach einem Jahr Therapie
Zwei Wochen nach Entlassung stellte sich der Patient erneut mit Fieber, massiver Exazerbation der Hautläsionen und deutlichem Wiederanstieg der Infektparameter unter der Fortführung der Prednisolontherapie (60 mg pro Tag) in unserer Ambulanz vor. Aufgrund des steroidrefraktären Verlaufs der Typ-2- Reaktion wurde eine Therapie mit Thalidomid (300 mg/Tag) eingeleitet, hierunter zeigte sich ein rasches klinisches Therapie-Ansprechen inklusive rückläufigen Entzündungswerten. Infolgedessen konnte die Behandlung mit Thalidomid zeitnah über drei Wochen auf eine Dosis von 100 mg reduziert und im Verlauf auf eine Erhaltungsdosis (50 mg/Tag) umgestellt werden.
Im darauffolgenden Jahr wurden wiederholt Versuche unternommen, die Thalidomid-Erhaltungsdosis zu beenden. Jedoch führte jeder dieser Versuche trotz Dosiserhöhung von Clofazimin auf 100 mg unmittelbar zu einem Relapse, sodass die Erhaltungstherapie mit Thalidomid über ein Jahr fortgesetzt werden musste (Abb. 4). Aufgrund dieses prolongierten Verlaufs und eines nicht rückläufigen Antikörpertiters gegen Phenolisches-Glykolipid-1 erfolgten wiederholt Nasenabstriche und Hautbiopsien. Die molekularen Viabilitäts- und Resistenztestungen ergaben jedoch keine Hinweise für ein Therapieversagen. Infolge des komplizierten Verlaufs wurde die Lepra-spezifische Behandlung auf insgesamt 2 Jahre verlängert. Inzwischen ist der Patient beschwerdefrei (Abb. 5).
1 Department of Internal Medicine II, School of Medicine, University Hospital rechts der Isar, Technical University of Munich, Munich, Germany
2 Division of Infectious Diseases and Tropical Medicine, University Hospital, Ludwig-Maximilians-University (LMU) Munich, Leopoldstrasse 5, 80802 Munich, Germany
3 Ludwig-Maximilians-University (LMU) Munich, Geschwister-Scholl-Platz 1, 80337 Munich, Germany
4 Université de Paris, INSERM, IAME, UMR 1137, AP-HP, GHU Nord, service de Mycobactériologie spécialisée et de référence, laboratoire associé au Centre National de Référence des Mycobactéries et de la Résistance des Mycobactéries aux Antituberculeux, 75018 Paris, France
5 Department of Tropical Medicine, Missioklinik, Klinikum Würzburg Mitte, Würzburg, Germany
6 Institute for Pathology, Technische Universität München, Munich, Germany; MTBio-Biobank of Technische Universität München and University Hospital Klinikum rechts der Isar, Munich, Germany
Auf
dem Weg zu „Null Lepra weltweit“
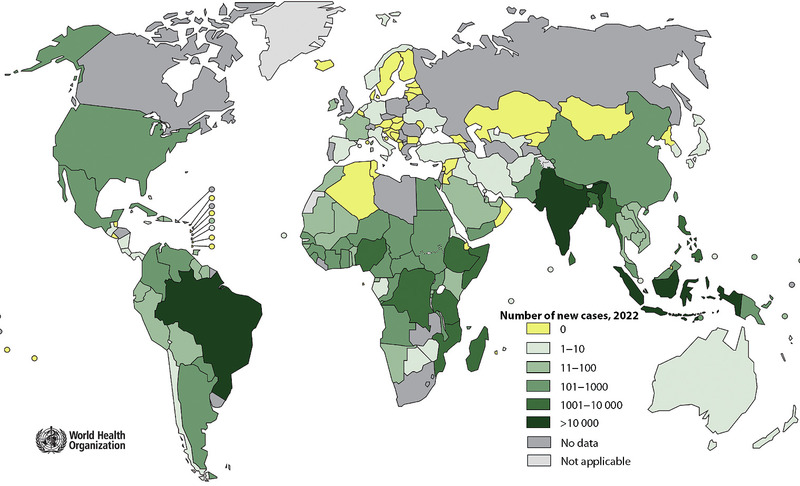
Lepra ist eine „neglected tropical disease“ (NTD), die in mehr als 120 Ländern vorkommt. Jährlich werden rund 200.000 Neuinfektionen gemeldet. Die „Elimination“ der Lepra als weltweites Gesundheitsproblem (definiert als eine Prävalenz von weniger als ein Fall pro 10.000 Personen) wurde im Jahr 2010 erreicht. Der Rückgang der Infektionszahlen erfolgte kontinuierlich und weltweit. 2019 meldeten 45 Länder keine Neuinfektion, 99 Länder weniger als 1.000 neue Fälle. In 13 Ländern allerdings wurden 1.000 bis 10.000 Neuinfektionen beobachtet. Daher hat die WHO in den Jahren 2019/20 – ähnlich wie bei Hepatitis C und HIV – in Zusammenarbeit mit vielen Organisationen eine Strategie entwickelt mit dem Motto “Towards zero leprosy – The Global Leprosy Strategy 2021-2030”. Es gibt vier zentrale Bereiche:
1. Implemetierung einer integrierten, landestypischen “Zero Leprosy Roadmap“ in allen endemischen Ländern
2. Intensivierung von Prävention und Diagnostik
3. Behandlung der Erkrankung und ihrer Komplikationen, um Behinderung zu verhindern
4. Stigma bekämpfen, Menschenrechte sichern und Transmissionen verhindern
Hilfe
aus Deutschland
Die Anstrengungen der WHO und der beteiligten Länder werden von der internationalen Webseite Infolep (https://www.leprosy-information.org) unterstützt. Dort findet man ausführliche Informationen inklusive aktuelle wissenschaftliche Artikel und verschiedene Hilfsmaterialien. Finanziell wird die Webseite von neun Hilfsorganisationen finanziert. Eine davon ist die Deutsche Lepra- und Tuberkulosehilfe e.V. (DAHW). 1957 wurde der Verein als „Deutsches Aussätzigen-Hilfswerk“ gegründet und 2003 in „Deutsche Lepra- und Tuberkulosehilfe“ (https://www.dahw.de/) umbenannt. Ausgangspunkt war der Bericht eines deutschen Journalisten, der mithilfe von Würzburgern zum Aufbau einer Leprastation in Äthiopien und Vereinsgründung führte. Heute finanziert der Verein in 21 Ländern auf vier Kontinenten verschiedene medizinische, wissenschaftliche und soziale Projekte für Menschen, die von Lebens- und Arbeitsbedingungen besonders anfällig für Erkrankung sind und unter Folgen wie Ausgrenzung und Diskriminierung leiden. Finanziert wird die DAHW durch Spenden, die Ruth-Pfau- und Hermann-Kober-Stiftung.