Doris Hillemann, Elvira Richter, Ulf Greinert, Borstel
Tuberkulose (TB)
Aktuelle Beiträge zum Thema:
Die Tuberkulose (TB) gehört nach Schätzungen der Weltgesundheitsorganisation (WHO) mit HIV/AIDS und Malaria nach wie
vor zu den weltweit häufigsten Infektionskrankheiten. Für das Jahr 2007 schätzt die WHO etwa 9,3 Millionen
Neuerkrankungen (Abb. 1). Schwerpunkte der TB-Epidemie sind Asien und Afrika, wo zusammen ungefähr 86% aller TB-Fälle
auftraten. Etwa 1,3 Millionen HIV-negative Patienten und weitere 456.000 HIV-positive Patienten sind 2007 an TB
verstorben.1 In afrikanischen Ländern ist die Koinfektion mit HIV die Ursache für die hohen Fallzahlen (Abb.
2, HIV-Prävalenz von 50 bis 70% bei TB-Fällen). TB ist damit auch die häufigste Todesursache unter HIV-Patienten in
Afrika.
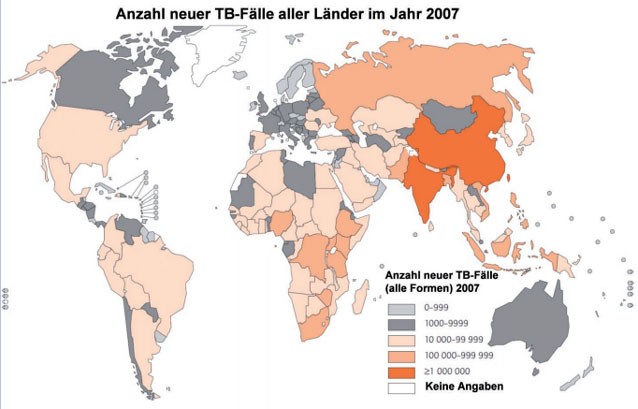
StäbAbb. 1: Anzahl der neuen TB-Fälle im Jahr 2007 (modifiziert nach http://www.who.int/tb/publications/global_report/2009/en/index.html,
WHO 2009)
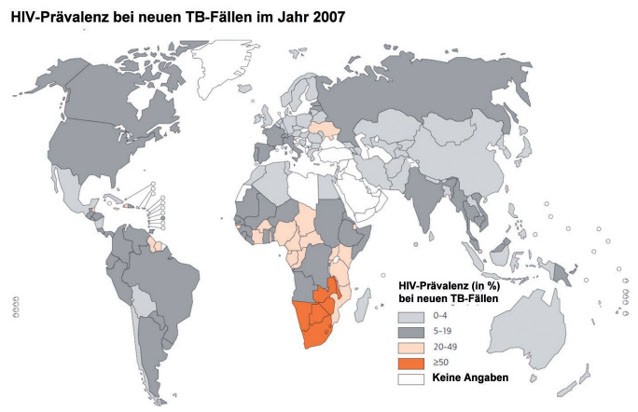
Abb. 2: Weltweite HIV-Prävalenz bei neuen TB-Fällen im Jahr 2007 (modifiziert nach
http://www.who.int/tb/publications/global_report/2009/en/index.html,
WHO 2009)
In Europa zeigt sich ein ausgeprägtes Ost-West-Gefälle.2 In Westeuropa (EU- und westliche Länder) wird seit Jahren eine rückläufige Tendenz der TB-Häufigkeit beobachtet. Im Gegensatz dazu steigen die Fallzahlen in den Ländern der früheren Sowjetunion an, wobei Inzidenzraten bis zu 282/100.000 (Kasachstan) notiert wurden. Die Entwicklung resistenter Stämme führt in Osteuropa zu einer besonders problematischen Situation. Auch hier wird eine Zunahme der HIV/TB-Koinfektion beobachtet, welche die Problematik weiter verschärfen wird. Insgesamt entfallen auf Europa ca. 5% der weltweit auftretenden TB-Neuerkrankungen.
In Deutschland wurden im Jahr 2007 5.020 TB-Neuerkrankungen gemeldet, was einer Inzidenz von 6,1/100.000 entspricht (3, http://www.rki.de). Seit Jahren ist in Deutschland – wie auch in den anderen EU-Staaten – ein rückläufiger Trend zu beobachten (2006: 5.402 Neuerkrankungen, Inzidenz: 6,6).
Seit einigen Jahrzehnten wird die Entwicklung von resistenten TB-Stämmen beobachtet, vor allem die multiresistente (MDR)-TB, definiert als Resistenz gegenüber mindestens Isoniazid (INH) und Rifampicin (RMP). Die Weltgesundheitsorganisation schätzt in den aktuellen Berechnungen (WHO 2009; http://www.who.int/tb/challenges/hiv/factsheet_hivtb_2009.pdf), dass im Jahr 2007 ca. 511.000 neue MDR-TB-Fälle unter allen TB-Fällen auftraten. Unter den von MDR-TB besonders betroffenen Ländern befinden sich insbesondere Indien und China, denn ca. 50% aller MDR-TB- werden in allein diesen beiden Ländern gefunden (4, WHO/HTM/TB/2008.394). Einen weiteren Schwerpunkt resistenter TB bilden die Länder der ehemaligen Sowjetunion mit etwa 7% aller MDR-TB Fälle. In einzelnen Regionen werden hier hohe Raten von 22% MDR-TB unter neuen Fällen gefunden. Die Raten bei Patienten mit vorheriger medikamentöser Therapie sind noch höher einzuschätzen.4 Im Jahr 2007 sind in Deutschland 66 Patienten (2,0%) gemeldet worden, die mit MDR-Stämmen erkrankt waren; 2006 waren es 79 Fälle (2,2%).3
In jüngster Zeit wurden erstmalig sogar TB-Infektionen beschrieben, bei denen die MTB-Stämme auch gegenüber Fluorchinolonen und zusätzlich einem der injizierbaren Medikamente Amikacin, Capreomycin oder Kanamycin resistent waren. Die Weltgesundheitsorganisation (WHO) hat diese Bakterienstämme als „extensively-drug-resistant“ (XDR) klassifiziert (http://www.who.int/tb/xdr/faqs/en/index.html). Inzwischen wird das Auftreten von XDR-TB-Stämmen in mehr als 55 Ländern der Welt bestätigt.
Klinik der Tuberkulose
Die TB ist eine chronisch verlaufende Infektionskrankheit, die durch Bakterien des Mycobacterium tuberculosis-Komplexes (M. tuberculosis, M. africanum, M. bovis mit den beiden Subspezies bovis und caprae, der Impfstamm BCG, M. microti, M. pinnipedii, „M. canetti“) hervorgerufen wird und vorwiegend in der Lunge lokalisiert ist.
Die Übertragung erfolgt durch Tröpfcheninfektion beim Husten, Niesen und Sprechen. Der Zeitraum zwischen Infektion und klinisch erkennbarer Erkrankung kann mehrere Jahre oder auch Jahrzehnte betragen, häufig setzt die Erkrankung innerhalb der ersten beiden Jahre nach Infektion ein. Für HIV-infizierte Patienten ist die Erkrankungswahrscheinlichkeit um den Faktor 20-30 höher als bei HIV-negativen Personen.
Obwohl alle Organsysteme von einer TB betroffen sein können, ist die Lunge die häufigste Manifestation der TB, gefolgt von Lymphknoten, Pleura, Urogenitaltrakt, Knochen und Gelenken. Extrapulmonale TB (Lymphknoten, Urogenitalsystem, Knochen, Gelenke, Verdauungsorgane) kann nur infektiös sein, wenn der Krankheitsherd einen Kontakt nach außen erhält.
Das Krankheitsbild ist zunächst uncharakteristisch und symptomarm. Mögliche allgemeine Symptome sind Gewichtsabnahme, Appetitmangel, Müdigkeit, vermehrtes Schwitzen (vor allem nachts) und erhöhte Temperaturen. Respiratorische Beschwerden können in Form von andauerndem Husten, gegebenenfalls mit (blutigem) Auswurf, Thoraxschmerzen oder Atemnot auftreten.
Bei Verdacht auf Lungen-TB müssen differentialdiagnostisch vor allem eine Sarkoidose (Morbus Boeck), Tumor der Lunge und andere bakterielle oder granulomatöse Erkrankungen abgegrenzt werden.
Diagnostik – alte und neue Methoden
Weltweit wird der Erregernachweis auch heute noch häufig ausschließlich mikroskopisch nach Anfärbung säurefester Stäbchen geführt, eine Methode, die zwar kostengünstig und schnell ist, aber vergleichsweise wenig sensitiv und keine Resistenztestung erlaubt. Kulturelle Verfahren sind deutlich sensitiver, die Diagnose einer TB und die sich daran anschließende Resistenztestung allerdings langwierig (bis zu 10 Wochen). Da auch in Deutschland zunehmend resistente Stämme isoliert werden3, muss bei jedem Erstnachweis von TB-Bakterien eine Empfindlichkeitsprüfung durchgeführt werden. Auch bei einem Ausbleiben des Therapieerfolges nach 2 - 3 Monaten muss erneut eine Prüfung erfolgen. Zunächst werden die Erstrangmedikamente Isoniazid, Rifampicin, Pyrazinamid (PZA), Streptomycin (SM) und Ethambutol (EMB) geprüft. Bei vorliegenden Resistenzen werden weitere Zweitrang- oder Reserveantibiotika getestet, für deren Testung erst kürzlich Protokolle ergänzend publiziert wurden.5
Die Einführung einer schnelleren Diagnostik zur Identifizierung resistenter TB-Stämme mit dann frühzeitiger Isolierung der Patienten mit MDR/XDR-TB ist als wichtiges Ziel bei der Bekämpfung der TB erkannt worden. Dies ist mit molekularbiologischen Techniken möglich. Basis dieser Methoden ist die Kenntnis der Assoziation spezifischer Mutationen in bestimmten Genen mit der entsprechenden Antibiotikaresistenz.6 Die Analyse der Mutationen kann prinzipiell mit verschiedenen Techniken durchgeführt werden (Sequenzierung, real-time PCR, Streifenhybridisierungsverfahren, u.a.). Eine aktuelle Meta-Analyse berechnete die Sensitivität der Streifentests für Detektion von RMP-Resistenz mit 98,1%, die Spezifität mit 98,7%, für INH wurde je nach untersuchter Testregion eine höhere Variabilität und niedrigere Sensitivität (84,3%) bei hoher Spezifität (99,5%) berechnet.7
Ein weiteres molekularbiologisches Verfahren zur Testung von „second-line“ Antibiotika ist seit kurzem erhältlich, das die Fluorquinolone und die injizierbaren Medikamente Amikacin, Capreomycin und Kanamycin einschließt.8
Mit Hilfe von immunologischen Verfahren kann der spezifische Kontakt eines Patienten mit TB-Erregern (latente TB) nachgewiesen werden (Tab. 1). Der Tuberkulin-Hauttest nach Mendel-Mantoux war lange Zeit das einzig verfügbare Verfahren. Da jedoch die in diesem Test verwendeten Antigene mit dem Impfstamm BCG und einigen nicht-tuberkulösen Mykobakterienarten (NTM) kreuzreagieren, kann eine latente TB nicht von einer vorausgegangenen BCG-Impfung bzw. einer Infektion mit NTM unterschieden werden. Neuere immunologische Verfahren basieren dagegen auf dem Nachweis der Freisetzung von Interferon-? durch sensibilisierte T-Lymphozyten. Bei den als ‚Interferon-?-Release Assays“ (IGRAs) bezeichneten Verfahren werden die humanen Lymphozyten durch spezifische Peptide (ESAT6, CFP 10) stimuliert und anschließende ihre IFN-?-Produktion bestimmt.9 Die zur Stimulation verwendeten Peptide sind beim Impfstamm BCG und den meisten nicht-tuberkulösen Mykobakterienarten nicht vorhanden, so dass eine vorausgegangene Impfung oder Infektion mit NTM den Test nicht beeinflussen kann. Auch bei Patienten mit HIV-Infektion können IGRAs eingesetzt werden (Tab. 1). Ein negativer Testausfall darf nicht, insbesondere aber nicht bei CD-4-Zellzahlen < 200 als Ausschluss einer TB-Infektion angesehen werden. Bei HIV-seropositiven Patienten mit tuberkulöser Exposition sollten diese Tests regelmäßig angewendet werden, um Hinweise für das Vorliegen einer latenten TB-Infektion zu bekommen. Abschließende Empfehlungen zum Einsatz von IGRAs zur Diagnose der latenten TB bei HIV-seropositiven Patienten stehen noch aus.
| Methode | Vorteile |
Nachteile |
Dauer/ Befunderhebung |
Klinischer Stellenwert |
|
|---|---|---|---|---|---|
| THT | Hautinduration nach Injektion von Tuberkulin intrakutan | Preiswert Langjährige Erfahrung Einzige Methode mit klinisch validierten Daten zur Entwicklung einer aktiven TB bei LTBI |
Falsch pos. Ergebnisse bei BCG -geimpften Personen Sensitivität bei Immunsupp- rimierten deutlich eingeschränkt Wiederholter Patientenkontakt nötig |
48-72 h | Zur LTBI -Diagnose in Niedrginzidenz-Ländern der TB bei Immunkompetenten ohne BCG -Impfung noch empfohlen |
| TIGRA | ELISA: IFN-γ-Nachweis aus ESAT ESAT-6, CFP-10 und TB 7,7 stimuliertem Vollblut |
Sehr hohe Spezifität (ELIS pot <ELISA ) Hohe Sensitivität (ELIS pot >ELISA ) Hohe Sensitivität bei HIV -Infizierten mit relativ hoher CD -4 Zellzahl (ELISpot >ELISA ) ELISPOT mit Sensitivität >THT bei Kindern |
Im Blut keine Differenzierung zwischen aktiver und LTBI möglich Teurer als THT |
1 Tag | ELISA und ELISpot ersetzen den THT zunehmend im klinischen Alltag |
| |
ELISpot: IFN-γ-Nachweis in ESAT-6 und CFP-10 stimulierten MNZ (aus Venenblut) |
Optimierte Differenzierung aktiver TB versus LTBI durch Vergleich peripherer/lokaler Immunantwort im ELISpot |
Aufwendige Laboruntersuchung (ELISpot >ELISA ) |
1Tag | Nachweis der lokalen Immunantwort zur raschen TB -Diagnose aus BAL , Pleuraerguss, Aszites und Liquor im ELISpot |
Tab. 1: Vergleich von Tuberkulinhauttest (THT) und T-Zell Interferon-γ Release Assays (TIGRA): ELISA und ELISpot
TB-Therapie
Leitlinien zur Therapie der TB sind national und international publiziert und bilden auch die Grundlage der nachfolgenden Darstellung.10,11 Sie umfassen alle Aspekte der TB-Therapie, daher wird nachdrücklich das Studium dieser Publikationen empfohlen.
Die erfolgreiche Behandlung der TB erfordert die kombinierte Gabe mehrerer Medikamente (Tab. 1 und 2). Diese
Notwendigkeit gründet sich auf die modellhaften Überlegungen, dass bei einer kavernösen Lungen-TB zumindest drei
unterschiedliche Bakterienpopulationen mit unterschiedlichem Wachstumsverhalten in unterschiedlichen Kompartimenten mit
jeweils differentem pH-Wert vorliegen. Die Bakterizidie der Antituberkulotika INH, RMP und PZA ist gegenüber den
jeweiligen Populationen im jeweiligen Milieu unterschiedlich stark ausgeprägt, wobei INH die größte bakterizide
Aktivität gegenüber schnell proliferierenden Keimen in Kavernen besitzt, PZA im sauren Milieu der Makrophagen am
stärksten bakterizid wirkt und RMP eine sterilisierende Wirkung im Hinblick auf Bakterienpopulationen mit niedrigem
Metabolismus zugeschrieben wird. RMP hat darüber hinaus wahrscheinlich auch die größte Potenz, eine Resistenzentstehung
zu verhindern. Durch die Kombinationstherapie wird eine schnelle Reduktion der Bakterienpopulation meist innerhalb von 2
Monaten erreicht, sofern keine resistenten Erregerpopulationen vorhanden sind (Tab. 2).
| Initialphasse | Stabilisierungsphase | |||
| Indikation |
Dauer in Monaten |
Medikamente |
Dauer in Monaten |
Medikamente |
|---|---|---|---|---|
| Neue mikroskopisch oder kulturell positive Fälle |
2 | INH, RM P, PZA, EMB | 4 | UINH, RMP |
| Kulturell negative Fälle | 2 | INH, RM P, PZA, EMB | 4 | INH, RMP |
| INH - Intoleranz | 2 | RMP, EMB , PZA | 7 | RMP, EMB |
| RMP - Intoleranz | 2 | INH, EMB , PZA, SM | 16 | INH, EMB |
| PZA - Intoleranz |
2 | INH, RMP, EMB |
7 | INH, RMP |
| NH – Isoniazid; RMP – Rifampicin; PZA – Pyrazinamid, EMB – Ethambutol; SM – Streptomycin | ||||
Tab. 2: Standardtherapie der Tuberkulose
Die medikamentöse Behandlung der TB erfolgt in Deutschland wie auch sonst in Europa im Regelfall als Kombinationstherapie unter Einsatz der vier so genannten Erstrang- oder Standardmedikamente INH, RMP, PZA und EMB über die Initialphase von 2 Monaten. Sollten vor Ablauf der Initialphase die Ergebnisse der Empfindlichkeitstestung des jeweiligen TB-Stamms vorliegen, kann bei fehlendem Nachweis von Resistenzen die EMB- und PZA-Medikation zu diesem Zeitpunkt beendet werden. Es schließt sich dann in der Kontinuitätsphase eine tägliche Behandlung mit RMP und INH über 4 Monate an. Die Therapiedauer bleibt auf 6 Monate begrenzt, sofern bei dokumentierter röntgenologischer Rückbildung auch bakteriologisch nach der 2-monatigen Initialphase keine positiven kulturellen Befunde mehr vorliegen. Die Gesamttherapiedauer von 6 Monaten ist auch erforderlich, wenn keine bakteriologische Diagnosesicherung erfolgen konnte und nur röntgenologische oder histomorphologische Kriterien zur Diagnose einer TB beigetragen haben. In der Initialphase sind die Antituberkulotika täglich zu applizieren, in der Kontinuitätsphase verspricht eine intermittierende Therapie (2- oder 3-mal wöchentliche Einnahme) oder die Einnahme an 5 Tagen in der Woche (Mo bis Fr) vergleichbare Heilungsraten (Evidenzgrad A I bei HIV-negativen und A II bei HIV-positiven Patienten).
Von der intermittierenden Medikamentenapplikation sollte nur dann Gebrauch gemacht werden, wenn sich die tägliche Gabe aus Gründen mangelnder Compliance des Patienten nicht realisieren lässt oder eine täglich überwachte Medikamenteneinnahme aus anderen Gründen nicht möglich ist.
Die Hoffnungen, durch den Einsatz von Fluorchinolonen wie z.B. Moxifloxacin in der Therapie der sensiblen TB eine Verkürzung der Behandlungsdauer erzielen zu können, haben sich bisher nicht erfüllt. Allerdings konnten in einer Studie die antituberkulösen Effekte und die gute Verträglichkeit des Präparates dokumentiert werden.12
| tägliche Einnahme | intermittierende Einnahme | ||||
| Substanz |
Dosis (mg/kg KG) |
Minimal- und Maximaldosis in mg |
Dosis in mg/kg KG Minimal und Maximal |
Minimale und maxi- male Tagesdosis |
|
|---|---|---|---|---|---|
| 3x/Woche | 2x/Woche | ||||
| Isoniazid | 5 | 200-300 | 10-15 | 15 | 900 |
| Rifampicin | 10 | 450-600 | 10 | 10 | 600 |
| Pyrazinamid | 25 | 1.500-2.500 | 35 | 50 | 2.500 - 3.500 |
| Ethambuol | 15-25 | 800-2.000 | 30 | 45 | 2.500 |
| Streptomycin | 15 | 600-1.000 | 15 | 15 | 1.000 |
| Substanz |
Dosis |
Höchstdosis in mg |
intermittierende Dosis (3 x wöchentlich) in mg/kg KG |
|
|---|---|---|---|---|
| Isoniazid | 200 mg/m2 KOF | 300 | 15 | KG - Körpergewicht |
| Rifampicin | 350 mg/m2 KOF | 600 |
15 | |
| Pyrazinamid | 30 mg/kg KG | 1.500 | 50 | |
| Ethambuol | 850 mg/m2 KOF | 1.600 | 30 | |
| Streptomycin | 20 mg/kg KG | 750 | 20 | |
Tab. 3a und b: Dosierung der Standardmedikamente; a: Erwachsend, b: Kinder
Die Tagesdosen der Standardantituberkulotika (Tab. 3) werden üblicherweise per os morgens gleichzeitig vor dem Frühstück eingenommen, um synergistische Effekte ausnutzen zu können und eine optimale Resorption zu gewährleisten. Bei Unverträglichkeit einer Standardtherapie aus hepatischer Ursache oder bei gleichzeitig bestehender Lebererkrankung sollte auf zumindest eine, ggf. zwei hepatotoxische Substanzen verzichtet werden (Tab. 4). Mögliche Medikamentenkombinationen können INH/EMB oder RMP/EMB jeweils mit oder ohne zusätzlich Gabe eines Fluorchinolons umfassen. Ein weiteres nicht hepatotoxisches Medikament, wenn auch mit geringerer antituberkulöser Potenz, ist das Terizidon.
| Substanz | UAW | ||
|---|---|---|---|
| Häufige |
Selten |
Sehr selten |
|
| Isoniazid | Transaminasenerhöhung, Akne |
Hepatitis, kutane UA W, Polyneuropathie |
Krampfanfälle, Vertigo, Optikus-Neuritis, Bewusstseinsstörungen, hämolytische und aplastische Anämioe, Agranulozytose, Lupus-Reaktion, Arthralgien, Gynäkomastie |
| Rifampicin | Transaminasenerhöhung, Cholestase, Rotfärbung von Körperflüssigkeiten (Kontaktlinsen) |
Hepatitis, UA W, Übelkeit, Thrombopenie, Fieber, „Flu-like“- Syndrom |
Anaphylaxie, hämolytische Anämie, akutes Nierenversagen, Wirkungen auf das zentrale und peripheres Nervensystem (Müdigkeit, Kopfschmerzen, Benommenheit, Vertigo, Ataxie, Verwirrtheit, Adynamie, Sehstörungen), |
| Pyrazinamid | Transaminasenerhöhung, Übelkeit, Erbrechen, Flush-Syndrom, Myopathie, Arthralgie, Hyperurikämie |
Hepatitis, kutane UA W | Gicht, Photosensibilisierung, sideroblastische Anämie |
| Ethambutol | |
Retrobulbäre Neuritis, Arthralgie, Hyperurikämie |
Kutane UA W, Transaminasenerhöhung, Polyneuropathie |
| Streptomycin | |
Gleichgewichtsstörungen, Tinnitus, Hörverlust, kutane UA W |
Nierenfunktionseinschränkungen, Agranulozytose, aplastische Anämie; Anaphylaxie, neuromuskuläre Blockade, Atemdepression, Parästhesien, Dermatitis exfoliativa, Kontaktallergie (Pflegepersonal) |
Tab. 4: Wichtige unerwünschte Arzneimittelwirkungen (UAW) der Standardmedikamente
Medikamenteninteraktionen sind insbesondere unter RMP-Medikation zu beachten und führen zu einer Erniedrigung der Serumkonzentrationen vieler Medikamente, während INH zur Kumulation einzelner Medikamente (z.B. Antiepileptika) beiträgt (Tab. 5).
| Substanz |
Spiegel erhöht durch |
Spiegel gesenkt durch |
erhöht den Serumspiegel von |
senkt den Serumspiegel von |
|---|---|---|---|---|
| Isoniazid | Prednisolon Protionamid (PTH) |
|
Phenytoin Carbamazepin Cumarinen Diazepam Protionamid (PTH) |
Enfluranen Azolen |
| Rifampicin | Cotrimoxazol | Paraaminosalicylsäure (PAS ) Ketokonazol |
|
Cumarinen Azolen Oralen Kontrazeptiva Glukokortikoiden Diazepam Phenytoin Theophyllin Digoxin Digitoxin Methadon Protease-Inhibitoren Ciclosporin |
| Ethambutol | |
Antacida | |
|
Tab. 5: Arzneimittelinteraktionen der Standardmedikamente
Therapie bei HIV-Koinfektion
Die gleichzeitige Behandlung einer TB und HIV-Infektion ist eine Herausforderung, da mit Arzneimittel – Wechselwirkungen, Toxizität der Arzneimittel und unter Therapie mit Verschlechterung der klinischen Symptome durch die verbesserte zelluläre Immunität (Immunrekonsitutionssyndrom/IRIS) gerechnet werden muss.11 Insbesondere der Interaktion von RMP und Protease-Inhibitoren (PI) und nichtnukleosidische Inhibitoren der reversen Transkriptase (NNRTI) muss Rechnung getragen werden. Wenn RMP trotzdem eingesetzt werden soll, dann sollte auf PIs und NNRTIs verzichtet werden. Bei Ersatz von RMP durch Rifabutin sollte ein spezieller Therapieplan aufgestellt werden, je nachdem, ob die Substanz über den gesamten Therapiezeitraum oder nur ab dem 3. Monat eingesetzt wird. PI sind in Kombination mit Rifabutin möglich, allerdings unter Beachtung eventuell veränderter Dosierungen.
Welche der Therapieoptionen ausgewählt wird, ist schwierig zu entscheiden, da Vor- und Nachteile gewichtet werden müssen. Beispielsweise ist zu beachten, dass bei Wegfall von RMP, einem hoch potenten Antibiotikum der TB-Therapie, sich die Therapiezeiten verlängern (s. auch Tab. 2). Beim Wechsel von RMP zu Rifabutin kann eine Dosisanpassung der Arzneimittel notwendig sein, als Folge von Wechselwirkungen mit anderen antiretroviralen Substanzen.
Bei Vorliegen einer sensiblen TB wird empfohlen, die Therapie von 6 auf 9 Monate zu verlängern. Bei Vorliegen resistenter TB muss die Therapie entsprechend des Resistogramms modifiziert werden.
Aufgrund der Komplexität der Therapien ist immer ein erfahrener Arzt zu konsultieren.
Therapie der resistenten Tuberkulose
Als Verdachtsmomente für eine Infektion mit resistenten TB-Stämmen (Tab. 6) gelten
- die Herkunft des Patienten aus einer Region mit hoher TB-Inzidenz bzw. einem hohen Anteil resistenter TB-Stämme,
- eine frühere antituberkulöse Therapie über mindestens 4 Wochen,
- Kontakte zu TB-Patienten mit nachgewiesener Resistenz und
- die fehlende Sputumkonversion nach dreimonatiger Therapie.
Bei einem erhöhten Risiko für das Vorliegen einer Resistenz sollte diese Information dem mikrobiologischen Labor mitgeteilt werden, damit über die Routineverfahren hinaus Techniken zur schnellen Bestätigung einer Resistenz eingesetzt werden können.
Bis zur bakteriologischen Sicherung der Diagnose einer resistenten TB sollte mit einer Kombination aus mindestens den
4 Erstrangmedikamenten INH, RMP, PZA, EMB sowie einem Fluorchinolon und einem injizierbaren Medikament (SM, Amikacin
oder Capreomycin) therapiert werden. Wird die Verdachtsdiagnose der Resistenz bestätigt, muss die Therapie unmittelbar
auf Grundlage der Ergebnisse der Sensitivitätstestung modifiziert werden. Der Behandlungserfolg korreliert umgekehrt
proportional mit dem Ausmaß der Resistenz (Tab. 6 und 7).
| Resistenz | Definition |
Behandlung |
|---|---|---|
| Einfachresistenz | Resistenz gegenüber nur einem (Erstlinien-) Medikament, meist IN H oder SM | Behandlung unproblematisch; Verlängerte Behandlungsdauer |
| Mehrfachresistenz | Resistenz gegenüber mindestens 2 Erstlinienmedikamenten, meist INH und SM betreffend, aber nicht INH und RMP | Behandlung meist noch unproblematisch; in Abhängigkeit von der Anzahl der nicht wirksamen
Medikamente verlängerte Behandlungsdauer |
| MDR „multi drug resistance“ |
Resistenz gegenüber zumindest IN H und RM P | Behandlungserfolg eingeschränkt je nach Ausmaß des Lungenbefalls; Behandlungserfolge mit kombinierter medikamentöser und ggf. operativer Therapie in über 70% möglich |
| XDR „extensively drug resistance“ |
Resistenz gegenüber IN H und RM P, allen Fluorchinolonen und mindestens einem injizierbaren
Medikament (Capreomycin, Amikacin) |
Behandlungserfolg hochgradig eingeschränkt; bei Kombination mit HIV -Infektion oder AIDS kurzfristig letaler Verlauf! |
Tab. 6: Definitionen: resistente Tuberkulose
Bei den noch immer häufigen Monoresistenzen, z.B. gegenüber INH oder SM, kann lediglich auf das jeweilige Medikament
verzichtet werden, bei einer Mehrfachresistenz oder einer MDR-TB (Tab. 6) müssen neben dem Verzicht auf die nicht
wirksamen Substanzen weitere antituberkulös wirksame Medikamente ergänzt werden (Tab. 7).
| Medikamente | Dosis/Tag |
UAW |
|---|---|---|
| Erstlinienmedikamente Pyrazinamid Ethambutol |
20-30 mg/kg KG 15-20 mg/kg KG |
Hepatotoxizität;gastrointestinale Beschwerden, Hyperurikämie, Arthralgien Dosisabhängige Optikusneuritis und periphere Neuritis |
| Injizierbare Medikamente Streptomycin Kanamycin Amikacin Capreomycin |
15 mg/kg KG (750-1.000 mg) |
Ototoxizität (Schwindel und Hörverlust), Nephrotoxizität, hämolytische/ aplastische Anämie,
Agranulozytose, Thrombozytopenie, lupoide Reaktionen Hypokaliämie, Hypocalcämie, Hypomagnesiämie, Hautreakti-onen, selten Hepatotoxizität; Verstärkung der Wirkung neuro-muskulär blockierender Substanzen in der Anästhesiologie |
| Fluorchinolone Ofloxacin Ciprofloxacin Levofloxacin Moxifloxacin |
600-800 mg 1.000-1.500 mg 500-1.000 mg 400 mg |
Gastrointestinale Intoleranz; ZNS -Symptome (z.B. Kopfschmerz, Stimmungsschwankungen, selten Krampfanfälle, Sehnenrupturen) |
| Zweitlinienmedikamente Thioamide: Prothionamid Ethionamid |
10-20 mg/kg KG (500-1.000 mg) |
Epigastrische Beschwerden, Nausea, Anorexie, metallischer Geschmack, Erbrechen und Hypersalivation; psychotische Reaktionen incl. Depression und Halluzinationen; Hypoglykämie, Hypothyroidismus; Hepatotoxizität, Gynäkomastie, Menstruationsbeschwerden, Impotenz, Akne, Kopfschmerz, periphere Neuropathie; die Medikamententoleranz zeigt ethnische Variationen |
| Terizidon Cycloserin |
15-20 mg/kg KG (500-750 mg) |
Schwindel, Sprachstörungen, Krampfanfälle Kopfschmerz, Tremor, Insomnie, Verwirrtheit, Depression, Verhaltensänderung; Hypersensitivitätsreaktionen; Hepatopathie |
| Paraaminosalicylsäure | 150 mg/kg KG (10-12 g) |
Gastrointestinale Symptome; Hautveränderungen und generelle Hypersensitivität, Hepatopathie, Hypokaliämie; Hypothyroidismus; bei Nierenversagen Intensivierung einer Azidose |
| Linezolid | 600-1.200 mg | Anämie, Thrombocytämie; periphere Neuropathie |
Tab. 7: Medikamente zur Behandlung der MDR-TB; Dosierungen und häufigste unerwünschte Arzneimittel Nebenwirkungen
Standardisierte Behandlungsregime bei Therapieversagen unter der Vorstellung einer Medikamentenresistenz sind trotz überwachter Medikamenteneinnahme mit einer Induktion weiterer Resistenzen verknüpft.
Verschiedene Wirkstoffgruppen kommen in der Therapie der MDR- und XDR-TB zum Einsatz (Tab. 7).
Unter Berücksichtigung der antimykobakteriellen Potenz der Wirkstoffe besteht ein hierarchisches Prinzip für die Auswahl der Kombinationspartner.13 In erster Linie müssen - wann immer möglich - Erstrangmedikamente eingesetzt werden. Diese Therapie sollte, wenn möglich, durch ein Fluorchinolon und ein injizierbares Medikament – in erster Linie Capreomycin – ergänzt werden. Diese Empfehlungen können auch durch die Ergebnisse aktueller TBNET-Studien in Europa untermauert werden (http://www.tb-net.org/).
Ein weiteres Medikament sollte der Gruppe der Thioamide entstammen (z.B. Protionamid). Auch Cycloserin (in Deutschland als Terizidon® erhältlich) sollte eingesetzt werden.
Das Oxazolidinon Linezolid zeigt in Anwendungsstudien mit geringen Fallzahlen eine gute antituberkulöse Wirkung14 und im Rahmen der Sensitivitätstestungen resistenter TB-Stämme wird nahezu ausschließlich die Wirksamkeit nachgewiesen. Allerdings wurden in Deutschland schon erste Linezolid resistente TB–Stämme isoliert.15
Ein Problem der Linezolidtherapie stellt neben den sehr hohen Behandlungskosten das Nebenwirkungspotential der Substanz mit reversiblen Thrombozytopenien und Anämien sowie teils irreversibler Neuropathien dar. Unter Halbierung der üblichen Tagesdosis auf 600 mg treten deutlich weniger UAW auf, ohne dass Nachteile einer geringeren antimykobakteriellen Wirksamkeit befürchtet werden müssen.16 Allerdings traten bei 85 Linezolid-behandelten Patienten mit MDR-TB im Mittel nach 60 Therapietagen UAW auf und die Linezolidtherapie musste bei 77% der Behandelten vorzeitig beendet werden. Linezolid sollte daher nur eingesetzt werden, wenn keine anderen Therapieoptionen zur Behandlung der MDR-TB vorhanden sind.
Eine kürzlich erschienene Publikation weist auf eine zumindest in vitro nachweisbare gute Wirksamkeit der Kombination von Clavulansäure und Meropenem bei MDR-TB-Stämmen hin.17 Als Vorteil für den therapeutischen Einsatz dieser Substanzen sind neben der Verfügbarkeit dieser Substanzen die hinreichend gute Verträglichkeit wie auch die Anwendbarkeit bei Kindern schon ab den 4. Lebensmonat zu sehen. Problematisch für die Langzeitapplikation sind die intravenöse Medikamentengabe und die extrem hohen Kosten.
Selbstverständlich sind bei der Auswahl der Medikamente Begleitdiagnosen wie z.B. Niereninsuffizienz, Hepatitiden, zerebrale Anfallsleiden, bekannte Unverträglichkeiten gegenüber einzelnen Substanzklassen wie auch Interaktionen mit anderen verabreichten Medikamenten zu beachten.
Angestrebt wird, möglichst 4-6 Medikamente zu applizieren, deren Wirksamkeiten über Sensitivitätstestungen belegt sind. Die empfohlene Behandlungsdauer bei der MDR- TB wird mit 18-24 Monaten über den Zeitpunkt der kulturellen Konversion hinaus angegeben.
Die Behandlungserfolge sind bei Vorliegen von Mono- oder auch Mehrfachresistenzen meist nicht beeinträchtigt, aber es ist eine Verlängerung der Behandlungsdauer erforderlich. Bei der MDR-TB muss mit dem ersten Therapieregime eine maximale Effizienz und ein kurativer Behandlungsansatz angestrebt werden. Die Möglichkeit einer Lungenresektion ist insbesondere bei lokalisierten, günstigstenfalls nur ein Lungensegment oder einen Lungenlappen betreffenden Herdbefunden ebenfalls zu erwägen. Im Ausnahmefall kann bei kompletter oder auch nur weitgehender Destruktion einer Lunge eine Pneumonektomie lebensrettend sein.18
Die Behandlungserfolge bei MDR-TB sind in erster Linie von den medizinischen Ressourcen abhängig, die für die Therapie der Patienten zur Verfügung stehen. Unter optimalen Bedingungen sind Heilungsraten bei der MDR-TB von bis zu 85% erzielt worden.19 Unter suboptimalen Bedingungen liegen die Behandlungserfolge mit <60% deutlich niedriger, gekoppelt mit hohen Rückfallraten.20
Der langfristige Behandlungserfolg korreliert mit der kulturellen Sputumkonversion nach 2-monatiger Therapie.21
Zu Behandlungsergebnissen bei XDR-TB liegen nur wenige Daten vor.22 Das amerikanische Center of Disease Control and Prevention (CDC) berichtet zwischen 1993 und 2002 über 64 Patienten, von denen ein Drittel starben und nur 31% die Therapie beendeten. In Litauen wurde zwischen 2000 und 2002 bei 115 Patienten eine XDR-TB Therapie eingeleitet, von denen 61% geheilt wurden bzw. die Behandlung beendeten, 3% starben, 27% zeigten ein Therapieversagen und 13% konnten nicht nach verfolgt werden.
Daten aus Peru von 651 Patienten zeigen, dass mit einem aggressiven Behandlungsregime mit täglich überwachter Gabe von mindestens 5 als wirksam getesteten Medikamenten, einschließlich eines injizierbaren Medikamentes über bis zu 15 Monate und dem Einsatz operativer Verfahren (Lappenresektion) bei lokalisierter Erkrankung, Heilungsraten von über 60% bei der XDR- und >66% bei der MDR-TB erzielt werden konnten.23
Daten aus 27 deutschen Krankenhäusern24 über 184 MDR-TB-Fälle (7 davon XDR), bei denen jeweils komplette Ergebnisse der Sensitivitätstestungen vorlagen, zeigten einen Therapieerfolg von 59,3% der MDR- und 57,1% der XDR-TB-Patienten. Die Krankenhausverweildauer betrug 123±81 Tage bei den MDR- und 202±130 bei den XDR-TB-Patienten. Die Mehrzahl der Studien zum Therapieerfolg bei resistenter TB belegen für die XDR-TB im Vergleich zur MDR-TB die höhere Wahrscheinlichkeit für Todesfälle und Therapieversagen, längere Hospitalisierungszeiten, längere Behandlungsdauern und eine verzögerte mikrobiologische Konversion.25
1 WHO, Global tuberculosis control: epidemiology, strategy, financing: WHO report 2009. “WHO/HTM/TB/2009.411”
2 EuroTB and the national coordinators for tuberculosis surveillance in the WHO European Region. Surveillance of tuberculosis in Europe. Report on tuberculosis cases notified in 2006. Institut de veille sanitaire, Saint-Maurice, France. March 2008
3 Robert Koch-Institut, Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2007, Robert Koch-Institut, Berlin 2009
4 WHO, anti-tuberculosis drug resistance in the world, Fourth Global Report, The WHO/IUATLD Global Project on Anti-tuberculosis Drug Resistance Surveillance, 2002-2007 , WHO/HTM/TB/2008.394
5 Rüsch-Gerdes S, Pfyffer GE, Casal M, Chadwick M, Siddiqi S. Multicenter laboratory validation of the BACTEC MGIT 960 technique for testing susceptibilities of Mycobacterium tuberculosis to classical second-line drugs and newer antimicrobials. J Clin Microbiol 2006; 44:688-92.
6 Zhang Y, Telenti A. Genetics of drug resistance in Mycobacterium tuberculosis. In: Hatful GF, Jacobs WR Jr., editors. Molecular Genetics of Mycobacteria. Washington DC: ASM Press, 2000:235-54.
7 Ling DI, Zwerling AA, Pai M. GenoType MTBDR assays for the diagnosis of multidrug-resistant tuberculosis: a meta-analysis. Eur Respir J 2008; 32:1165-74.
8 Hillemann D, Rüsch-Gerdes S, Richter E. Feasibility of the GenoType® MTBDRsl Assay for fluoroquinolone, amikacin/capreomycin, and ethambutol resistance testing of Mycobacterium tuberculosis strains and in clinical specimens. J Clin Microbiol 2009; 47:1767-72.
9 Hauer B, Loddenkemper R, Detjen A, Forssbohm M, Haas W, Loytved G, Magdorf K, Mauch H, Nienhaus A, Rieder HL, Sagebiel D, Schaberg T. Interferon-?-Tests in der Tuberkulose-Diagnostik – Aktueller Stand. Pneumologie. 2006; 60:29-44.
10 Blumberg, HM, Burman WJ, Chaisson RE, Daley CL, Etkind SC, Friedman LN, Fujiwara P, Grzemska M, Hopewell PC, Iseman MD, Jasmer RM, Koppaka V, Menzies RI, O‘Brien RJ, Reves RR, Reichman LB, Simone PM, Starke JR, Vernon AA. American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America: treatment of tuberculosis. Am J Respir Crit Care Med. 2003; 167:603-662. Identisch mit: www.cdc.gov/mmwr/preview/mmwrhtml/rr5211a1.htm - Vol 52, No 11;1
11 Schaberg, T., M. Forssbohm, B. Hauer, D. Kirsten, R. Kropp, R. Loddenkemper, K. Magdorf, Rieder H, Sagebiel D, Urbanczik R.. [Guidelines for drug treatment of tuberculosis in adults and childhood]. Pneumologie 2001; 55:494-51.
12 Burman WJ, Goldberg S, Johnson JJ, Muzanye G, Engle M, Mosher AW, Chourdhri S, Daley CL, Munsiff SS, Zhao Z, Vernon A, Chaisson RE and the Tuberculosis Trial Consortium. Moxifloxacin versus Ethambutol in the first 2 months of treatment for pulmonary tuberculosis. Am J Respir Crit Care Med 2006; 174: 331-338.
13 Mukherjee JS, Rich ML, Socci AR, Joseph JK, Virú FA, Shin SS, Furin JJ, Becerra MC, Barry DJ, Kim JY, Bayona J, Farmer P, Smith Fawzi MC, Seung KJ. Programmes and principles in treatment of multidrug-resistant tuberculosis. Lancet 2004; 363:474-81.
14 von der Lippe B, Sandven P, Brubakk O. Efficacy and safety of linezolid in multidrug resistant tuberculosis (MDR-TB)--a report of ten cases. J Infect 2006; 52:92-6.
15 Richter E, Rüsch-Gerdes S, Hillemann D. First linezolid-resistant clinical isolates of Mycobacterium tuberculosis. Antimicrob Agents Chemother 2007; 51:1534-6.
16 Migliori GB, Eker B, Richardson MD, et al. for the TBNET Study Group. A retrospective TBNET assessment of linezolid safety, tolerability and efficacy in MDR-TB. Eur Resp J 2009, in Press.
17 Hugonnet J-E, Tremblay LW, Boshoff HI, Barray 3rd CE, Blanchard JS. Meronem-Clavulate is effective against extensively drug-resistant Mycobacterium tuberculosis. Science 2009; 323:1215-18
18 Kim HJ, Kang CH, Kim YT, Sung SW, Kim JH, Lee SM, Yoo CG, Lee CT, Kim YW, Han SK, Shim YS, Yim JJ. Prognostic factors for surgical resection in patients with multidrug-resistant tuberculosis. Eur Respir J 2006; 28:576-80.
19 Chan ED, Laurel V, Strand MJ, Chan JF, Huynh ML, Goble M, Iseman MD. Treatment and outcome analysis of 205 patients with multidrug-resistant tuberculosis. Am J Respir Crit Care Med 2004; 169:1103-9.
20 Palmero DJ, Ambroggi M, Brea A, De Lucas M, Fulgenzi A, Martínez D, Mosca C, Musella R, Natiello M, Gonzalez C, Abbate E. Treatment and follow-up of HIV-negative multidrug-resistant tuberculosis patients in an infectious diseases reference hospital, Buenos Aires, Argentina. Int J Tuberc Lung Dis 2004; 8:778-84.
21 Holtz TH, Sternberg M, Kammerer S, Laserson KF, Riekstina V, Zarovska E, Skripconoka V, Wells CD, Leimane V. Time to sputum culture conversion in multidrug-resistant tuberculosis: predictors and relationship to treatment outcome. Ann Intern Med 2006;144:650-9.
22 Centers for Disease Control and Prevention (CDC). Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs--worldwide, 2000-2004. MMWR Morb Mortal Wkly Rep 2006; 55:301-5.
23 Mitnick CD, Shin SS, Seung MD, Rich ML, Atwood SS, Furin JJ, Fitzmaurice GM et al. Comprehensive treatment of extensively drug-resistant tuberculosis. N Engl J Med 2008; 359:563-74.
24 Eker B, Ortmann J, Migliori GB, Sotgiu G, Muetterlein R, Centis R, Hoffmann H, Kirsten D, Schaberg T, Rüsch-Gerdes S, Lange C, the German TBNET Group1. Multidrug- and extensively drug resistant tuberculosis, Germany. Emerg Infect Dis 2008; 14:1700-6.
25 Sotgiu G, Ferrara G, Richardson MD, Centis R, Ruesch-Gerdes S, Toungoussova O, Zellweger J-P, Spanevell A, Cirillo D, Lange C and Migliori GB. Epidemiology and clinical management of XDR-TB: a systematic review by TBNET. Eur Respir J 2009; 33:871-81.
Mycobacterium tuberculosis-Stämme ...
Abb. TB-Bakterien
... die gegenüber einer zunehmenden Zahl von Antibiotika Resistenzen aufweisen, sind weltweit ein wachsendes Problem, vor allem auch für HIV-Patienten. In den letzten zwei Jahrzehnten war es vor allem die multiresistente (MDR) Tuberkulose (TB), definiert als Resistenz gegenüber mindestens Isoniazid (INH) und Rifampicin (RMP). Die Behandlung von MDR-TB erfordert den Einsatz von sogenannten Zweitrang- (oder auch „second-line“) Medikamenten (SLD), die weniger effektiv, mit mehr Nebenwirkungen behaftet und auch teurer sind als Erstrang- („first-line“) Medikamente. Die neueste Entwicklung ist das Auftreten von extensiv-resistenter TB (XDR-TB), die als spezielle Form der MDR-TB definiert ist, mit zusätzlichen Resistenzen gegenüber den Fluorquinolonen und mindestens einem der injizierbaren Medikamente, die in der TB-Therapie verwendet werden: Amikacin, Kanamycin oder Capreomycin. Patienten mit XDR-TB haben weniger Heilungschancen aufgrund begrenzter Therapieoptionen und sind über längere Zeiten infektiös. Hohe HIV-Koinfektionsraten und überforderte Gesundheitssysteme haben zur Entstehung von XDR-TB beigetragen. Verbesserungen in der Überwachung der TB, Ausweitung der Laborkapazitäten und bessere Infektions- und Therapiekontrollen sind notwendige Maßnahmen zur Bekämpfung dieser weltweit immer noch nicht besiegten Infektionskrankheit.