Ein aktueller
Überblick Alveoläre und zystische Echinokokkose in Deutschland
Lediglich zwei der vier bekannten Echinococcus-Spezies sind humanmedizinisch als Erreger von Zoonosen relevant. Nach korrekter Nomenklatur entsprechend WHO-Empfehlung wird die durch Echinococcus granulosus verursachte Erkrankung als zystische Echinokokkose (CE, Hundebandwurmerkrankung) bezeichnet, während die alveoläre Echinokokkose (AE, Fuchsbandwurmerkrankung) durch Echinococcus multilocularis verursacht wird. Nach IfSG §7 sind beide Erkrankungen in Deutschland meldepflichtig.
Da das Wachstumsverhalten der beiden Spezies im Menschen sehr unterschiedlich ist, resultieren zwei völlig verschiedene Krankheitsbilder. Bild 1 verdeutlicht dies anhand makroskopischer Präparate von Leberteilresrektaten. Das Erscheinungsbild der AE entspricht dem einen Malignomes, während ein CE Herd durch die glatt begrenzte Perizyste benigne imponiert.
Ziel dieses Beitrages ist es, dem Leser die korrekte Unterscheidung der beiden Krankheitsentitäten zu verdeutlichen.
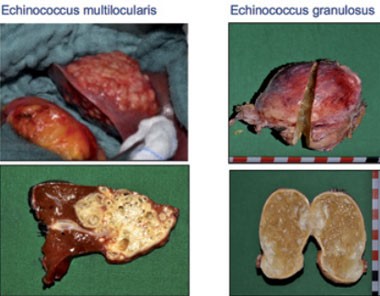
Abb. 1 Wachstumsverhalten von Echinococcus multilocularis versus Echinococcus granulosus
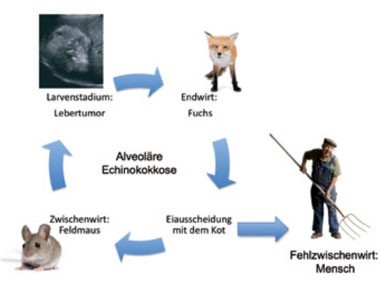
Abb. 2 Entwicklungszyklus von Echinococcus multilocularis
Alveoläre Echinokokkose
Die alveoläre Echinokokkose (AE) wird durch das Larvenstadium des Kleinen Fuchsbandwurmes verursacht und ist die gefährlichste Parasitose Europas. Trotz Ausbreitung der Endemiegebiete und zunehmender Urbanisierung handelt es sich bei der alveolären Echinokokkose in Mitteleuropa weiterhin um eine sehr seltene Erkrankung 1,2. Der maligne Charakter dieser Helminthose und die Unkenntnis über das Infektionsrisiko beunruhigen die Bevölkerung in wachsendem Ausmaß und stehen in Kontrast zu den niedrigen Fallzahlen in unseren Breiten.
Der Parasit: Echinococcus multilocularis
Der Kleine Fuchsbandwurm (adult 2-4 mm groß) besiedelt den Dünndarm des Rotfuchses oder anderer Karnivoren. Die Endwirte scheiden Bandwurmeier mit dem Kot aus. Kleine Nagetiere (Feldmaus, Schermaus u.a.) sind die natürlichen Zwischenwirte, in denen sich nach oraler Aufnahme der Eier ein vielkammriger, schwammartiger Lebertumor entwickelt, in dessen Innerem Tausende neuer Kopfanlagen enthalten sind. Der Zyklus schließt sich, wenn ein befallenes Nagetier von einem Fuchs (bzw. Hund/ Katze) gefressen wird.
Der Mensch infiziert sich durch
akzidentelle Aufnahme der Eier. Da im Menschen die Ausbildung von Protoscolices
durch das larvale Keimepithel nur in Ausnahmefällen erfolgt, wird er als
Fehlzwischenwirt bezeichnet 3.
Epidemiologie
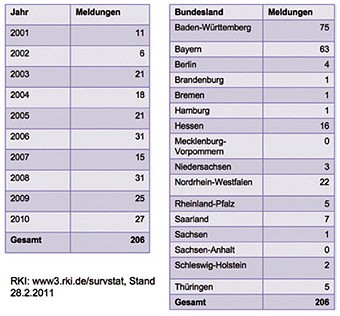
Tabelle 1 RKI Meldungen Alveoläre Echinokokkose Deutschland 8
Echinococcus multilocularis kommt nur in den gemäßigten bis kalten Klimazonen der Nordhalbkugel vor. In Mitteleuropa wird seit Jahren eine zunehmende Ausbreitung des Parasiten, über die bekannten Endemiegebiete in Süddeutschland, Ostfrankreich, der Nordschweiz und Westösterreich hinaus, berichtet 4. Trotz der hohen Befallsraten in Fuchspopulationen mit bis 75% in einigen Gebieten Baden-Württembergs kam es bislang nicht zu einem drastischen Anstieg der Erkrankungen in Deutschland (Tabelle 1).
Von 1982 -2000 wurden vom Europäischen Echinokokkoseregister Ulm 556 Erkrankungen beim Menschen erfasst 5, wobei 96% auf die Länder Frankreich (235), Deutschland (132), Schweiz (118) und Österreich (54) entfielen. Die Inzidenz wird nach Eckert 6 1996 mit 0,02-1,4/100.000 Einwohner pro Jahr in Mitteleuropa angegeben. Die Prävalenz für Süddeutschland wurde 1995 mit 0,5 Fälle/ 100.000 Einwohner pro Jahr beziffert 7.
Die Anzahl der gemeldeten Neuerkrankungen in Deutschland beläuft sich in den letzten Jahren auf 20-30 Fälle pro Jahr. Dabei entfallen 77% der Fälle auf die Endemiegebiete Süddeutschlands.
Eine Untersuchung zur AE in der Schweiz zeigte einen Anstieg der mittleren Inzidenz beim Menschen von 0.10/100.000/Jahr in den Jahren von 1993 bis 2000 auf 0.26/100.000 im Zeitraum von 2001 bis 2005. Ursächlich hierfür wird unter Beachtung der 5-15 jährigen Latenzphase bei der AE die seit 1985 zunehmende Fuchspopulation und Prävalenz infizierter Tiere gesehen 9. Es ist nicht auszuschließen, dass ein ähnlicher Anstieg auch in Deutschland in den nächsten Jahren zu beobachten sein wird.
Bekannte Endemiegebiete außerhalb Europas mit nachgewiesenen Erkrankungen beim Menschen sind Russland, besonders Sibirien, die Mongolei, China mit der Tibetischen Hochebene, der Norden Japans und die Türkei 10. In Nordamerika finden sich Endemiegebiete in Kanada, Alaska und in den zentralen Bundesstaaten der USA, mit jedoch geringen Fallzahlen beim Menschen 11,12. Nach aktueller Datenlage scheint China das Land mit der weltweit höchsten Prävalenz alveolärer Echinokokkose zu sein 13, 14, 15.
Die Erkrankung des Menschen
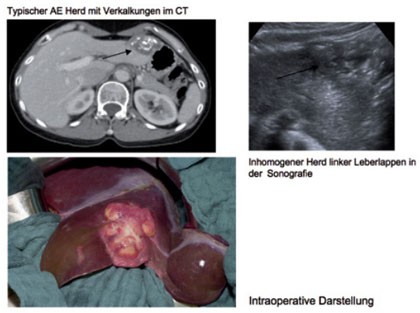
Abb. 3 Typischer Leberherd bei alveolärer Echinokokkose, Computertomografie, Sonografie, intraoperativer Situs.
Die genaue Inkubationszeit der alveolären Echinokokkose ist nicht bekannt. Man geht davon aus, dass 10-15 Jahre vergehen, bevor eine Läsion erkennbar wird 3.
Das Larvengewebe von E. multilocularis zeigt ein infiltrierendes, tumorartiges Wachstum, das zu 98% in der Leber beginnt, sich kontinuierlich auf benachbarte Strukturen/Organe ausbreitet und /oder zu Fernmetastasen führen kann 16. Unbehandelt wird die Letalität der AE mit 90% innerhalb 10-15 Jahren nach Diagnosestellung angegeben 13, 17, 18. Mit Einführung der Benzimidazole in die Therapie 1976 verbesserte sich die Prognose erheblich 19,20. Bei der Larve von E. multilocularis erfolgt, im Gegensatz zu E. granulosus, keine Abkapselung seitens des Wirtes, sondern der parasitäre Herd wächst in der Peripherie indem sich dort neue Vesikel bilden. Dies führt zu einem vielkammrigen (alveolären) und infiltrativ-destruierend wachsenden „Tumor“, der Blutgefäße und Gallengänge involviert, sich über die Organgrenzen hinaus ausbreitet und auch hämatogen bzw. lymphogen streut (Bild 3). Nach Daten des Europäischen Echinokokkose Registers war zum Zeitpunkt der Erstdiagnose bereits bei 34% der Patienten ein extrahepatischer Befall feststellbar 5.
Symptomatik
Typische Frühsymptome gibt es bei der AE nicht und häufig wird die Diagnose zufällig bei einer Sonografie oder im Rahmen von Screeninguntersuchungen gestellt 21, 22. Auch die Abklärung pathologischer Laborparameter (BSG, Leberwerte vor allem der GGT) führt über bildgebende Verfahren zur Diagnose. Typischerweise bestehen klinisch keine Beschwerden, obwohl bereits ein großer Teil der Leber durch den parasitären Herd infiltriert ist.
Meist treten erst im späteren Verlauf Symptome wie abdominales Druckgefühl, Schmerzen, Übelkeit oder Fieber auf. Der Parasit involviert regelhaft Gallengänge und Gefäße, konsekutiv sind Cholestase/ Ikterus bzw. Pfortaderthrombose/portale Hypertension typisch im weiteren Verlauf. Erst mit zunehmender Durchsetzung der Leber durch parasitäres Gewebe verschlechtert sich die Leberfunktion 23.
Bildgebung
Die Sonografie ist das erste zum Einsatz kommende Verfahren. Hier werden typischerweise größere unregelmäßig und unscharf begrenzte Leberläsionen, die echoreich/echoarm und inhomogen sind mit Nachweis von scholligen Verkalkungen und vesikulären Strukturen, beschrieben. Initiale Herde stellen sich meist echoreich, hämangiomartig dar. Durch geringe Vaskularisation kann es allem im Zentrum großer Herde zur Ausbildung einer Nekrosehöhle kommen. Diese imponiert als sogenannte Pseudozyste 3, was zur Fehldiagnose zystische Echinokokkose führen kann 24.
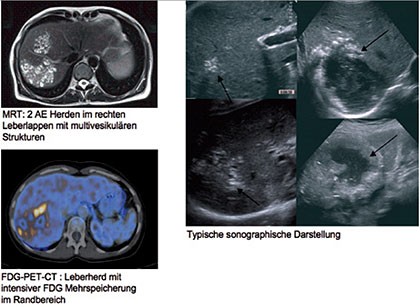
Abb. 4
Alveoläre Echinokokkose: Bildgebung
Im CT werden Verkalkungen besonders gut erfasst, während im MRT vor allem die vesikulären Strukturen am Klarsten zur Darstellung kommen. Zusätzliche Informationen können mittels [F18]-FDG-PET gewonnen werden 23. Hier dient die FDG- Mehrspeicherung im Randbereich einer Läsion (welche sich meist als zentraler fotopenischer Defekt darstellt) als Parameter für die metabolische Aktivität des Parasiten 25. Hilfreich ist ein FDG-PET-CT unter anderem zur Verlaufsbeurteilung unter Benzimidazoltherapie 23, 25. Auch zur Detektion von Rezidiven im postoperativen Verlauf scheint das FDG-PET-CT Methode der Wahl zu sein. In Bild 4 sind typische Befunde in den verschiedenen Modalitäten (Sonografie, MRT, PET-CT) dargestellt.
Labor
Charakteristische Laborbefunde gibt es nicht, häufig ist jedoch eine Erhöhung des Gesamt IgE, sowie des Echinokokkus-spezifischen IgE (im RAST). Eine Eosinophilie ist in weniger als 10% der Patienten zu beobachten 26. Oft findet sich eine Erhöhung der GGT (durch Gallengangsbeteiligung), eine beschleunigte BSG, sowie eine Hypergammaglobulinämie.
Serologie
Die Serodiagnostik erfolgt in der Regel stufenweise 24, 26, 27, 28. Beim initialen Suchtest (meist indirekte Hämagglutination) wird als Rohantigen Hydatidenflüssigkeit von E.granulosus verwendet, hierdurch können aufgrund der Antigenverwandtschaft sowohl für AE als auch CE Antikörper recht zuverlässig nachgewiesen werden. Die Sensitivität wird mit 80% für CE bzw. 94-97% für AE angegeben 26. Im Bestätigungstest werden zur Verbesserung der Spezifität verschiedene aufgereinigte bzw. rekombinante Antigene von E. multilocularis eingesetzt. Hierfür werden eine hohe Sensitivität mit 90-100%, sowie eine Spezifität von 95-100% angegeben 27. In Deutschland kommt meist der kommerziell erhältliche E. multilocularis – ELISA mit Em2 plus Antigen zur Anwendung (24). Für spezielle Fragestellungen sollten die jeweiligen Nationalen Konsiliarlabore hinzugezogen werden. Bei bis zu 2% der ländlichen Bevölkerung fanden sich positive serologische Befunde ohne Hinweis für eine Leberechinokokkose 22.
Falldefinition und WHO-Klassifikation. Die klinische Diagnose basiert auf dem typischen morphologischen Befund eines Lebertumors mit entsprechender Anam-nese und Epidemiologie, sowie positiver Echinokokkoken-Serologie.
Präziser ist die Definition nach WHO-Leitlinien, wonach die Falldefinition als erfüllt angesehen wird, wenn 2 der folgenden Kriterien erfüllt sind:
- bildgebend typische Organläsion,
- positiver Nachweis spezifischer Antikörper für E.multilocularis ,
- kompatibler histopathologischer Befund von Metazestodengewebe,
- Nachweis von E. multilocularis Nukleinsäure in klinischen Proben 29.
Liegt lediglich eine positive Serologie vor, ohne Herdnachweis, ist die Falldefinition nicht erfüllt .
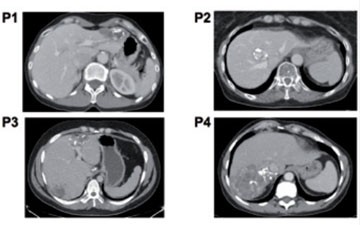
Abb. 5 WHO-Klassifikation der alveolären Echinokokkose: PNM-Stadien, parasitäre Leberherde P1-P4 (CT)
Da die AE sehr selten ist, das biologische Verhalten eines malignen Tumors zeigt, und das klinische Bild stark variieren kann, wurde von Experten der WHO-Arbeitsgruppe und des Europäischen Echinokokkose Registers eine Klassifikation analog zum TNM-System erarbeitet. Hiermit ist eine standardisierte Beurteilung des Stadiums bei Diagnosestellung und ein Austausch zwischen Zentren vor allem in Hinblick auf die Therapie möglich 28. Die Klassifikation beruht auf bildgebenden Verfahren und berücksichtigt das Wachstumsverhalten des Larvengewebes. Bild 5 zeigt typische CT-Befunde für Leberherde der Stadien P1-4.
Tabelle 2 WHO PNM-Klassifikation der alveolären Echinokokkose
Therapie
Empfohlen wird die Behandlung in einem erfahrenen Zentrum bzw. unter Anleitung eines solchen. Die Therapieplanung sollte in interdisziplinärer Kooperation erfolgen 28.
Nur etwa ein Drittel der Patienten wird in einem primär lokal operablen Stadium diagnostiziert. Bei etwa 70% ist bereits ein Großteil der Leber befallen bzw. liegen extrahepatische Manifestationen vor, so dass eine kurative Resektion nicht möglich ist 30, 31, 32.
Primäres Ziel ist die radikale (R0) Resektion eines Herdes. Ist eine komplette Resektion nach tumorchirurgischen Kriterien mit ausreichendem Sicherheitsabstand erfolgt, wird die Albendazol-Therapie post-operativ für 2 Jahre beibehalten. Rationale hierfür ist analog einer adjuvanten Chemotherapie, verbliebenes parasitäres Gewebe, das bildgebend nicht erfassbar ist, abzutöten. Nach einer Operation sollten AE Patienten mindestens 10 Jahre lang hinsichtlich eines eventuellen Rezidives der Erkrankung überwacht werden 30, 31, 32.

Tabelle 2 PNM-Klassifikation der alveolären Echinokokkose
Eine Chemotherapie mit einem Benzimidazol ist bei allen Patienten indiziert und mitunter lebenslang erforderlich, da sie nur parasitostatisch wirken 27, 30, 31,32. Albendazol wird in einer Dosis von 10-15 mg/kg/Tag in 2 geteilten Dosen gegeben. Die Einnahme muss mit einer fettreichen Mahlzeit erfolgen, andernfalls ist die Resorption nicht gewährleistet. In einem Teil der Patienten muss die Therapie aufgrund schwerer Nebenwirkungen, wie medikamentös-toxische Hepatitis oder Zytopenie abgebrochen werden. Ein entsprechendes Monitoring mit regelmäßigen Blutbild- und Leberwertkontrollen ist erforderlich. Das einzig verfügbare Alternativpräparat ist Mebendazol, welches mit 40-50 mg/kg/Tag verteilt auf 3 Dosen einzunehmen ist. Bei Benzimidazolintoleranz sind die medikamentösen Therapieoptionen eingeschränkt. In der Frühschwangerschaft sollt auf Benzimidazole verzichtet werden, da in Tierversuchen teratogene Effekte auftraten.
Unter bestimmten Umständen kann bei dokumentiertem Ansprechen auf die anthelminthische Therapie ein Auslassversuch bei fehlender metabolischer Aktivität im FDG-PET erfolgen, hierunter sollte jedoch auf regelmäßige klinische und sonografische Kontrollen geachtet werden 23, 33, 34.
Palliative Eingriffe im Sinne einer parasitären Massenreduktion sind nur bei Komplikationen (zum Beispiel Superinfektion) empfohlen, da hierdurch gegenüber der alleinigen medikamentösen Therapie kein Vorteil gezeigt werden konnte. Endoskopische Eingriffe wie Stentanlagen sind bei Cholestase/Ikterus häufig erforderlich, aber im weiteren Verlauf unter Benzimidazoltherapie bei Regression des Leberherdes wieder entbehrlich 30, 31, 32.
Eine Lebertransplantation wurde bei etwa 60 Patienten weltweit durchgeführt und ist als Ultima Ratio anzusehen. Indikationen sind schwere Leberinsuffizienz oder rezidivierende lebensbedrohliche Cholangitiden 27. Allerdings wird unter der immunsuppresiven Therapie regelhaft ein AE Rezidiv, eventuell mit disseminiertem Befall beobachtet, somit sind Benzimidazole auch nach Transplantation dauerhaft einzunehmen 30, 31, 32. Zusammenfassend ist festzuhalten, dass die AE in den meisten Fällen gut behandelbar ist, aber nur in etwa 30% der Fälle heilbar 20.
Prävention
Die genauen Übertragungsbedingungen für den Menschen sind nicht bekannt. Ältere Daten zeigen, dass die Bevölkerung im ländlichen Bereich ein höheres Infektionsrisiko trägt 7. Die Fuchsbandwurmerkrankung ist anerkannte Berufserkrankung bei Landwirten 35. In einer deutschen Fallkontrollstudie konnten als Risikofaktoren neben der Tätigkeit in der Landwirtschaft auch die Haltung freilaufender Hunde identifiziert werden. Hingegen konnte kein Zusammenhang zum Verzehr von Waldbeeren erbracht werden 36. Die Bandwurmeier sind sehr widerstandsfähig und können in feuchter, kühler Witterung viele Monate überstehen, auch Temperaturen von minus 20 ° Celsius und leichte alkoholische Lösungen wie im Rumtopf überstehen sie. Empfindlich sind sie gegen Austrocknung und bei Erhitzen über 60 ° Celsius sterben sie ab.
Daraus leiten sich folgende Möglichkeiten der Prävention ab: Hygiene beachten; Hände waschen nach potenzieller Kontamination wie Hundekontakt, Gartenarbeit, landwirtschaftliche Tätigkeit. Ggf. Kleidung wechseln (60°Wäsche). Hunde und Katzen regelmäßig entwurmen. Fuchsköder mit Praziquantel können deren Befallsraten senken.
Zystische Echinokokkose
Die zystische Echinokokkose wird vom Larvenstadium des Bandwurms aus dem Echinococcus granulosus-Komplex hervorgerufen und zeigt einen wesentlich benigneren klinischen Verlauf als die alveoläre Echinokokkose. Die Prognose der zystischen Echinokokkose ist bei adäquater medizinischer Versorgung wesentlich besser (Mortalität 2-4%) als bei der alveolären Echinokokkose 37. Obwohl in den letzten 10 Jahren in Deutschland mehr Fälle von zystischer Echinokokkose gemeldet (Tabelle 3) wurden als alveoläre Echinokokkose, tritt die Erkrankung in Deutschland nur sporadisch auf. In den allermeisten Fällen wurde sie von Migranten aus ihrer Heimat mitgebracht oder während Langzeitaufenthalten in Endemiegebieten erworben.
Der Parasit: Echinococcus granulosus
Beim adulten Hundebandwurm (Echinococcus granulosus) handelt es sich um einen
Darmparasiten von Caniden. Der bedeutendste Endwirt ist der Hund. Die Größe der
Würmer beträgt nur wenige Millimeter. Der Entwicklungszyklus des Parasiten
benötigt zwei Wirte (Bild 6). Der eigentliche Bandwurm lebt im Darm des
Endwirtes (Hund). Dieser produziert Eier, die mit dem Kot ausgeschieden und vom
Zwischenwirt (Schafe, Rinder, Esel, Kamele etc.) aufgenommen werden. Die
Parasiteneier sind sehr umweltresistent. Obwohl sie empfindlich gegenüber
Austrocknung sind, überleben sie Temperaturen zwischen -70°C und +40°C auch
über einen längeren Zeitraum. Menschen können durch orale Aufnahme von Eiern
ebenfalls Zwischenwirte werden. Im Zwischenwirt (Mensch oder Tier) entwickelt
sich das Larvenstadium des Parasiten in Form einer Zyste in inneren Organen 37.
Die Larve produziert Protoscolices in großer Anzahl, aus welchen sich bei
Aufnahme durch den Hund im Darm wiederum erwachsene Würmer bilden können.
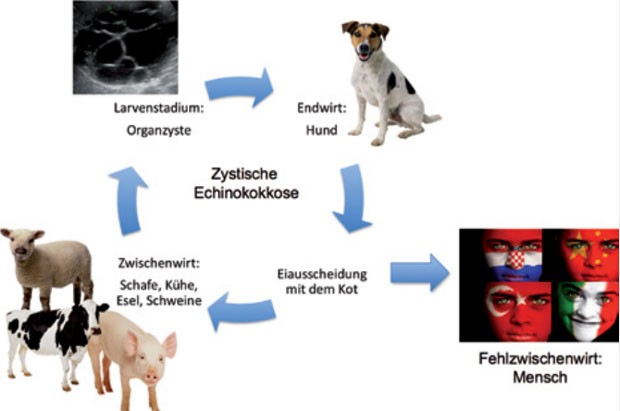
Abb. 6 Entwicklungszyklus von Echinococcus granulosus
Epidemiologie
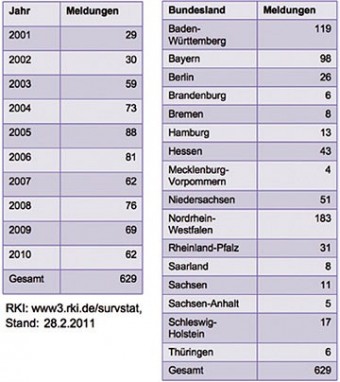
Tabelle 3 Zystische Echinokokkose, RKI-Meldungen 2001-2010
Die zystische Echinokokkose kommt weltweit vor, es gibt jedoch Gegenden mit erhöhter Prävalenz. In Europa sind hier vor allem Süd- und Osteuropa, sowie der Balkan von Bedeutung. Die höchste Inzidenz in Europa wird mit >8/100.000/Jahr auf Sardinien gefunden 38. Aus der Türkei und den Staaten der Russischen Föderation werden ebenfalls hohe Inzidenzen berichtet 39. Auch im Vereinigten Königreich ist die zystische Echinokokkose endemisch, Grönland und Island gelten dagegen als infektionsfrei. Weltweit ist die zystische Echinokokkose auch in Zentralasien inkl. dem tibetischen Hochland, Nord- und Ostafrika, Australien und dem südlichen Südamerika endemisch 39. Die Erkrankung wird zu den vernachlässigten tropischen Erkrankungen gezählt 40. Es besteht eine eindeutige Assoziation mit Armut und niedrigem sozioökonomischen Status und die höchsten Prävalenzen werden bei nomadisch lebenden Populationen gefunden, die Viehwirtschaft und Heimschlachtung betreiben. Hier wird Hunden die Gelegenheit geboten durch den Verzehr von rohen Schlachtabfällen rezidivierend mit Echinococcus granulosus infiziert zu werden. Durch den engen Kontakt zum Menschen kommt es hier häufiger zu Infektionen 16. Grundsätzlich können Menschen jeden Alters betroffen sein. In Deutschland besteht eine Meldepflicht für Echinokokkose. Diese beruht auf dem Nachweis von Antikörpern und es wird keine sichere Differenzierung zwischen den beiden humanmedizinisch relevanten Spezies gemacht (Tab. 3).
Die Erkrankung des Menschen
Die menschliche zystische Echinokokkose wird durch das Larvenstadium des Parasiten hervorgerufen und äußert sich durch Bildung einer oder in seltenen Fällen auch mehrerer glatt begrenzter Zysten. Die Präpatenzzeit ist sehr lang und kann mehrere Jahre bis Jahrzehnte betragen. Obwohl jedes Organ im Körper betroffen sein kann, finden sich bei 70% der Patienten Zysten in der Leber gefolgt von pulmonalen Zysten in 20% der Fälle 3, 16, 41. 40-80% der betroffenen Patienten entwickeln eine solitäre Zyste 3,16. Ca. 60% der Patienten bleiben asymptomatisch und die Echinokokkose ist ein Zufallsbefund bei aus anderen Gründen durchgeführter bildgebender Diagnostik 42. Unspezifische Symptome entstehen häufig erst nach Jahren durch den lokalen Effekt der Zyste auf das umgebende Gewebe und sind von Lokalisation und Größe der Zyste abhängig 43. Zusätzlich zu Symptomen durch den Lokaleffekt der Zyste können systemisch immunologische Symptome wie Urtikaria, Asthma oder Anaphylaxie auftreten. Die häufigste Komplikation der zystischen Echinokokkose ist die Zystenruptur. Bei der Ruptur hepatischer Zysten kann es zu Anaphylaxie, peritonealer Aussaat, Cholangitis und Cholestase bei Ruptur in die Gallenwege kommen. Bei pulmonalen Zysten stehen chronischer Husten, Auswurf, Dyspnoe, Hämoptysen, Pleuritis oder die Ausbildung eines Lungenabszesses im Vordergrund. 3,16
Risikofaktoren
In einer Fall-Kontroll-Studie aus Spanien konnte nachgewiesen werden, dass Patienten im Gegensatz zu Kontrollpersonen häufiger ländlich gelebt haben, häufiger Hundebesitzer waren und diese Hunde häufiger Zugang zu rohen Schlachtabfällen hatten. Obwohl hypothetisch eine Infektion über mit Kot kontaminiertes Gemüse aus dem eigenen Garten möglich wäre, konnte dies in der Studie nicht nachgewiesen werden 44. Aus Afrika weiß man jedoch, dass auch Wasser als Infektionsquelle in Frage kommt 45.
Bildgebung
Die Sonographie ist die bildgebende Methode der Wahl zur Diagnostik und Verlaufskontrolle der hepatischen zystischen Echinokokkose. Sind andere Organe involviert kommen weitere Verfahren, wie konventionelles Röntgen, die Computertomographie oder Kernspintomographie in Frage. Je nach Stadium der Erkrankung zeigt sich eine umkapselte zystische Struktur mit oder ohne Binnenstrukturen, wie Septierungen, Tochterzysten und selten Verkalkungen 27.
Serologie
Es gibt verschiedene Methoden (IHA, ELISA, Latex Agglutinations Test) zum Nachweis von Echinococcus-spezifischen Antikörpern. Der Suchtest mit Antigen aus der Zystenflüssigkeit weist eine hohe Sensitivität auf (vor allem bei Leberzysten), jedoch ist die Spezifität nicht zufriedenstellend. Die mangelnde Spezifität ist durch Kreuzreaktivität mit anderen Helminthen, Malignomen und bei Leberzirrhose bedingt. Im Bestätigungstest (Immunoblot) werden spezifischere Antigene benutzt. So steigt die Spezifität, aber insgesamt bleiben Sensitivität und Spezifität der serologischen Untersuchung unbefriedigend und bis zu 20% der Fälle hepatischer zystischer Echinokokkose zeigen keine messbare Antikörper-Antwort. Bei pulmonalen Erkrankungen kann dies bei 40% der Patienten der Fall sein 16. Sind Organe wie das Hirn oder der Knochen betroffen, können in den meisten Fällen keine spezifischen Antikörper nachgewiesen werden 27. Eine alleinige positive Serologie ohne bildmorphologisches Korrelat belegt keine zystische Echinokokkose und bedarf keiner Therapie.
Diagnostische Kriterien und Stadieneinteilung
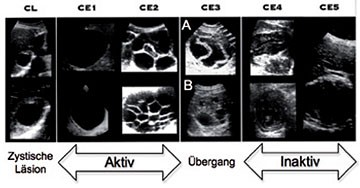
Abb. 7 WHO-IWGE Klassifikation der zystischen Echinokokkose nach Ultraschallmorphologie
Im Jahr 2010 wurden von Brunetti et al. Richtlinien zur Diagnosestellung der zystischen Echinokokkose veröffentlicht. Hier wird in Anlehnung an Pilzpneumonien, die Unterscheidung in mögliche, wahrscheinliche und gesicherte Infektion vorgenommen. Klinische Kriterien für eine Diagnose sind hierbei eine langsam wachsende oder stabile zystische Raumforderung in der Bildgebung oder eine anaphylaktische Reaktion durch Zystenruptur. Als diagnostische Kriterien werden weiterhin der Nachweis spezifischer Antikörper durch einen serologischen Test, mit Bestätigung durch eine weitere serologische Methode, der histopathologische Nachweis Echinococcus-typischer Strukturen (Protoscolices oder Häkchen in der Zystenflüssigkeit) oder typische makroskopische Veränderungen im chirurgischen Resektat gefordert. Für eine möglichen Infektion wird das Vorliegen eines indirekten diagnostischen Kriteriums gefordert. Sind mindestens zwei dieser Kriterien erfüllt, spricht man von einer wahrscheinlichen Infektion. Nur bei mikroskopischem Nachweis von Echinococcus-typischen Strukturen liegt eine gesicherte Infektion vor 27. Zusätzlich zu diesen Diagnosekriterien werden die hepatischen Zysten aufgrund ihrer Darstellung in der Sonographie in 5 Stadien eingeteilt (siehe Bild 7). Diese Einteilung ist für Prognose und Therapie von Bedeutung.
Therapie
Es gibt keine Standardtherapieempfehlung für die Behandlung der zystischen Echinokokkose. Die Therapieentscheidung ist komplex und es ist deshalb empfehlenswert den Patienten an einem Zentrum mit entsprechender Erfahrung vorzustellen.
Als prinzipielle Therapieoptionen kommen eine „Watch-and-Wait“-Strategie, radikale Chirurgie, perkutane oder medikamentöse Therapie in Frage. Die Entscheidung, welche Therapie für den individuellen Patienten die beste ist, hängt vom Stadium der Erkrankung, der Größe und Lokalisation der Zyste sowie eventuellen Komplikationen ab 46.
In den Stadien CE4 und CE5 (inaktive Zysten) ist eine zurückhaltende Herangehensweise angebracht und die Morphologie und Größe der Zyste sollten zunächst im Verlauf mittels Bildgebung kontrolliert werden.
Die chirurgische Resektion ist Therapie der ersten Wahl bei großen (>5 cm) Zysten im Stadium CE2 und 3 mit multiplen Tochterzysten, Zysten, die mit dem Gallenwegssystem kommunizieren, und bei allen Zysten, die Druck auf vitale Organe ausüben. Bei oberflächlich gelegenen Leberzysten mit Risiko einer Ruptur (traumatisch oder spontan) sowie superinfizierten Zysten kann die chirurgische Entfernung indiziert sein, wenn eine perkutane Behandlung nicht möglich ist. Kontraindiziert ist die chirurgische Entfernung bei inaktiven asymptomatischen Zysten, schwer zugänglichen und sehr kleinen Zysten.
Die perkutane Therapie mittel PAIR (Puncture, aspiration, injection, re-aspiration) ist vor allem in Entwicklungsländern von Bedeutung. Hierbei wird perkutan der Zysteninhalt aspiriert, anschließend eine protoscolizide Substanz instilliert und wieder aspiriert. Im europäischen Kontext kommt sie für inoperable Patienten und solche, die eine chirurgische Therapie ablehnen, in Frage, ebenso für Patienten mit einem Rezidiv. Die Therapie sollte generell bei begleitender Therapie mit Albendazol durchgeführt werden. Besonders erfolgreich ist sie bei großen Zysten mit mehr als 5 cm Durchmesser. Kontraindiziert ist sie bei Zysten im Stadium CE2, 3b, 4 und 5 und für Lungenzysten.
Eine rein medikamentöse Therapie mit Albendazol ist bei Patienten mit inoperablen Zysten in Leber oder Lunge, mit Multiorganbefall oder peritonealen Zysten indiziert. Besonders gut sprechen kleine Zysten (<5 cm) an. Nach einer 3-6-monatigen Therapie können 30% der Patienten als geheilt angesehen werden. Bei einigen Patienten ist eine dauerhafte Therapie notwendig. Weniger effektiv ist die Therapie bei großen Zysten (>10 cm). Kontraindiziert ist die alleinige medikamentöse Therapie wenn das Risiko einer Zystenruptur besteht und in der Frühschwangerschaft. Vorsicht ist bei Patienten mit chronischen Lebererkrankungen und Knochenmarksdepression geboten. Eine engmaschige Kontrolle von Blutbild und Leberwerten ist notwendig. Die Standarddosis des Albendazols ist bei der zystischen Echinokokkose, wie bei der alveolären 10-15 mg/kg Körpergewicht, verteilt auf zwei Tagesdosen, die zu einer fettreichen Mahlzeit eingenommen werden sollten.
Bei pulmonalen Zysten wird generell eine chirurgische Therapie angestrebt, obwohl Albendazol bei kleinen Zysten eine gute Wirkung gezeigt hat. Bei größeren sollte perioperativ auf Albendazol verzichtet werden, da dies zu einer Zystenruptur führen kann. Bei Knochenbefall ist die radikale Chirurgie Mittel der Wahl, ebenso wie bei kardialer Echinokokkose. Mit 0,5-2% aller Fälle sind beide Manifestationen extrem selten 27.
Echinokokkose bei Immundefizienz
Systematische Untersuchungen zum Verlauf von AE und CE bei Immundefizienz gibt es kaum. Die meisten Daten existieren zur AE und Lebertransplantation 15. Hier werden unter der immunsuppressiven Therapie Rezidive im Sinne von Befall des Transplantates und auch disseminierte AE-Verläufe beschrieben, so dass immer eine anthelminthische Therapie nach Transplantation indiziert ist 27. Eigenen Beobachtungen zufolge scheint eine rasche Progredienz der AE unter TNF-alpha Blocker-Therapie aufzutreten, die Erkrankung ist aber durch Benzimidazole zu stabilisieren. Akzelerierte und disseminierte Verläufe von zystischer und alveolärer Echinokokkose sind auch bei einer Koinfektion mit HIV beschrieben. Dies ist jedoch bisher nicht systematisch untersucht worden 47, 48, 49, 50, 51. Zusätzlich gibt es ein starkes Interaktionspotential der anthelminthischen Therapie mit der antiretroviralen Therapie, insbesondere Proteaseinhibitoren. Hier ist eine besonders engmaschige Kontrolle der Leberwerte notwendig und Spiegelbestimmungen der entsprechenden Medikamente mit spiegeladaptierter Dosisanpassung 52.
Abschließende Bemerkungen
Durch Anamnese, epidemiologische Daten, Bildgebung und Serologie gelingt es in den allermeisten Fällen zwischen AE und CE sicher zu unterscheiden. Herausforderungen stellen Patienten mit atypischen Herden aus Gebieten dar, wo sich die Endemiegebiete der Erkrankungen überlappen (Türkei, China, Russland). Auch hier kann in interdisziplinärer Kooperation zwischen Internisten, Chirurgen auch mit dem Konsiliarlabor für Echinokokkose und Referenzpathologie die Diagnose gesichert und ein Leitlinien-adaptiertes Therapiekonzept für den individuellen Patienten erarbeitet werden. Die Behandlung der Echinokokkose an einem Zentrum, das Erfahrung mit der Erkrankung hat, ist empfehlenswert, insbesondere im Kontext von Immunsuppression.
Die Bilder wurden freundlicherweise zur Verfügung gestellt:
Prof. Dr. Thomas F.E. Barth, Institut für Pathologie,
Universitätsklinikum Ulm (pathologische Makro- und Mikro-Präparate)
Prof. Dr. Hans-Jürgen Brambs, Ärztlicher
Direktor, Klinik für
diagnostische und interventionelle Radiologie, Universitätsklinikum Ulm
(MRT-und CT-Aufnahmen)
Prof. Dr. Klaus Buttenschön, ehemals Klinik
Chirurgie I, Universitätsklinikum Ulm,
jetzt: Department of Surgery, Division General Surgery, University of Alberta,
Edmonton, Alberta, Canada (intraoperative Aufnahmen)
Prof. Dr. Wolfgang Kratzer, Klink für Innere Medizin I,
Universitätsklinikum Ulm (Sonografie Aufnahmen)
Prof. Dr. med. Sven Norbert
Reske, Ärztlicher Direktor Klinik für Nuklearmedizin, Universitätsklinikum Ulm
(FDG-PET-CT-Aufnahmen)
literatur
1 Deplazes P, Hegglin D, Gloor S, Romig T. Wilderness in the city: the urbanization of Echinococcus multilocularis.
Trends Parasitol 2004;20:77–84
2 Romig T. Spread of Echinococcus multilocularis in Europe? In: Craig P, Pawlowski Z, editors.
Cestode zoonosis: echinococcosis and cysticercosis. Amsterdam: IOS Press; 2002. p. 65–80.
3 Ammann RW, Eckert J. Cestodes. Echinococcus. Gastroenterol Clin North Am. 1996 Sep;25(3):655-89
4 Moro P, Schantz PM. Echinococcosis: a review. Int J Infect Dis 2009; 13(2): 125-133
5 Kern P, Bardonnet K, Renner E, Auer H, Pawlowski Z, et al. European echinococcosis registry: human alveolar echinococcosis, Europe, 1982-2000. Emerg Infect Dis 2003;9:343-9
6 Eckert J. The “ dangerous fox tapeworm” (Echinococcus multilocularis) and alveolar echinococcosis of humans in central Europe. Berl Munch Tierärztl Wochenschr 1996 Jun-Jul; 109(6-7):202-10
7 Nothdurft HD, Jelinek T, Mai A, Sigl B, von-Sonnenburg F, Löscher T.Epidemiology of Echinococcus in Bavaria. Dtsch Med Wochenschr1995; 120: 1151-1155
8 Epidemiologisches Bulletin 05/2011, Februar 2011. Robert-Koch-Institut Berlin.Verfügbarunter:http://www.rki.de/cln_151/nn_196014/DE/Content/Infekt/EpidBull/Archiv/2010/46__10,templateId=raw,property=publicationFile.pdf/46_10.pdf
9 Schweiger A, Amann RW, Candinas D et al. Human alveolar echinococcosis after fox population increase, Switzerland. Emerg Infect Dis 2007;13:878-882
10 Torgerson PR, Keller K, Magnotta M, Ragland N. The Global Burden of Alveolar Echinococcosis. PLoS Negl Dis 2010; 4(6):e 722
11 Wilson JF, Rausch RL. Alveolar hydatid disease: A review of clinical features of 33 indigenous cass of Echinococcus multilocularis infection in Alaskan Eskimos. Am J Trop Med Hyg 1980 (29): 1340-1355
12 Storandt ST, Virchow DR, Dryden MW, Hygnstrom SE, Kzacos KR Distribution and prevalence of Echinococcus multilocularis in wild predators in Nebraska, Kansas, and Wyoming. J Parasitol 2002;88:420–2
13 Craig P. Echinococcus multilocularis. Curr Opin Infect Dis. 2003;16(5): 437-44. Review.
14 Craig PS, Deshan L, Macpherson CNL, et al. A large focus of alveolar echinococcosis in central China. Lancet 1992¸340: 826-831
15 Bresson-Hadni S, Koch S, Miguet JP, Gillet M, Mantion GA, Heyd B, Vuitton DA; European group of clinicians. Indications and results of liver transplantation for Echinococcus alveolar infection: an overview. Langenbecks Arch Surg. 2003; 388(4):231-8.
16 Pawlowski Z, Eckert J, Vuitton DA et al. Echinococcosis in humans: clinical as-pects, diagnosis and treatment. In: Manual on Echinococcosis in Humans and Animals: a Public Health Problem of Global Concern. Edited by J. Eckert, M.A. Gemmell, F.-X. Meslin, Z.S. Pawlowski (editors). Paris: World Organisation of Animal Health; 2001. pp. 20-66.
17 Miguet J-P, Bresson-HadniS Alveolar echinococcosis of the liver. J Hepatol 1989; 8:373-9
18 Kern P, Wechsler J.G., Lauchart W, Kunz R: Klinik und Therapie der alveolären Echinokokkose. Dtsch.Ärztebl. 1994;91,:1857-1863
19 Schantz PM, van den Bosche H, Ecklert J. Chemotherapy for larval echinococcosis in animals and humans: report of a workshop. Zeitschrift für Parasitenkunde 1982; 67: 5-26
20 Torgerson PR, Schweiger A, Deplazes P et al. Alveolar echinococcosis: from a deadly disease to a well-controlled infection. Relative survival and economic analysis in Switzerland over the last 35 years. J Hepatol 2008;49:72-7
21 Bresson-Hadni S, Laplante JJ, Lenys D, et al. Seroepidemiologic screening of Echinococcus multilocularis infection in an European area endemic for alveolar echinococcosis. Am J Trop Med Hyg 1994: 51: 837
22 Romig T, Kratzer W, Kimmig P, et al. An epidemiological survey of human alveolar echinococcosis in southwestern Germany. Am J Trop Med Hyg 1999; 61: 566-773
23 Reuter S, Buck A, Manfras B, Kratzer W, Seitz HM, Darge K, Reske SN, Kern P: Structured treatment interruption in patients with alveolar echinococcosis. Hepatology 2004; 39: 509-17
24 Kern P, Kratzer W, Reuter S. Alveoläre Echinokokkose: Diagnose. Deutsche Medizinische Wochenschrift 2000; 125: 59-62
25 Bresson-Hadni S, Delabrousse E, Blagosklonov O, Bartholomot B, Koch S, Miguet JP, et al. Imaging aspects and non-surgical interventional treatment in human alveolar echinococcosis. Parasitol Int 2006;55:S267–72
26 Ito A, Craig PS. Immunodiagnostic and molecular approaches fort he detection of taeniid cestode infections. Trends Parasitol. 2003;19:377-81
27 Brunetti E, Kern P, Vuitton DA, Writing Panel for the WHO-IWGE. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Trop 2010;114:1-16.
28 Kern P. Clinical features and treatment of alveolar echinococcosis. Curr Opin in Infect Dis 2010; 23: 505-12
29 Kern P, Wen H, Sato N et al. WHO classification of alveolar echinococcosis: principles and application. Parasitology International 2006;55 Suppl.:283-7
30 Ammann R (1995). Richtlinien zur Behandlung der zystischen und alveolären Echinokokkose beim Menschen. Klinische Wochenschrift 411-463
31 Kern P, Kratzer W, Reuter S (2000). Alveoläre Echinokokkose: Therapie. Deutsche Medizinische Wochenschrift 125
32 WHO-Arbeitsgruppe zur Echinokokkose (1997). Richtlinien zur Behandlung der zystischen und alveolären Echinokokkose beim Menschen. Chemotherapie-Journal 3: 111-120
33 Reuter S, Grüner B, Buck AK et al. Long-term follow-up of metabolic activity in human alveolar echinococcosis using FDG-PET. Nuklearmedizin 2008; 47: 147-152
34 Kadry Z., Renner EC, Bachmann LM et al. Evaluation of treatment and long-term follow-up in patients with hepatic alveolar echinococcosis. Br J Surg 2005;92:1110-16
35 Harbart ST, Nothdurft HD, v. Sonnenburg F (1995): Die Fuchsbandwurmerkrankung (Alveoläre Echinokokkose) bei Landwirten als Berufskrankheit gemäß Nr. 3102 der Berufskrankheiten-Verordnung (BeVK).Arbeitsmed.Sozialmed.Umweltmed. 30: 203-206
36 Kern P, Ammon A, Kron M, et al. Risk factors for alveolar echinococcosis in humans. Emerg Infect Dis 2004; 10:2088-93
37 Eckert J, Deplazes P Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern. Clin Microbiol Rev 2004;17:107–35
38 Conchedda M, Antonelli A, Caddori A, Gabriele F. A retrospective analysis of human cystic echinococcosis in Sardinia (Italy), an endemic Mediterranean region, from 2001 to 2005. Parasitol Int. 2010 Sep;59(3):454-9
39 Eckert J., Schantz PM., Gasser RB, Torgerson PR, Bessonov AS, Movsessian SO, Grimm F, Nikogossian MA. Geographic distribution and prevalence. WHO/OIE Manual on echinococcosis in humans and animals, 2001, p 100-142
40 Kern P: “Echinococcus granulosus infection: clinical presentation, medical treatment and outcome” Langenbecks Arch Surg 2003; 388(6): 413-20
41 Payne L, Fitchett JR: “Bringing neglected tropical diseases into the spotlight” Trends Parasitol, 2010; 26(9): 421-64
42 Caremani M, Maestrini R, Occhini U, Sassoli S, Accorsi A, Giorgio A, Filice C. Echographic epidemiology of cystic hydatid disease in Italy. 1993, Eur J Epidemiol; 9: 401-404
43 Frider B, Larrieu E, Odriozola M. Long-term outcome of asymptomatic liver hydatidosis. 1999. J Hepatol; 30: 228-231
44 Campos-Bueno A, Lopez-Abente G, Andres-Cercadillo AM. Risk factors for Echinococcus granulosus infection: a case-control study. 2000, Am J Trop Med Hyg; 62: 329-334
45 Macpherson CNL. Epidemiology fo Echinococcus granulosus in transhumant situations, p 156-163. In J. Eckert, MA Gemmell, F-X Meslin, and ZS Pawlowski (ed.) WHO/OIE manual on echinococcosis in humans and animals: a public health problem of global concern. World Organisation for Animal Health, Paris, France, 2001
46 Menezes da Silva A, Hydatid cyst of the liver – criteria fort he selection of appropriate treatment. Acta Trop, 2003; 85: 237-242
47 Chopdat N, Menezes CN, John M-A, Mahomed N, Grobusch MP: “A Gardener who coughed up blood” The Lancet, 2007; 370: 1520
48 Kakrani AL, Chowdhary VR, Bapat VM: “Disseminated pulmonary hydatid disease presenting as multiple cannon ball shadows in human immunodeficiency virus infection” JAPI, 2000; 48(12): 1208-9
49 Ramos JM, Masia M, Padilla S, Bernal E, Martin-Hidalgo A, Gutiérrez F: “Fatal infection due to larval cysts of cestodes (neurocysticercosis and hydatid disease) in human immunodeficiency virus (HIV) infected patients in Spain: a report of two cases” Scand J Infect Dis, 2007; 39: 719-23
50 Sailer M, Soelder B, Allerberger F, Zaknun D, Feichtinger H, Gottstein B: “Alveolar echinococcosis of the liver in a six-year-old girl with acquired immunodeficiency syndrome” J Pediatr, 1997; 130: 320-3
51 Shenoy VV, Joshi SR, Aklujkar AP, KotwalVS, Nadkarni NA, Ramraje NN: “Pulmonary Hydatid Cyst in HIV-1 Disease” JAPI, 2005; 53:1070-2
52 Zingg W, Renner-Schneiter EC, Pauli-Magnus C, Renner EL, van Overbeck J, Schläpfer E, Weber M, Weber R, Opravil M, Gottstein B, Speck RF, and the Swiss HIV Cohort Study: “Alveolar Echinococcosis of the Liver in an Adult with Human Immunodeficiency Virus Type-1 Infection” Infection, 2004; 32: 299-302