Ansgar Rieke, Koblenz
Antiretrovirale Therapie und Niere
Der Anteil HIV-Infizierter, die älter als 50 Jahre sind, nimmt rapide zu und das mediane Alter der Betroffenen in Deutschland hat bereits das 50. Lebensjahr erreicht. Damit werden altersbezogene Erkrankungen in den nächsten Jahren ein wichtiges Kriterium für die Auswahl einer antiretroviralen Therapie sein. Nierenerkrankungen und -funktionseinschränkungen kommen dabei besondere Bedeutung zu.
![Abb. 1 Jährlicher Verlust an Nierenfunktion. DETAIL Studie: Veränderung der Glomerulären Filtrationsrate (GFR). Nach Empfehlungen von Freeman (Freeman JW, S D J Med 49 [12]:439, 1996) sollte ab dem 65. Lebensjahr die Medikamentendosierung um 10%, ab dem 75. Lebensjahr um 20% Prozent reduziert werden.](images/FoBi_Rieke-001.jpg)
Abb. 1 Jährlicher Verlust an Nierenfunktion. DETAIL Studie: Veränderung der Glomerulären Filtrationsrate (GFR). Nach Empfehlungen von Freeman (Freeman JW, S D J Med 49 [12]:439, 1996) sollte ab dem 65. Lebensjahr die Medikamentendosierung um 10%, ab dem 75. Lebensjahr um 20% Prozent reduziert werden.
Die Nierenfunktion nimmt mit dem Alter ab und in der Altersgruppe der über 70Jährigen ist auch ohne HIV mit einer Prävalenz chronischer Nierenerkrankungen von etwa 30% zu rechnen. Ab dem 40. Lebensjahr muss von einer Minderung der eGFR um 8 ml/Min/1,73 m2/Jahrzehnt ausgegangen werden. Bei schlecht eingestelltem Diabetes mellitus ist der Verlust an GFR/Jahr etwa 12 ml/Min/1,73 m2 (Abb. 1). Deshalb muss für die Nierengesundheit vor allem auf eine exakte Diabeteseinstellung und Blutdruckeinstellung auf Zielwerte um 130/80 mmHg geachtet werden.
Kohortenanalysen belegen, dass bei einer HIV-Infektion das renale Risiko noch einmal deutlich höher ist. HIV selbst kann die Niere schädigen. Zudem sind Nikotin, Alkohol, Substanzmissbrauch, die die Vulnerabilität der Niere erhöhen, bei HIV-Betroffenen häufiger anzutreffen. Hinzu kommt, dass andere Erkrankungen, die im Alter häufiger vorkommen (z.B. rheumatische Erkrankungen, degenerative Skelettveränderungen usw.), sowie deren Therapie (z.B. nichtsteroidale Antirheumatika) die Niere schädigen. Die antivirale Therapie muss darauf Rücksicht nehmen und robust genug sein, einer akuten Verschlechterung der glomerulären Filtrationsrate ohne eigene zusätzliche Toxizität zu begegnen.
Screening
Leitsymptome einer renalen Schädigung sind die Proteinurie und Erythrozyturie mit dem Bild eines nephritischen Sedimentes, wenn glomeruläre Schäden Ursache sind. Eine Vielzahl von Begleiterkrankungen und Infektionen können Ursache des Nierenschadens sein, insbesondere eine Lues, eine chronische Hepatitis B, eine chronische Hepatitis C und andere STI, die unter dem Bild einer Glomerulonephritis auffällig werden können.
Jeder Patient sollte gemäß Leitlinien vor Beginn der antiviralen Therapie und danach zumindest jährlich mit Urin-streifentest und Kreatinin-basierter eGFR auf die Anzeichen einer Glomerulonephritis, einer Minderung der glomerulären Filtrationsrate und auf das Vorhandensein eines nephritischen Sedimentes hin untersucht werden.
Bei einer Kombinationstherapie aus Tenofovir Diproxil und Cobicistat sollten diese Kontrollen häufiger, im ersten Behandlungsjahr monatlich und dann vierteljährlich, erfolgen. Die Daten zu Tenofovir Alafenamid (TAF) legen nahe, dass man aufgrund des besseren renalen Sicherheitsprofils auf die monatlichen Kontrollen im ersten Jahr verzichten kann.
Häufigere Kontrollen können auch indiziert sein bei Patienten mit Nierenerkrankungen in der Vorgeschichte oder in der Familienanamnese sowie bei Patienten mit entsprechenden Risikofaktoren z.B. Diabetes mellitus, nephrotoxische Komedikation inklusive ACE-Hemmer und AT1-Inhibitoren, kardiovaskulären Erkrankungen, metabolischem Syndrom und/oder arterieller Hypertonie.
Bei einem Abfall der eGFR <60 ml/Min/1,73 m2 sollte in aller Regel ein Nephrologe hinzugezogen werden. Hier spielt die Dynamik des Nierenfunktionsverlustes eine besondere Rolle: Bei schnellem Verlust der GFR im Sinne eines akuten Nierenversagens ist dies als mögliche Rapid Progressive Glomerulonephritis ein Notfall.
Bei Patienten mit eingeschränkter Nierenfunktion sollte bei den Routinekontrollen Parameter des Knochenstoffwechsels wie Calcium, Phosphat, Parathormon und Vitamin D-Status miterfasst werden. Die Bestimmung eines 24 Stunden-Sammelurins auf Protein ist nicht zu empfehlen, sondern vielmehr die Bestimmung des Urin-Protein-Kreatinin-Quotienten im Spontanurin. Relevant ist eine Urin-Protein-Kreatinin-Konzentration von >0,3 g/Tag. Eine Proteinurie >1 g/Tag sollte eine nephrologische Mitbetreuung auslösen.
Warnzeichen
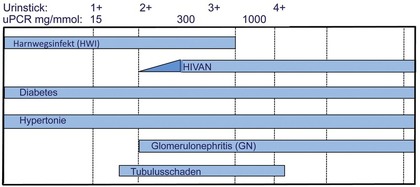
Abb. 2 Proteinurie
Eine Mikroalbuminurie bei HIV-Patienten ist ein Prädiktor für eine spätere Proteinurie und kann wie beim Diabetes mellitus Frühzeichen einer renalen Schädigung sein (Abb. 2). Dennoch ist (bisher) die regelmäßige Durchführung eines Micraltestes (sensitiver immunologischer semiquantitativer Teststreifen zur Bestimmung von Albumin im Urin) nicht Bestandteil der Routinekontrollen bei HIV. Weitere Prädiktoren für eine Proteinurie bei HIV sind eine milde Proteinurie zu Beginn der ART, eine Einschränkung der GFR auf <90 ml/Min und der Gebrauch von Tenofovir Diproxil in Verbindung mit geboosterten Proteaseinhibitoren. Risikofaktoren für einen proximal-renalen tubulären Schaden sind Lebensalter, Dauer der antiviralen Therapie, die Ausgangs-GFR, ein arterieller Hypertonus und eine Hepatitis-C-Koinfektion.
HIV-typische Veränderungen
Als HIV-typische Nierenerkrankung gilt die HIV-assoziierte Nephropathie (HIV-AN), die 1984 erstmals beschrieben wurde und die durch Wechselwirkung des humanen Gens MYH9 mit HIV unter einem benachbarten Apolipoprotein-L1-Gen überwiegend bei Menschen schwarzafrikanischem Ursprungs auftritt. Die Mutation des APO-L1-Gens hat einen evolutionären Vorteil in der Bewältigung der Schlafkrankheit, darin ist die ethnische Häufung begründet. Die 1-Jahresmortalität ohne ART beträgt 50%. Die frühzeitige ART kann den Verlust der Nierenfunktion bis hin zu einem ESRD (Endstage Renal Disease) meist verhindern. Histologisch handelt es sich bei der HIV-AN typischerweise um eine fokal-segmental sklerosierende Glomerulonephritis.
In Deutschland findet man bei HIV-Patienten häufig auch Formen einer IgA-Nephropathie, deren Verlauf von Ausmaß und Neigung zu sklerosierten Glomeruli bestimmt wird. In jedem Fall sollte eine Proteinurie und Verschlechterung der Nierenfunktion Anlass sein, mit einer antiviralen Therapie umgehend zu beginnen. Die Ergebnisse der START-Studie legen zudem nahe, dass die frühzeitige ART die Häufigkeit renaler Schädigungen durch die HIV-Infektion ähnlich wie die von Leber- und Herzkreislauf-Erkrankungen vermindert.
Medikamentös-toxische Nierenschäden
Medikamente können an der Niere medikamentös-allergische oder auch Autoimmunreaktionen auslösen, die humoral oder T-Zell vermittelt sind und zu einer Niereninsuffizienz führen können. Selbst der einmalige Einsatz eines Analgetikums (z.B. Ibuprofen) kann zu einem akuten Nierenversagen führen. Dies ist auch bei jeder antiviralen Therapie denkbar. Deshalb muss beim Beginn der ART bzw. bei einem Wechsel stets kurzfristig die Nierenfunktion überprüft werden. Ein akutes Nierenversagen oder akute Tubulusnekrosen sind unter Ganciclovir, Aciclovir, zahlreichen Antibiotika (z.B. Aminoglykosiden, Cephalosporinen), unter Pentamidin und unter antihypertensiver Therapie, hier insbesondere unter ACE-Hemmern und AT1-Inhibitoren, beschrieben.
Eine
akute allergische interstitielle Nephritis kann im Rahmen einer
Hypersensitivitätsreaktion z.B. unter Abacavir entstehen. Unter
Atazanavir und dem Fusionsinhibitor
T20 wurden membrano-proliferative
Glomerulonephritiden beschrieben ebenso unter Ritonavir und
Efavirenz. Unter Indinavir waren früher Kristall-assoziierte
Nephropathien
häufig, wobei die Kristalle erst in Verbindung mit
Calcium röntgendicht waren und gegenüber röntgentransparenten
Uratsteinen abgegrenzt werden konnten. Weitere Substanzen, die über
Kristallbildung zur Nephrolithiasis führen
können sind
Ampicillin, Aciclovir, Aspirin, Ciprofloxacin, Methotrexat, Vitamin
C, Sulfonamide und Medikamente, die zu einer Erhöhung der Harnsäure
führen.
Tubulo-toxische Schäden
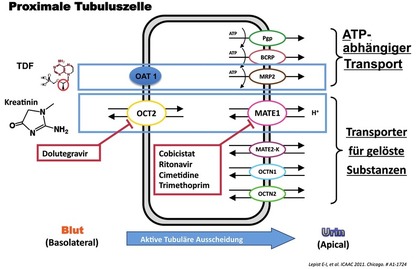
Abb. 3 Alternative Kreatininausscheidung über aktive tubuläre Ausscheidung
Neben der glomerulären Filtration von Kreatinin ist auch ein alternativer Ausscheidungsweg durch Transporter des tubulären Systems möglich (Abb. 3). Im proximalen Tubulus führt der Transporter OCT2 zu einer Aufnahme von Kreatinin mit dem Blut in die Tubuluszelle, das dann über MATE1 in den Urin sezerniert wird. Der Integrasehemmer Dolutegravir hemmt dieses OCT2, der Pharmacoenhancer Cobicistat dagegen MATE1. Beide Substanzen blockieren also den alternativen Ausscheidungsweg über die Tubuluszelle, was zu einem milden Anstieg des Kreatinins (im Mittel 0,14 mg/dl) bzw. zu einer Minderung der geschätzten eGFR von etwa 15 ml führt. Diese Veränderungen bedeuten keinen wahren Verlust an renaler Funktion, sondern sind über die genannten Transportmechanismen erklärbar. Bei Kombination dieser Substanzen mit Tenofovir Diproxil ist besondere Vorsicht geboten, denn eine echte Nierenfunktionsverschlechterung ist unter Umständen nur schwer von der oben beschriebenen Störung zu unterscheiden, was wiederum die Entscheidung über eine Dosisreduktion von Tenofovir Diproxil ab einer GFR <60 ml/Min kompliziert. Aus diesem Grund sollte die Fixkombination TDF/FTC/Elvitegravir/c nur bei Patienten mit einer eGFR >90 ml eingesetzt werden. Die neue Fixkombination TAF/FTC/Elvitegravir/c kann dagegen bei einer GFR bis zu >30 ml/Min gegeben werden.
Tenofovir selbst wird neben der glomerulären Filtration über den Transporter OAT1 in die Tubuluszelle aufgenommen, um dann aktiv (ATP-abhängig) über MRP2 und 4 als Transporter in den Urin des proximalen Tubulus sezerniert zu werden. Fällt die wahre Filtration im Glomerulum ab, etwa beim akuten Nierenversagen, wird versucht, mehr TDF über die Tubuluszelle zu eliminieren (erhöhte Aktivität von OAT1). Daraus resultiert eine Konzentrationssteigerung von TDF in der proximalen Tubuluszelle, was zu einem mitochondrialen Schaden und zu einem Abfall der energieabhängigen Stofftransporte führen kann. Tatsächlich kann dieser konzentrationsabhängige Schaden von TDF an der Tubuluszelle gezeigt werden und führt besonders bei Patienten mit niedrigem Körpergewicht zum Bild eines Fanconi-Syndroms, bei dem die notwendige Rückresorption lebenswichtiger Substanzen im Urin reduziert ist. Klinisch zeigt sich dies als Glukosurie, Phosphaturie und meist milde Proteinurie.
Verbesserung durch TAF
Durch die um etwa 90% reduzierte Plasmakonzentration des neuen Tenofovir Alafenamid (TAF) ist das Risiko einer tubulären Schädigung unter TAF im Vergleich zu Tenofovir Diproxil deutlich geringer, denn die Transportkapazitätsgrenze der Tubuluszelle wird meist nicht mehr überschritten. In der Tat belegen die Zulassungsstudien von TAF/FTC/EVG/c, dass dieses Regime auch bei niereninsuffizienten Patienten bis zu einer Grenze von 30 ml/Min/1,73 m2 eingesetzt werden kann. Selbst bei einem typischen Fanconi-Syndrom (Tubulusschaden) unter Tenofovir-Diproxil in der Anamnese darf die TAF-haltige Kombination laut Label (Zulassungstext) gegeben werden.
Durch die Tubulusstörung unter TDF-Diproxil ist es in der Vergangenheit wahrscheinlich viel stärker zu einem Verlust von Phosphat, Aminosäuren und Bicarbonat über den Urin gekommen als sich im klinischen Alltag messen ließ. Möglicherweise sind dies Gründe für Veränderungen des Knochenstoffwechsels, die unter Tenofovir beobachtet wurden. Die unter TAF gezeigten geringeren Knochen-Veränderungen im Dexa Scan sind aus nephrologischer Perspektive am ehesten dadurch bedingt, dass die für den Knochen wichtigen Substanzen in ausreichender Weise von der Tubuluszelle in den Körper rückresorbiert werden. Aus nephrologischer Sicht ist TAF somit besser als das herkömmliche Tenofovir Diproxil und sollte bevorzugt eingesetzt werden. Insbesondere renal besonders vulnerable Patienten, wie Ältere, Drogengebraucher, Hypertoniker, Diabetiker, Patienten unter Chemotherapie, Patienten, die NSAR einnehmen, usw., sollten auf TAF umgestellt werden.
Hypophosphatämien, die bei etwa 10% der HIV-Patienten zu finden sind, gibt es auch unter Alkoholeinfluss, Diabetes, Kachexie, anhaltenden Diarrhoen oder bei Störung des Vitamin D-Stoffwechsels oder bei Hyperparathyreoidismus. Die Gründe sind vielfältig und reichen von einer zu geringen Phosphataufnahme, dem Einsatz von Diuretika, Erbrechen, bis zu den Zeichen eines Fanconi-Syndroms. Eine Vitamin-D-Substitution wird an vielen Stellen bereits empfohlen, sollte aber wegen der Gefahr einer iatrogenen Hypercalcämie mit Augenmaß durchgeführt werden.
TAF/Tenofovir Alafenamid
Als wirksame Substanz muss Tenofovir (TFV) über den Weg der oralen Medikamentenaufnahme via Plasma in die HIV-infizierte Zielzelle gelangen. Dies geschah bisher über die oral resorbierbare Form des Tenofovir Disoproxil Fumarates (TDF). Die Weiterentwicklung Tenofovir Alafenamid ermöglicht gegenüber TDF eine um ca. 90% reduzierte Plasmakonzentration, bei der mit gleicher Konzentration und Wirksamkeit dieselbe Menge des TFV in die Zielzelle gelangt. Entsprechend ist TAF keine neue Substanz, sondern TFV mit einem neuen Carrier-Molekül. Durch die Dosisreduktion im Plasma scheint auch das Risiko einer Kumulation in der Tubuluszelle vermindert, da deutlich weniger Substanz hier alternativ ausgeschieden wird. Deshalb kann TAF auch bis zu einer GFR von 30 ml eingesetzt werden. In den Zulassungsstudien und beim Einsatz an niereninsuffizienten Patienten konnte eine Verbesserung der Proteinurie und tubulären Proteinausscheidung beobachtet werden, wenn vom alten TDF auf TAF umgesetzt wurde (Abb. 4). Wahrscheinlich über den ungestörteren Phosphatmetabolismus scheint die Substanz auch knochenfreundlicher zu sein. Es ist zu hoffen, dass durch die Umsetzung der zahllosen Kombinationen und STR-Regime, auf TAF-haltige Regime in Zukunft auch der schleichenden Verschlechterung der Nierenfunktion begegnet werden kann.
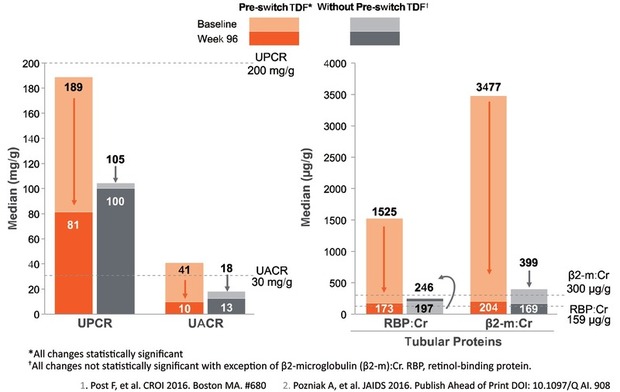
Abb. 4 Switch von Regime mit TDF oder ohne TDF auf TAF/FTC/EVG/c bei Patienten mit eingeschränkter Nierenfunktion (eGFR 30-69 ml/Min)
Überprüfung auf tubuläre Schäden
Patienten mit einem echten Fanconi-Syndrom unter TDF dürfen auf TAF umgesetzt werden, ebenso Patienten mit Proteinurie oder Niereninsuffizienz bis zu einer GFR von 30 ml/Min. Auch Atazanavir wird in Kohortenanalysen mit möglichen renalen Veränderungen in Verbindung gebracht, so wurde in der Eurosida-Kohorte ein 21% höheres Risiko für eine Niereninsuffizienz im Vergleich zu Atazanavir freien Kombinationen gesehen, dies war aber reversibel. Auch die Häufigkeit einer Nephrolithiasis unter Atazanavir ist umstritten und reicht von selten bis zu einer Fallanalyse der FDA mit 30 Fällen, die sich nach Absetzen in der Nierenfunktion vollständig erholten. Bei Patienten mit bekannter Nephrolithiasis, Nierenkoliken und Hämaturie in der Anamnese, ist Atazanavir (besonders geboostert) allerdings sicher keine zu bevorzugende Substanz.
Durch die Sensibilität im Umgang mit TDF-haltigen Schemata sind HIV-Therapeuten die Charakteristika eines medikamentös induzierten Fanconi-Syndroms bekannt: Eine Glucosurie bei einem Nicht-Diabetiker, eine Hypophosphatämie und eine Hypokaliämie sind Kennzeichen dieser Störung. Die in den TAF-Studien gezeigten Veränderungen einer tubulären Beta-2-Mikroglobulinausscheidung oder des Retinolbindenden Proteins könnten auch um die tubuläre Phosphatrückresorptionskapazität/GFR (TmPO4/GFR) erweitert werden, sind jedoch nicht Gegenstand der Routineüberprüfung des Patienten unter Therapie und sollte Studien überlassen werden, die sich anhand dieser Surrogatparameter mit tubulären Schäden beschäftigen.
Niereninsuffizienz und ART
Bei fortgeschrittener Niereninsuffizienz und Enstage Renal Disease (ESRD) mit einer GFR<30 ml/Min sollte, sofern es die Resistenzlage erlaubt, eine Nuke-freie Kombination eingesetzt werden. Dazu stehen Proteaseinhibitoren, Dolutegravir, Raltegravir oder Maraviroc zur Verfügung, die als „Nieren-neutrale Lösung“ eingesetzt werden können. Die derzeit durchgeführten ART-Studien mit einer Nuke-freien Therapie sollten Grundlage für die Entscheidung für den Einsatz bei Niereninsuffizienz sein. Eine Kombination aus geboostertem PI und Dolutegravir (z.B. Darunavir/r + Dolutegravir oder PI/r + Raltegravir) sind gute Therapieoptionen. Gleichzeitig ist auf die Multimorbidität und die meist umfangreiche Medikamentenliste eines niereninsuffizienten Patienten zu achten. Raltegravir kommt wegen des geringen Interaktionspotentials besondere Bedeutung zu.
Zusammenfassung:
Bei der immer älter werdenden Gruppe von HIV-Patienten stellt der schleichende Verlust an Nierenfunktion einen höheren Anspruch an die Auswahl der antiviralen Therapie als noch zum Beginn der ART-Ära. Nuke-freie Therapieoptionen sind ein Gewinn bei einem fortgeschrittenen Nierenschaden und Dialysepflichtigkeit und sollten aus nephrologischer Sicht für diese Situation ‚aufbewahrt‘ werden. Eine genaue Kenntnis des Patienten, seiner renalen Vulnerabilität und seiner Lebensweise sind notwendig, um eine ART sicher auszuwählen. Bei nachgewiesener virologischer Wirksamkeit sollte das neue Tenofovir Alafenamid alle Substanzkombinationen mit TDF verdrängen, wenn diese in der entsprechenden Kombinationstherapie zugelassen sind.