The International Liver Congress, Easl, Amsterdam, 19.-23. April 2017
 EASL 2017 – Die Highlights
EASL 2017 – Die Highlights
Der Internationale Leberkongress in Amsterdam hat wieder einmal über 10.000 Hepatologen aus aller Welt an-gezogen. Die Stimmung war sehr entspannt, denn bahnbrechende Neuigkeiten wurden nicht erwartet. Die Hepatitis C ist ganz klar nicht mehr der Mittelpunkt der Leberkonferenzen. Hier sind nur noch einige wenige neue Substanzen bzw. Fixkombinationen im Rennen, die aber ein interessantes Profil haben. Bei der Hepatitis B waren die neuen EASL-Leitlinien das Highlight. In den anderen Bereichen wie NASH, Zirrhose und HCC gab es einzelne spannende Entwicklungen.
Neue Fixkombinationen

©
S. Heldwein
Die Zulassung der Fixkombinationen Glecaprevir/Pibrentasvir (GP) sowie Sofosbuvir/ Velpatasvir/Voxilaprevir (SVV) wird noch in diesem Jahr erwartet. Beide Kombinationen sind pangenotypisch und können einmal täglich gegeben werden. Eine Therapieverkürzung bei naiven Patienten ohne Zirrhose scheint bei fast (!) allen Genotypen möglich zu sein. Ein weiterer Pluspunkt ist die Wirksamkeit bei NS5A-vorbehandelten Patienten, wobei hier das letzte Wort noch nicht gesprochen ist.
Glecaprevir/Pibrentasvir
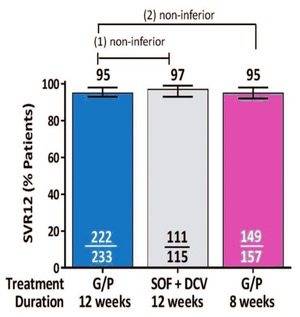
Abb. 1 ENDURANCE-3. Vergleichbare SVR-Raten nach 8 oder 12 Wochen Glecaprevir/Pibrentasvir oder 12 Wochen Daclatasvir+ Sofosbuvir. ITT-Analyse. Foster G et al., EASL 2017
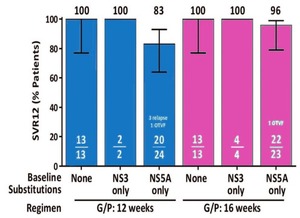
Abb. 2 MAGELLAN-1. SVR-Raten bei vorbehandelten Patienten gemäß NS3- und NS5A-RAS nach 12 bzw. 16 Wochen Glecaprevir/Pibrentasvir. Poordad F et al., EASL 2017
Zu GP wurden mehrere wichtige Studien vorgestellt. Frühere Studien hatten bereits gezeigt, dass die Therapie bei GT 1 und 2 sowie GT 4-6 bei therapienaiven Patienten ohne Fibrose/Zirrhose auf acht Wochen verkürzt werden kann. Das ist auch bei GT3-Patienten möglich. Die SVR-Raten nach 8 Wochen GP waren vergleichbar mit 12 Wochen GP bzw. 12 Wochen Sofosbuvir+Daclatasvir (95% vs. 95% vs. 97%) (Abb. 1). 10/381 Patienten unter GP hatten virologisch versagt, wobei es numerisch mehr Relapser bei der Verkürzung waren (5 vs. 3 vs. 1). Ein Zusammenhang mit Baseline-Polymorphismen wurde nicht beobachtet (Foster GR et al., GS-007). Auch bei HIV/HCV-Koinfizierten ist eine Verkürzung der Therapie möglich. Die SVR-Rate in EXPEDITION-2 lag bei 98%. Lediglich ein Patient mit GT3a erlitt einen Relaps (Rockstroh J et al., LBP-522).
Die Wirksamkeit von GP bei Patienten mit kompensierter Zirrhose bei GT 1, 2, 4, 5 und 6 wurde EXPEDITION-1 geprüft. 99% (145/146) der Patienten wurden geheilt.
60%
hatten GT 1 und 24% GT 2, 90% einen Child Pugh Score 5. 40% hatten
NS5A-Polymorphismen zu Baseline und 25% waren vorbehandelt ohne
NS5A-Hemmer. Lediglich bei einem Patienten mit GT 1a kam es zum
Relaps zu Woche 8 nach Therapie. Der Patient hatte bei Therapiebeginn
und beim Relaps NS5A-Resistenzen (RAS Baseline: Y93N; Relapse:
Q30R/H58D und Y93N). Die Verträglichkeit von GP insgesamt war sehr
gut. Am häufigsten waren leichte Kopfschmerzen (14%), Müdigkeit
(19%) und Juckreiz (10%). Es wurde kein relevanter Anstieg der
Transaminasen dokumentiert (Forns X et al., GS-006).
Island 2018 Hepatitis C-frei

©fotolia-faveteart
Erklärtes Ziel der WHO ist es, die Hepatitis C zu eliminieren. Dieses Ziel haben sich auch Georgien und Island gesetzt und schon begonnen, es in die Tat umzusetzen. In Georgien geht es eher langsam voran. Bei einer Prävalenz von 5% müssen 150.000 Patienten geheilt werden. Bisher wurden knapp 20.000 Patienten behandelt mit einer SVR von 80%. Das Ziel 2020 Hepatitis C-frei zu sein, wird daher wohl nicht erreicht werden. Deutlich besser sieht es in Island aus. Hier müssen bei einer Prävalenz von 0,3% lediglich 1.000 Patienten geheilt werden. 2016 begann das Programm und nach 9 Monaten sind bereits 406 Isländer behandelt mit einer SVR-Rate von 96%. 2018 wird Island dann als erstes Land Hepatitis C-frei sein. (Walker J et al., PS-125; Olafson S et al., PS-129)
In MAGELLAN-1 und -2 wurden „schwierige“ Patienten mit GP behandelt und zwar Patienten nach DAA-Versagen bzw. nach Leber- oder Nierentransplantation. An MAGELLAN-1 nahmen 91 Patienten mit GT 1 oder 4 nach DAA-Versagen teil. Nach 12 bzw. 16 Wochen GP lag die SVR bei 89% bzw. 91%. Es gab insgesamt nur 5 Patienten mit virologischem Versagen, wobei die Kombination von NS3- und NS5A-RAS ungünstig war. Dagegen wurden alle Patienten (13/13) mit einer Y93H zu Baseline geheilt (Abb. 2) (Poordad F et al., PS-156). An der Studie (siehe S. 5)MAGELLAN-2 nahmen 100 Patienten mit GT 1-6 nach Lebertransplantation (n=80) und Nierentransplantation teil. 32 hatten NS5A-Polymorphismen bei Therapiebeginn. Es wurde nur ein Relaps beobachtet bei einem Patient mit GT 3a. Relevante Interaktionen mit der immunsuppressiven Therapie wurden nicht beobachtet. Die Verträglichkeit war gut (Reau N et al.; LBO-03).
Sofosbuvir/Velpatasvir/Voxilaprevir
Zur
Dreierkombination SVV wurden keine neuen Therapiestudien vorgestellt,
aber u.a. verschiedene Auswertungen der POLARIS-Studien. So hatten
die bekannten negativen Prädiktoren wie
Zirrhose, Thrombozyten
<100.000/µl, DAA-Vorbehandlung usw. keinen Einfluss auf das
Ansprechen auf SVV (Roberts L et al., SAT-280). In einer deutschen
Analyse von POLARIS-1 und -4 wurde der Einfluss von Polymorphismen
bei DAA-vorbehandelten Patienten untersucht. Bestehende RAS hatten
keinen Einfluss auf das Outcome (Abb. 3) (Sarrazin C et al.,
THU-248).
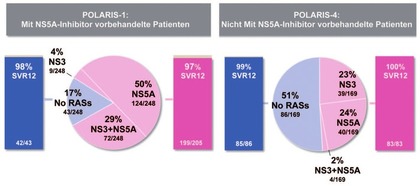
Abb. 3 SVR-Raten in Abhängigkeit von bestehenden RAS nach 12 Wochen Sofosbuvir/ Velpatasvir/Voxilaprevir bei DAA-vorbehandelten Patienten. Sarrazin, EASL 2017
Auch bei POLARIS-2 und -3 wurden die Baseline-Polymorphismen analysiert. In diesen Studien lag die SVR-Rate bei therapienaiven Patienten mit Genotyp 1a nach 8 Wochen SVV nicht im erwarteten Bereich. Insbesondere GT1a-Patienten mit der NS3-RAS Q80K hatten schlechter angesprochen. Diese Mutation, die häufiger in den USA vorkommt, vermindert die Empfindlichkeit auf Voxilaprevir in vitro interessanterweise nicht (Wyles S et a., THU-273).
Was kommt noch?
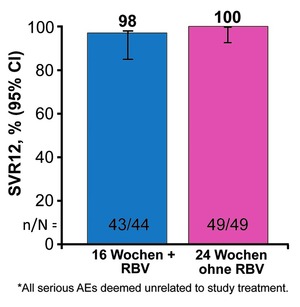
Abb. 4 C-SURGE: Wirksamkeit nach DAA- Versagen. SVR12-Raten. Wedemeyer H et al., EASL 2017.
Etwas abgeschlagen im Rennen ist die MSD-Kombination GRU, die aus dem bekannten Proteasehemmer Grazoprevir und dem neuen NS5A-Hemmer Ruzasvir und dem neuen NS5B-Hemmer Uprifosbuvir besteht. Die Fixkombination ist pangenotypisch und wird einmal täglich in zwei Tabletten gegeben. In C-SURGE erhielten 94 DAA-Versager entweder 16 Wochen GRU mit Ribavirin oder 24 Wochen GRU ohne Ribavirin. Beide Regime waren gleichermaßen erfolgreich, alle Patienten wurden geheilt. Baseline RAS einschließlich Y93 hatten keinen Einfluss (Abb. 4) (Wedemeyer H et al., PS-159).
Aus dem klinischen Alltag
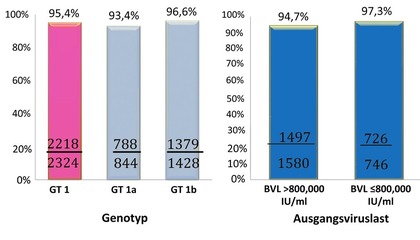
Abb. 5 VA-Kohorte. SVR nach Genotyp und Ausgangsviruslast. Kramer JR et al., EASL 2017
Erneut
gab es eine Fülle von Auswertungen zum Einsatz der DAA im klinischen
Alltag. Bei den schon länger zugelassenen Regimen sind die
Patientenzahlen größer geworden, an der
bekannten Wirksamkeit
hat sich nichts geändert. Erstmals gab es auch Daten aus dem Alltag
zu Elbasvir/Grazoprevir und Sofosbuvir/Velpatasvir.
Elbasvir/Grazoprevir bei GT 1 führte per protocol übereinstimmend
zu 97% SVR in TRIO und TARGET (Bacon B et al., THU-239; Pearlman BL
et al., THU-237). Die meisten Patienten wurden in der VA-Kohorte
behandelt. Von den knapp 2.300 Patienten erreichten 96% die SVR,
wobei der Unterschied zwischen GT 1a und GT 1b sowie über oder unter
800.000 IU/ml marginal war (Abb. 5). Zirrhotiker, HIV-Koinfizierte
und Patienten mit Nierenfunktionseinschränkungen in allen Stadien
sprachen gleichermaßen gut an. 36% hatten GT 1a, aber nur 7% wurden
zusätzlich mit Ribavirin behandelt. (Kramer JR et al., PS-095).
Bei Sofosbuvir/Velpatasvir waren die ausgewerteten Patientenzahlen relativ gering, die Ergebnisse vielversprechend. Die SVR-Raten in TARGET und TRIO lagen bei GT 1-6 kumuliert bei 94% bzw. 97% (Tsai N et al., SAT-244; Curry M et al., PS-102; Khalili M et al.; SAT-222). In einer kleinen deutsche Kohorte mit GT3 zeigte Sofosbuvir/Velpatasvir eine vergleichbar hohe Wirksamkeit wie Sofosbuvir/Daclatasvir (Vermehren J et al., PS-155).
HCC-Risiko durch DAA?
EASL – Wechsel in der Führungsebene
Auf der Generalversammlung der Europäischen Lebergesellschaft (EASL) wurden neue Vorstände gewählt. Der neue Generalsekretär ist der Norweger Prof. Tom Hemming Karlsenaus, Oslo und der Vize-Sekretär Prof. Frank Tacke aus Aachen.

Prof.
Tacke und Prof. Karlsenaus
https://ilc-congress.eu/wp-content/
Die Diskussion schwelt seit über einem Jahr: Erhöhen DAA das Risiko der Entstehung bzw. des Wiederauftretens von Leberkrebs? Die spanische Arbeitsgruppe aus Barcelona, die die Diskussion ausgelöst hat, hält an ihrer These fest. Auch in einer neuen Analyse ihrer Daten fanden sie nach rund einem Jahr bei über 30% ihrer HCV-Patienten nach Ende der DAA-Therapie ein HCC-Rezidiv, das zudem ungewöhnlich rasch fortschritt (Reig M et al., PS-031).
Zahlreiche andere Studien sprechen gegen ein erhöhtes HCC-Risiko. Großes Gewicht hatte hier eine Meta-Analyse von 41 Studien (n=13.875), die nach Adjustierung für Alter und Beobachtungszeit kein höheres HCC-Risiko als nach Interferon-Therapie ergab. Weitere Untersuchungen deuten ebenfalls darauf, dass das HCC bzw. HCC-Rezidiv eher mit den bekannten Risikofaktoren wie Alter, fortgeschrittene Zirrhose, usw. oder häufigeren Kontrollen zusammenhängt als mit der DAA-Therapie (Waziry R et al., PS-160; Audureau E et al.; PS-034; Ji D et al., PS-037).
Hepatitis B
Zur Hepatitis B gab es wie üblich Berichte zum Stand der Forschung auf dem Weg zur Heilung. Hier geht es langsam voran und ein Durchbruch ist derzeit noch nicht in Sicht. Das Update der Studie zum Switch von Tenofovir Diproxil (TDF) auf Tenofovir Alafenamid (TAF) hat die erwarteten Ergebnisse erbracht: die virologische Wirksamkeit von TAF ist auch nach 96 Wochen stabil und der Einfluss auf die Marker von Nierenfunktion und Knochenstoffwechsel geringer als bei TDF (Chan HL et al., PS-041; Brunetto M et al., PS-042; Agarwal K et al., FRI-153).
Überraschend war dagegen, dass beim Absetzen von Nukes die Dynamik des Rebounds bei TDF und Entecavir (ETV) unterschiedlich ist. Im Rahmen einer Studie zum Effekt einer therapeutischen Vakzine wurden TDF bzw. ETV abgesetzt. Die Patienten waren mindestens zwei Jahre erfolgreich mit den Polymerasehemmern behandelt worden. Bei TDF kam es deutlich schneller zum Rebound. Nach 12 Wochen war bei >70% der TDF-Patienten, aber nur bei <10% der ETV-Patienten die Viruslast >2000 IU/ml angestiegen (Wedemeyer H et al., LBP-518).
Neue Nukes
Und es gibt auch neue Nukleoside gegen Hepatitis B in der Entwicklung. Tenofovir Exalidex (TLX) ist ein neues Tenofovir-Prodrug, das sich speziell in der Leber anreichert (Tanwandee T et al., PS-040). Zu Besifovir wurde eine Phase-3-Studie vorgestellt. Das Nukleosid war genauso effektiv wie TDF und hatte weniger Einfluss auf Niere und Knochen. Ein Nachteil könnte die notwendige zusätzliche Gabe von L-Carnitin sein (Ahn SH et al., GS-017).
HBV-Reaktivierung durch SVR?
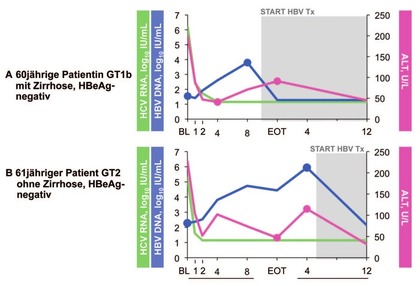
Abb. 6 HBV-Reaktivierung unter DAA-Therapie. Liu, EASL 2017
Vor etwa einem Jahr berichtete die amerikanische FDA über gravierende Folgen einer HBV-Reaktivierung im Rahmen einer DAA-Therapie der Hepatitis C. Nun hat eine taiwanesische Arbeitsgruppe 111 Patienten mit HCV/HBV-Koinfektion (HBsAg-positiv, HBeAg-negativ, keine Therapie) während und nach der DAA-Therapie beobachtet. Die SVR lag bei 100% und die HBV-DNA stieg bei 63% der Patienten an und zwar insbesondere bei Patienten mit bereits vor Therapiebeginn höherer Viruslast und Transaminasen. Klinische Komplikationen ergaben sich nicht, bei zwei Patienten wurde eine HBV-Therapie eingeleitet (Abb. 6) (Liu CJ et al., PS-098).
Neue Leitlinien
Die EASL hat die Empfehlungen zum Management der Hepatitis B aktualisiert. In den neuen Leitlinien gab es Neuerungen insbesondere zu:
- Definition des Krankheitsverlaufs
- Therapieindikationen einschließlich Prävention der MTCT
- Therapieindikation bei besonderen Patientengruppen
- Anleitung zur Response-gesteuerten Therapie mit Interferon
- Empfohlene orale Firstline-Medikamente
- Empfehlungen zum Therapiestopp
Krankheitsphasen
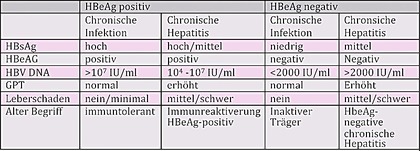
Tab. 1 Natürlicher Verlauf und Klassifikation der chronischen Hepatitis B. EASL 2017
Es wird unterschieden zwischen „chronischer Infektion“ und „chronischer Hepatitis“ bei HBeAg-positiven bzw. HBeAg-negativen Patienten. Die Phase 1 (früher „immuntolerante Phase“) ist die HBeAg-positive chronische Infektion mit hoher HBV-Viruslast und normaler GPT (<40 IU/ml). In der Phase 2 kommen als Zeichen der Inflammation erhöhte Transaminasen hinzu. In der Phase 3 (früher „inaktiver HBsAg-Träger“) ist es zur HBeAg-Serokonversion gekommen. Die Viruslast ist meist niedrig (<2.000 IU/ml), die Transaminasen nicht erhöht. Bei einigen Patienten steigt die Viruslast gelegentlich bis >20.000 IU/ml, die GPT bleibt jedoch im Normbereich. In der Phase 4 kommt es immer wieder zum Anstieg der HBV-Viruslast allerdings mit Entzündungszeichen der Leber. Die Phase 5 ist gekennzeichnet durch den Verlust von HBsAg mit oder ohne Anti-HBsAg, normale Leberwerte und eine (meist) nicht nachweisbare HBV-DNA.
Therapieindikationen
News
in Kürze
Hepatitis
E häufig
Am Universitätskrankenhaus Hamburg-Eppendorf wurden seit Oktober 2016 13.441 Blutspenden auf Hepatitis-E-Virus (HEV) untersucht. 15 Proben waren positiv. Ein Spender hatte eine akute Hepatitis E, die spontan ausheilte. 14 Spender hatten keinerlei Beschwerden. Einer der 14 gesunden Spender hatte schon drei Monate lang HEV im Blut und hatte auch schon früher Blut gespendet. Neun abwehrgeschwächte Patienten hatten solche Blutkonserven erhalten. Bei 8 Patienten hatte das keine Folgen, sie entwickelten keine Hepatitis E. Nur bei einem Patienten war HEV im Blut nachweisbar bevor er an einem akut-auf-chronischen Leberversagen starb (Westhölter D et al., PS-110).
Ledipasvir/Sofosbuvir bei Kindern
In Kürze wird man auch Kinder Interferon-frei behandeln können. Eine Studie mit 90 Kindern im Alter zwischen 6 und 11 Jahren, die mit der halben Dosis Ledipasvir/Sofosbuvir behandelt wurden, zeigte eine hohe SVR-Rate von 99% und eine sehr gute Verträglichkeit (Murray KF et al., GS-010). Eine Studie an Kindern im Alter zwischen 3 und 6 Jahre läuft noch.
SVR macht Transplantation überflüssig
Jeder vierte geheilte Patient konnte von der Warteliste genommen werden.
Von 142 Patienten mit Hepatitis C und dekompensierter Zirrhose (ohne HCC) konnte jeder vierte nach erfolgreicher DAA-Therapie von der Transplantationsliste genommen werden. Der mittlere MELD – bzw. CP-Score verbesserte sich von vor Therapie 14 bzw. 9 auf 9 bzw. 6. Die mittlere Beobachtungszeit seit DAA-Therapie betrug 28 Monate, seit Delisting 15 Monate. Nur ein Patient verschlechterte sich so, dass er wieder gelistet wurde (Belli L et al., PS-063).
Behandelt werden sollen Patienten:
- mit einer HBV-DNA >2.000 IU/ml und Zeichen der Leberentzündung oder Fibrose
- mit einer HBV-DNA >20.000 IU/ml und GPT >2x ULN
- mit Zirrhose und nachweisbarer HBV-DNA
- die im Gesundheitswesen arbeiten
- Schwangere
Behandelt werden können Patienten:
- mit HBeAg, hohen und normalen Transaminasen, wenn sie mehr als 30 Jahre alt sind
- mit HCC oder Leberzirrhose in der Familienanamnese
- mit extrahepatischen Manifestationen
Empfohlene Medikamente
Mittel
der Wahl sind Entecavir (ETV), Tenofovirdisoproxil (TDF) und Tenofovir
Alafenamid (TAF). Zu TAF liegen bei der Hepatitis B bisher nur
96-Wochen-Daten vor. In diesen Studien war die
virologische
Wirksamkeit von TDF und TAF vergleichbar. Unter TAF war es jedoch
häufiger zu einem Rückgang der GPT gekommen. Zudem waren die
Auswirkungen auf Nierenfunktion und Knochendichte geringer. Bei
älteren Patienten sowie Patienten mit eingeschränkter
Nierenfunktion oder Osteoporose bzw. entsprechenden Risikofaktoren
sollte man daher Entecavir oder TAF den Vorzug geben. Bei
Lamivudin-vorbehandelten Patienten sollte TAF priorisiert werden.
Therapiestopp
Nach HBsAg-Verlust mit oder ohne HBsAg-Serokonversion sollte das Medikament abgesetzt werden. Bei HBeAg-positiven Patienten mit stabiler HBeAg-Serokonversion und negativer HBV-DNA kann nach einer 12monatigen Konsolidierungsphase die Therapie beendet werden. Ein Therapiestopp kann auch erwogen werden bei HBeAg-negativen Patienten ohne Zirrhose, wenn die Viruslast mehr als 3 Jahre unter der Nachweisgrenze lag, sofern die Möglichkeit von engmaschigen Kontrollunter-suchungen besteht.