Nils Von Hentig, Frankfurt
Kardiovaskuläres Risiko bei HIV
Neuere Daten zur Pathogenese
Mehrere Studien der jüngsten Vergangenheit haben versucht, den Einfluss einer HIV-Serokonversion in späterem Lebensalter zu charakterisieren und das besondere kardiovaskuläre Risiko älterer HIV-infizierter Menschen zu ermitteln. Abgesehen von einem signifikant erhöhten Risiko von Multimorbidität bei langjährig HIV-Infizierten und in höherem Lebensalter neu Infizierten, fand man in beiden Gruppen eine jeweils um 5% höhere Prävalenz von kardiovaskulären Ereignissen als bei HIV-negativen Kontrollen. Ein Grund für diese Diskrepanz geht aus den Daten nicht hervor, anderer Lebensstil und HIV-Infektion könnten beide eine eigene Rolle spielen.
Inflammation
Zwei Studien der INSIGHT-Studiengruppe untersuchten den Zusammenhang zwischen Beginn einer cART und Parametern für Entzündung, Gerinnung und Vascular Injury sowie dem klinischen Risiko und stellten die Ergebnisse auf der CROI 2017 vor. In der START-Studie wurden insgesamt 4.684 erwachsene HIV-Patienten mit einer CD4-Zellzahl >500/µL entweder sofort (n=2.325) oder verzögert (n=2.359) behandelt. Untersucht wurde der Einfluss des Therapiebeginns auf verschiedene Biomarker für Entzündung und Gerinnung und das Auftreten von AIDS oder AIDS-bedingtem Tod, schwerwiegenden AIDS-assoziierten Erkrankungen oder nicht-AIDS-bedingten Tod. AIDS, AIDS-assoziierter Tod bzw. nicht-AIDS-assoziierter Tod, Tuberkulose oder kardiovaskuläre Events waren jeweils mit signifikanten Erhöhungen von D-Dimer, IL-6 bzw. einem D-Dimer/IL-6 Score assoziiert und zwar über alle CD4-Zellzahlen hinweg.
Proteasehemmer
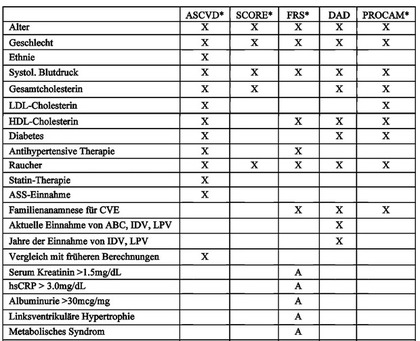
* 10-Jahres-Risiko für einen CVE; DAD: 5-Jahres-Risiko für einen CVE; FRS mit A=aggravating factors
American College for Cardiology: ASCVD Risk estimator Plus (http://tools.acc.org/ASCVD-Risk-Estimator-Plus/#!/calculate/estimate/)
European Society of Cardiology: SCORE European High Risk Chart https://www.escardio.org/static_file/Escardio/Subspecialty/EACPR/Documents/score-charts.pdf – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3819022/
Framingham Risk Score mit zusätzlichen Parametern:
https://www.mdcalc.com/framingham-coronary-heart-disease-risk-score
DAD Risiko Score:http://www.hivpv.org/Home/Tools/tabid/91/ctl/ExamView/mid/500/eid/0/lid/0/Default.aspx
PROCAM Risiko Score: http://www.scores.bnk.de/procam.html
Tab. 1 Übersicht über gängige Risiko-Scores für ein kardiovaskuläres Ereignis
Daten der D:A:D-Studiengruppe zeigen eine Assoziation von erhöhtem kardiovaskulären Risiko unter neueren Proteaseinhibitoren (2009 bis 2016). Nach Adjustierung für Risikofaktoren wie Alter, Geschlecht, Ethnie, Rauchen, Cholesterinerhöhung usw. ergab sich im Vergleich zur Allgemeinbevölkerung ein um 53% höheres relatives kardiovaskuläres Risiko bei einer Einnahme von Darunavir/Ritonavir über fünf Jahren (IRR 1,53%, (CI 1.28 to 1.84) und bei Einnahme von Atazanavir/Ritonavir um 1%, (ITT 1,01% CI 0.88 to 1.16). Frühere Studien postulierten einen möglichen protektiven Effekt des unkonjugierten Bilirubins durch antioxidative Eigenschaften. Eine Analyse der Daten von 96.373 Patienten zeigte allerdings eine inverse Korrelation von Bilirubin und kardiovaskulärem Risiko. Interessant war hierbei, dass die Mehrheit der Patienten mit erhöhten Bilirubinwerten kein Atazanavir eingenommen haben.
Fettstoffwechsel
Eine Störung des Fettstoffwechsels mit erhöhten Cholesterinwerten bzw. einer ungünstigen HDL/LDL-Ratio und hohem Apolipoprotein-A erhöht bekanntermaßen das kardiovaskuläre Risiko. Verschiedene Studien versuchten die Frage zu klären, ob Statine – außer den bekannten Effekten wie Cholesterinsenkung und Plaque-Stabilisierung – speziell bei HIV-Patienten noch andere Effekte haben. Drechsler und Kollegen konnten einen Zusammenhang zwischen regelmäßiger Statineinnahme und einer verminderten Rate virologischer Rebounds zeigen.25 In einer anderen Studie wurden die bereits bekannten Effekte von Rosuvastatin auf verschiedene Parameter des Fettstoffwechsels bei HIV-Patienten durch sehr niedrige Vitamin D3-Spiegel abgeschwächt (SATURN-HIV Studie).
Weiterhin gibt es einen Zusammenhang zwischen HDL-Cholesterin-Effluxkapazität und anderen Parametern der HDL-Funktion, Monozytenfunktion und KHK-Risiko. Dysfunktionales HDL begünstigte in vitro die Bildung von Monozyten-Schaumzellformation. Die Einleitung einer cART verbesserte die antioxidative HDL-Funktion, wobei niedrige CD4+ Zellzahlen und hohe HI-Viruslast mit einer verminderten HDL-Funktion und schlechtem Immunstatus korrelierten. HDL-Cholesterin-Efflux ist ebenfalls invers mit Monozytenzahlen korreliert. Das unterstützt die Theorie, dass eine Wiederherstellung der HDL-Funktion das Potenzial hat, die Monozytenfunktion zu modulieren und damit das kardiovaskuläre Risiko zu senken.
Gerinnung
Die Rolle von Thrombozyten bei chronisch entzündlichen Prozessen im Gefäß wird vermehrt wahrgenommen. In chronisch entzündeten Gefäßen sind an der Oberfläche von Thrombozyten Komponenten für die Degranulation von Entzündungsmediatoren wie CD62p oder sP-Selektin vermehrt exprimiert und aktiviert. CD62p interagiert, wenn aktiviert, mit verschiedenen Partnern, z.B. neutrophilen Granulozyten, Monzyten und seinen Liganden P-Selektin Glykoprotein Ligand-1 (PSGL-1). Dies führt zu einer vermehrten Bildung von Plättchen-Leukozyten-Aggregaten (PLA) und einer Hochregulation des MAC-1 Endothelzell-Liganden gemessen durch vermehrte Expression von CD11b/CD18), der wiederum Mediator einer verstärkten Interaktion der oben genannten Partner ist.
Ebenfalls werden Zusammenhänge zwischen thromboembolischen Komplikationen und einer erhöhten Aktivierung von prokoagulatorischen Faktoren, wie z.B. dem D-Dimer, beschrieben.
Gewebsfaktoren
Bei verstärkter Koagulation bewirkt zum einen die Adhäsion der Leukozyten an der beschädigten Gefäßwand die Freisetzung proteolytischer Enzyme und toxischer Substanzen, welche zusätzlich pro-aggregatorische Moleküle in der Gefäßwand offenlegen. Auf der anderen Seite tragen vermehrt Gewebsfaktoren aus dem subendothelialen Gewebe und Leukozyten zur verstärkten Gerinnung bei, indem sie die Thrombingeneration induzieren und somit zusätzlich von dieser Seite die Thrombozytenaktivierung und den thrombotischen Prozess im Gefäß verstärken. Die Gerinnung startet, wenn nur 5% des Fibrinogens konvertiert wurde. An dieser Stelle setzen Gerinnungstests wie Prothrombinzeit (PT) oder partielle Prothrombinzeit (PTT) an. Während diese Routinetests also die Zeit messen, bis ein Gerinnsel gebildet wird, können sie jedoch nicht eine erhöhte Koagulabilität messen bzw. sind nicht sensitive genug, eine kleine Blutungsdiathese zu erfassen. Modernere automatisierte Testverfahren sind jedoch heute in der Lage diese Tests schnell und zuverlässig durchzuführen, so z.B. mithilfe des Multiplate Analyzer.
Klinische Diagnostik
Die Vergangenheit hat gezeigt, dass alle Risiko-Scores das kardiovaskuläre Risiko von HIV-Patienten unterschätzen. Die Scores ASCVD, FRS, SCORE, PROCAM und auch der DAD-Score unterschätzen die jeweiligen Inzidenzen um 41-28%, so dass auch noch weitere Parameter als die klassischen Risikofaktoren eine Rolle zu spielen scheinen. Nichtsdestotrotz sind FRS- oder DAD-Scores in der Klinik hilfreich, um sich dem Problem zumindest so weit als möglich anzunähern.
Der FRS-Score scheint für Ältere besonders gut geeignet, da er auch eine Nierenschädigung berücksichtigt. Liegt ein Diabetes mellitus vor, so ist der neue DAD-Score vorzuziehen bzw. eine Kombination aus beiden genannten die Methode der Wahl in der Praxis. Ein interessante Option in diesem Zusammenhang ist die Kombination verschiedener Risiko-Scores speziell für HIV-Patienten: Hier werden FRS, DAD-Score, Eurosida-Score, die GFR und die NNH-Risikoberechnung für die Abacavir-Einnahme miteinander kombiniert. Eurosida ergänzt beispielsweise noch die HIV-Geschichte des Patienten, z.B. Infektionsdauer, CD4-Zellzahl, frühere AIDS-Diagnose, therapienaiv bzw. Therapiepause) (http://www.hivpv.org/Home/Tools/tabid/91/ctl/ExamView/mid/500/eid/0/lid/0/Default.aspx). Einschränkend muss allerdings gesagt werden, dass dieser Kombinationsscore nicht klinisch evaluiert ist.
Ausblick
Wie auch immer man die neuen Studienergebnisse betrachtet: Die größte Risikoreduktion für ein kardiovaskuläres Ereignis erreicht man durch konsequente Einstellung von Blutdruck, Blutzucker, Cholesterin und Nikotinabstinenz. Jeder dieser Faktoren ist allein für eine 40%ige Reduktion des Infarktrisikos verantwortlich. Die Einnahme von Statinen hat einen deutlich positiven Einfluss und die Effekte, die bei Rosuvastatin gesehen wurden, sind wahrscheinlich auch für andere Statine gegeben. Der Einsatz von kardiovaskulären Risiko-Scores ist zur Einschätzung der individuellen Situation eines Patienten sicher hilfreich.
1 Decrion AZ, Dichamp I, Varin A, Herbein G. HIV and inflammation. Curr HIV Res 2005,3:243-259.
2 Coll B, Parra S, Alonso-Villaverde C, Aragones G, Montero M, Camps J, et al. The role of immunity and inflammation in the progression of atherosclerosis in patients with HIV infection. Stroke 2007,38:2477-2484.
3 Appay V, Sauce D. Immune activation and inflammation in HIV-1 infection: causes and consequences. J Pathol 2008,214:231-241.
4 Melendez MM, McNurlan MA, Mynarcik DC, Khan S, Gelato MC. Endothelial adhesion molecules are associated with inflammation in subjects with HIV disease. Clin Infect Dis 2008,46:775-780.
5 Jong E, Meijers JC, van Gorp EC, Spek CA, Mulder JW. Markers of inflammation and coagulation indicate a prothrombotic state in HIV-infected patients with long-term use of antiretroviral therapy with or without abacavir. AIDS Res Ther 2010,7:9.
6 Lane HC. Pathogenesis of HIV infection: total CD4+ T-cell pool, immune activation, and inflammation. Top HIV Med 2010,18:2-6.
7 Tien PC, Choi AI, Zolopa AR, Benson C, Tracy R, Scherzer R, et al. Inflammation and mortality in HIV-infected adults: analysis of the FRAM study cohort. J Acquir Immune Defic Syndr 2010,55:316-322.
8 Eastburn A, Scherzer R, Zolopa AR, Benson C, Tracy R, Do T, et al. Association of low level viremia with inflammation and mortality in HIV-infected adults. PLoS One 2011,6:e26320.
9 Guzman-Fulgencio M, Medrano J, Rallon N, Echeverria-Urabayen A, Miguel Benito J, Restrepo C, et al. Soluble markers of inflammation are associated with Framingham scores in HIV-infected patients on suppressive antiretroviral therapy. J Infect 2011,63:382-390.
10 Mangili A, Polak JF, Quach LA, Gerrior J, Wanke CA. Markers of atherosclerosis and inflammation and mortality in patients with HIV infection. Atherosclerosis 2011,214:468-473.
11 Aberg JA. Aging, inflammation, and HIV infection. Top Antivir Med 2012,20:101-105.
12 Duprez DA, Neuhaus J, Kuller LH, Tracy R, Belloso W, De Wit S, et al. Inflammation, coagulation and cardiovascular disease in HIV-infected individuals. PLoS One 2012,7:e44454.
13 Langkilde A, Petersen J, Klausen HH, Henriksen JH, Eugen-Olsen J, Andersen O. Inflammation in HIV-infected patients: impact of HIV, lifestyle, body composition, and demography - a cross sectional cohort study. PLoS One 2012,7:e51698.
14 Stein JH, Hsue PY. Inflammation, immune activation, and CVD risk in individuals with HIV infection. JAMA 2012,308:405-406.
15 Subramanian S, Tawakol A, Burdo TH, Abbara S, Wei J, Vijayakumar J, et al. Arterial inflammation in patients with HIV. JAMA 2012,308:379-386.
16 Piconi S, Clerici M. HIV replication, inflammation and atherogenesis: dangerous liaisons. AIDS 2013,27:1521-1522.
17 Nou E, Lo J, Grinspoon SK. Inflammation, immune activation, and cardiovascular disease in HIV. AIDS 2016,30:1495-1509.
18 Baker J, Sharma S, Grund B, Group ISS. The Erffect of ART on Inflammation, Coagulation, and Vascular Injury in START. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, USA:Poster 608.
19 Baker J, Sharma S, Grund B, Group ISS. Association of Inflammation and Coagulation With Clinical Risk in the START Trial. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, USA:Poster 623.
20 Ryom L, Lunsgren J, el-Sadr W, Reiss P, Phillips A, Kirk O, et al. Associations Between Cardiovascular Disease And Contemporarily Used Protease Inhibitors. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, USA:OP 128LB.
21 Marconi V, So-Armah K, Tate J, Lim J, Lo Re V, Butt A, et al. HYPERBILIRUBINEMIA PREVENTS CARDIOVASCULAR DISEASE FOR HIV+ AND HIV- INDIVIDUALS. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
24 Brothers TD, Kirkland S, Theou O, Zona S, Malagoli A, Wallace LMK, et al. Predictors of transitions in frailty severity and mortality among people aging with HIV. PLoS One 2017,12:e0185352.
25 Drechsler H, Ayers C, Cutrell J, Maalouf N, Tebas P, Bedimo R. CURRENT STATIN USE REDUCES RISK OF VIRAL REBOUND ON SUPPRESSIVE CART. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
26 Funderburg NT, Jiang Y, Debanne SM, Labbato D, Juchnowski S, Ferrari B, et al. Rosuvastatin reduces vascular inflammation and T-cell and monocyte activation in HIV-infected subjects on antiretroviral therapy. J Acquir Immune Defic Syndr 2015,68:396-404.
27 Corrilynn O. Hileman1 VT, Abdus Sattar1, Grace A. McComsey1. VITAMIN D DEFICIENCY IMPAIRS THE BENEFICIAL EFFECTS OF STATIN IN TREATED HIV. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
28 Angelovich T, Hearps A, Shi M, Kelesidis T, Jaworowski A. DYSFUNCTIONAL HDL FROM HIV+ INDIVIDUALS PROMOTES FOAM-CELL FORMATION IN VITRO. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
29 Mannem S, Chow D, Playford M, Nakamoto B, Kallianpur K, Byron M, et al. HDL CHOLESTEROL EFFLUX CAPACITY IS INVERSELY RELATED TO CLASSICAL MONOCYTE NUMBER. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
30 O‘Halloran J, Kelesidis T, O‘Brien L, Herlihy T, Rainford L, Lambert J, et al. EFFECT OF ART INITIATION ON MONOCYTE AND HDL FUNCTION. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
31 Tort O, Pastor R, Garcia F, Martinez E, Plana M, Escribà T, et al. CHOLESTEROL EFFLUX RESPONDS TO THE IMMUNE STATUS IN PROGRESSION OF HIV INFECTION. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
32 Clement M, Lin L, Navar A, Okeke N, Naggie S, Douglas PS. LOWER RATES OF CVD PROCEDURES IN HIV-INFECTED PATIENTS WITH ACUTE CORONARY SYNDROME. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
33 Friis-Moller N, Weber R, Reiss P, Thiebaut R, Kirk O, d‘Arminio Monforte A, et al. Cardiovascular disease risk factors in HIV patients--association with antiretroviral therapy. Results from the DAD study. Aids 2003,17:1179-1193.
34 Friis-Moller N, Sabin C, Weber R, d‘Arminio Monforte A, El-Sadr W, Reiss P, et al. Combination antiretroviral therapy and the risk of myocardial infarction. N Engl J Med 2003,349:1993-2003.
35 Palmer CS, Cherry CL, Sada-Ovalle I, Singh A, Crowe SM. Glucose Metabolism in T Cells and Monocytes: New Perspectives in HIV Pathogenesis. EBioMedicine 2016,6:31-41.
36 Palmer CS, Henstridge DC, Yu D, Singh A, Balderson B, Duette G, et al. Emerging Role and Characterization of Immunometabolism: Relevance to HIV Pathogenesis, Serious Non-AIDS Events, and a Cure. J Immunol 2016,196:4437-4444.
37 Crane H, Nance R, Delaney J, Drozd D, Heckbert S, Young R, et al. Comparing Cardiovascular Disease Risk Scores for Use in HIV-Infected Individuals. Conference on Retroviruses and Opportunistic Infections 2016,Boston, U.S.A.
38 Ikeda H, Nakayama H, Oda T, Kuwano K, Yamaga A, Ueno T, et al. Neutrophil activation after percutaneous transluminal coronary angioplasty. Am Heart J 1994,128:1091-1098.
39 Ott I, Neumann FJ, Gawaz M, Schmitt M, Schomig A. Increased neutrophil-platelet adhesion in patients with unstable angina. Circulation 1996,94:1239-1246.
40 Guaraldi G, Rockwood K. Geriatric-HIV Medicine Is Born. Clin Infect Dis 2017,65:507-509.
41 Guaraldi G, Raggi P, Gomes A, Zona S, Marchi E, Santoro A, et al. Lung and Heart Diseases Are Better Predicted by Pack-Years than by Smoking Status or Duration of Smoking Cessation in HIV Patients. PLoS One 2015,10:e0143700.
42 Currier JS, Havlir DV. CROI 2017: Complications and Comorbidities of HIV Disease and Its Treatment. Top Antivir Med 2017,25:77-83.
43 van Zoest R, Smit M, Nichols B, Vaartjes I, Smit C, van der Valk M, et al. CARDIOVASCULAR PREVENTION POLICY IN HIV: RECOMMENDATIONS FROM A MODELING STUDY. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.
44 Althoff K, Horberg M, Eron J, Gange S, Crane H, Justice A, et al. THE LARGE GAP BETWEEN STATIN ELIGIBILITY AND PRESCRIPTION AMONG HIV+ IN NORTH AMERICA. Conference on Retroviruses and Opportunistic Infections 2017,Seattle, U.S.A.