SOUND-C2: Faldaprevir+BI207127 mit und ohne pegIHN/RBV
In der Phase-2b-Studie wurden 362 Patienten mit HCV GT1 behandelt.
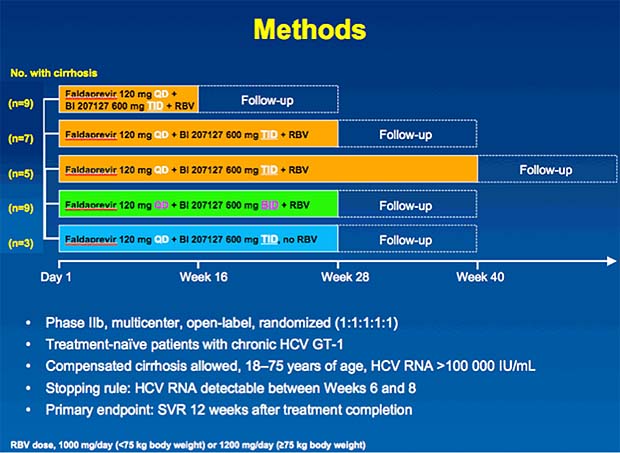
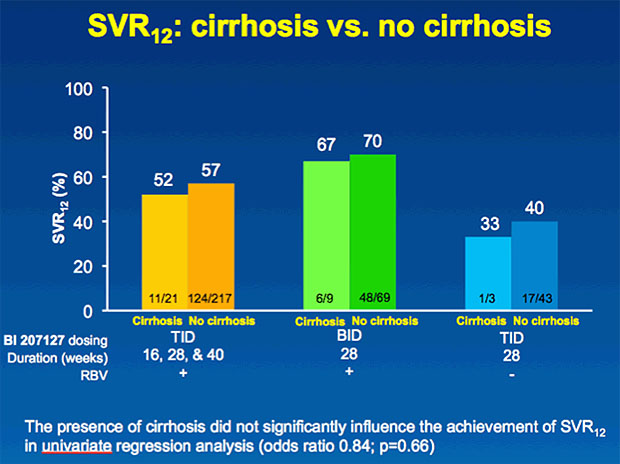
33 Patienten (9%) hatten eine Leberzirrhose. Die Leberveränderung hatte keinen relevanten Einfluss auf die SVR12.
Entscheidender war der Subtyp. Mit GT-1a erreichten 43-50% der Patienten eine SVR12 und mit GT-1b 57-80%.
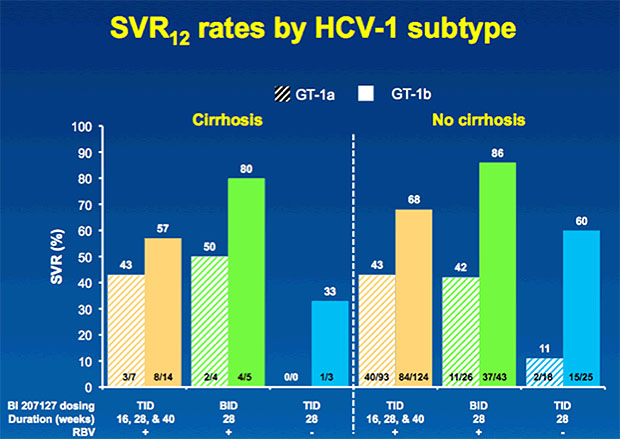
Die Verträglichkeit war bei gut und bei zweimal täglicher Gabe bei Patienten mit und ohne Zirrhose vergleichbar.
Zeuzem S, Soriano V, Asselah T, et al. Interferon (IFN)-free combination treatment with the HCV NS3/4A protease inhibitor BI 201335 and the non-nucleoside NS5B inhibitor BI 207127 ± ribavirin (R): final results of SOUND-C2 and predictors of response. Program and abstracts of the 63rd Annual Meeting of the American Association for the Study of Liver Diseases; November 9-13, 2012; Boston, Massachusetts. Abstract 232.
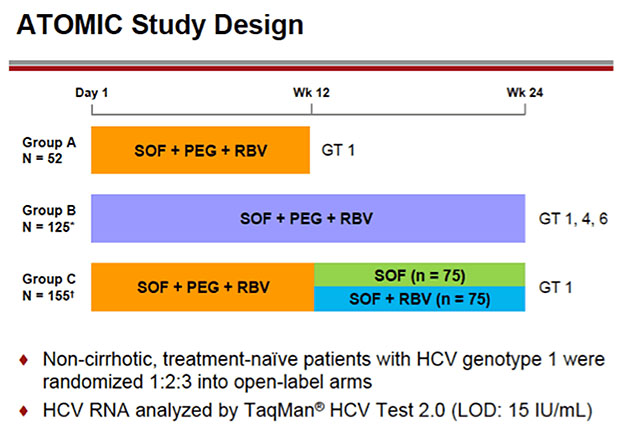
ATOMIC: Sofosbuvir + pegIFN/RBV
Die 12wöchige Tripletherapie mit Sofosbuvir führte bei über 90% der therapienaiven HCV-Patienten zu Heilung.
An der Studie nahmen rund 400 therapienaive Patienten ohne Zirrhose teil, alle wurden mit Sofosbuvir plus pegIFN/RBV
behandelt. Unterschiedlich war lediglich die Therapiedauer.
Die SVR-Rate lag bei über 90%, wobei auch Pateinten mit GT4 und 6 nach 24 Wochen Therapie eine SVR von 82% bzw. 100%
erreichten.
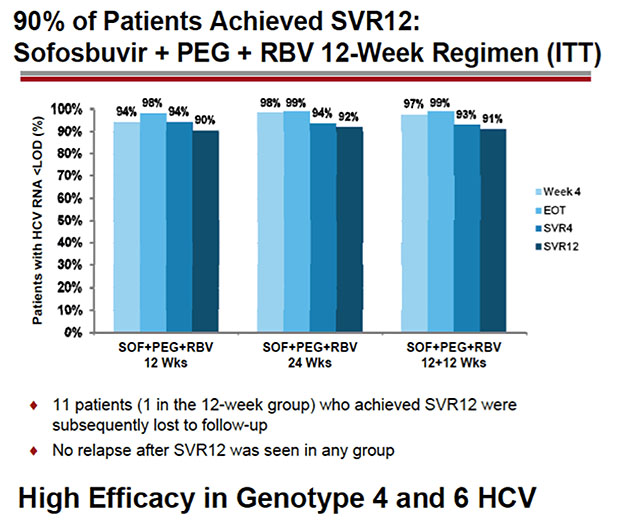
11 Patienten (3%) hatten einen Relaps. Primärmutationen (S282T) wurden nicht beobachtet und 10/11 Patienten waren phänotypisch weiterhin empfindlich auf Sofosbuvir.
Die Verträglichkeit von Sofosbuvir war sehr gut. Es dominierten die unerwünschten Wirkungen von Interferon und Ribavirin.
Abbildungen www.natap.org