PROF. DR. ANDREAS SAUERBREI, JENA
Diagnostik und Therapie von Varicella-Zoster-Virus-Infektionen
Varizellen und Zoster können bei immungeschwächten Patienten einen schweren Krankheitsverlauf zeigen. Gefürchtet sind vor allem Komplikationen unter der Beteiligung viszeraler Organe. Im Falle einer Labordiagnostik ist der Virusnachweis anzustreben. Ein Antikörpernachweis ist zum Erkennen von empfänglichen Personen sowie zur Kontrolle des Impferfolges bei bestimmten Personengruppen indiziert. Zur antiviralen Behandlung von Risikopatienten mit Varizellen sind Aciclovir sowie zur Therapie des Zoster Aciclovir, Brivudin, Famciclovir und Valaciclovir zugelassen. Während die parenterale Aciclovir-Therapie bei immunsupprimierten Patienten zu bevorzugen ist, eignet sich die orale Gabe von Brivudin, Famciclovir oder Valaciclovir gut zur Behandlung des Zoster einschließlich der Reduktion des zosterassoziierten Schmerzes. Mit der seit Juli 2004 empfohlenen allgemeinen Varizellenimpfung besteht die Möglichkeit, über 80% aller Varizellenfälle und deren Komplikationen zu verhindern. Zur Verfügung stehen sowohl monovalente Varizellenimpfstoffe als auch Vierfachimpfstoffe in Kombination mit den Impfstoffen gegen Masern-Mumps-Röteln. Da es sich um eine Impfung mit Lebendimpfstoff handelt, ist die Impfung bei symptomatischer HIV-Infektion kontraindiziert. Für immungesunde Personen ab dem 60. Lebensjahr wurde zur Vorbeugung des Zoster eine Zostervakzine zugelassen, die sich von den Varizellenimpfstoffen durch eine wesentlich höhere Konzentration des Impfvirus unterscheidet.
Abb.1: Elektronenmikroskopische Aufnahme eines kompletten VZV-Partikels (nach Fenner)
Das Varicella-Zoster-Virus (VZV) ist ein hochkontagiöses Virus, das nach Primärinfektion die Varizellen auslöst (Abb. 1). Diese Erkrankung stellt in Ländern mit gemäßigtem Klima die häufigste impfpräventable Virusinfektion im Kindesalter dar. Bis zur Einführung der allgemeinen Varizellenimpfung im Jahr 2004 traten in Deutschland jährlich circa 750.000 Erkrankungen auf. Unabhängig vom Zeitpunkt der Erstinfektion verbleibt das VZV in Neuronen der hinteren Wurzeln der Spinal- und Hirnnervenganglien. Eine Reaktivierung dieser Viren kann zu einem Zoster führen, von dem vor allem ältere Menschen und Personen mit gestörter Immunabwehr betroffen sind. Mit circa 350.000 Erkrankungen pro Jahr gehört der Zoster zu den häufigsten Virusinfektionen der Haut. Aufgrund der steigenden Lebenserwartung und der zunehmenden Zahl an immunsupprimierten Patienten muss mit einer Zunahme der Fallzahlen gerechnet werden.
VARIZELLEN ALS PRIMÄRINFEKTION
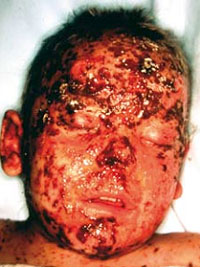
Abb. 2: Schwere hämorrhagische Varizellen bei einem 7-jährigen Patienten mit angeborenem
T-Zell-Defekt
Infektionsquelle sind akut an Varizellen erkrankte oder infizierte Personen am Ende der Inkubationszeit, wobei das Virus über Speichel, Konjunktivalflüssigkeit oder die Bläschenflüssigkeit der Hauteffloreszenzen übertragen werden kann. Bei Kontakt mit einem Zoster besteht ein deutlich niedrigeres Infektionsrisiko, da nur die Bläschenflüssigkeit infektiöses Virus enthält. Die klinischen Erscheinungsformen der Varizellen sind vielfältig. Sie reichen von relativ harmlosen Windpocken im Kindesalter bis zu schwersten Krankheitsverläufen bei immungeschwächten Patienten aller Altersstufen. Das typische klinische Erscheinungsbild besteht in einem schubweise auftretenden, am Kopf beginnenden Exanthem, das sich aus kleinen roten Flecken über Papeln, wasserklaren Bläschen, gelblichen Pusteln bis zu Krusten weiterentwickelt und bei unkompliziertem Verlauf narbenlos abheilt. Während der behaarte Kopf und v.a. die Schleimhäute der Mundhöhle befallen sind, bleiben Handteller und Fußsohlen fast immer frei. Die Ansteckungsfähigkeit endet in der Regel 5 Tage nach Beginn des Exanthems. Bis zum Abfallen der Krusten vergehen ungefähr 2 Wochen. Bei bis zu 5% der Erkrankten kommt es zu Komplikationen, die mit dem Alter zunehmen. Dazu gehören vor allem bakterielle Superinfektionen der Haut, Mittelohrentzündung bei Kindern, Bronchitis, Pneumonie und Erkrankungen des Zentralen Nervensystems (ZNS). Eine besondere Gefährdung stellen Varizellen für Patienten dar, bei denen die zellulären Immunfunktionen geschwächt sind (Abb. 2). Gefürchtet sind vor allem viszerale Komplikationen, wie Hepatitis, Pneumonitis, Pankreatitis und Enzephalitis. Während der Schwangerschaft sind Windpocken ein besonderes Risiko für Mutter und Kind. Infolge einer Erkrankung kann es bei der Schwangeren zur lebensbedrohlichen Pneumonie kommen, während eine intrauterine Virusübertragung zum fetalen Varizellensyndrom oder zu schwer verlaufenden Windpocken des Neugeborenen in den ersten Lebenstagen führen kann9.
Hochrechnungen ergaben für Deutschland vor Einführung der Impfung jährlich etwa 40.000 Varizellenkomplikationen, was nahezu 5,5% aller Erkrankungen entspricht, und 22 Todesfälle durch Windpocken1. Etwa 5.500 Erkrankungen machten eine stationäre Behandlung erforderlich. Nach Erhebungen der Kassenärztlichen Vereinigungen in Hamburg, Mecklenburg-Vorpommern, Niedersachsen und Thüringen von 2003/04 bewegte sich die Anzahl der in der ambulanten Praxis beobachteten Varizellenkomplikationen zwischen 2,2 und 5,6%13.
Als neue Erscheinungsform der Windpocken sind die Durchbruchsvarizellen anzusehen, die durch das Wildvirus verursacht werden und frühestens 43 Tage nach Impfung gegen Varizellen auftreten. Ihre Häufigkeit wird mit 1-4% der jährlich Geimpften angegeben. Die Erkrankung verläuft deutlich milder als die natürliche Infektion und auch die Kontagiosität wird wesentlich geringer eingeschätzt. Es treten meist weniger als 50 Effloreszenzen auf, und in etwa der Hälfte der Fälle bleibt das Exanthem makulopapulös. Fieber und die sonst üblichen Varizellenkomplikationen werden äußerst selten beobachtet.
ZOSTER NACH ENDOGENER VIRUSREAKTIVIERUNG
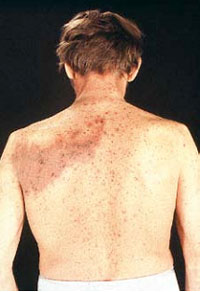
Abb. 3: Zoster mit kutaner Disseminierung bei einem immunsupprimierten Patienten
Beim Zoster handelt es sich stets um eine Erkrankung nach endogener Reaktivierung des VZV. Meist geht eine 2-5 Tage andauernde Prodromalphase mit milden uncharakteristischen Allgemeinsymptomen voraus. Typisch sind brennende Schmerzen und/oder Sensibilitätsstörungen im Bereich von einem bis drei benachbarten Dermatomen. In seltenen Fällen bleiben Schmerzen das einzige Symptom (Zoster sine herpete). Im Unterschied zu Erwachsenen sind bei Kindern die Allgemeinsymptome meist stärker ausgeprägt, während intensive Schmerzen häufig fehlen. In dem betroffenen Areal zeigt sich zunächst ein Erythem, gefolgt von charakteristisch gruppiert stehenden Papeln, aus denen sich Bläschen entwickeln. Die Bläschenbildung hält 1-5 Tage an. Danach trocknen diese über 7-12 Tage aus, so dass der Zoster bei immungesunden Patienten nach 2-4 Wochen abgeheilt ist. Bei abwehrgeschwächten Patienten kann die Erkrankung chronisch mit monatelang bestehenden Hautläsionen und wiederholt auftretenden Bläschen verlaufen. Der Zoster ist vorwiegend thorakal lokalisiert. Mit zunehmendem Alter werden häufiger Innervationsgebiete des Nervus trigeminus befallen.
Bei immungeschwächten Patienten verläuft der Zoster im Allgemeinen schwerer, und es treten häufiger Komplikationen auf (Abb. 3). Zu den wichtigsten Komplikationen des Zosters gehören: neurologische Manifestationen, hämorrhagische und nekrotische Hautveränderungen, bakterielle Superinfektionen, Disseminierung der Infektion (Zoster generalisatus) und Mitbeteiligung des Auges oder des Ohres bei Zoster ophthalmicus bzw. oticus. Schmerzen, die länger als 4 Wochen fortbestehen und nach einem schmerzfreien Intervall erneut auftreten, werden als postzosterische Neuralgie (PZN) bezeichnet. Risikofaktoren für eine PZN sind hohes Lebensalter, dermatomgebundener Schmerz in der Prodromalphase, weibliches Geschlecht, mehr als 50 Effloreszenzen im befallenen Dermatom, hämorrhagische Effloreszenzen und der Befall kranialer oder sakraler Dermatome. Zoster in der Schwangerschaft schadet dem ungeborenen Kind nicht.
LABORDIAGNOSTIK
Als mögliche Pathomechanismen der PZN werden die Entwicklung einer peripheren Sensibilisierung von nozizeptiven C-Fasern, gefolgt von einer zentralen Sensibilisierung spinaler nozizeptiver Neurone, sowie die Degeneration von nozizeptiven C-Fasern im Rahmen der Entzündung diskutiert. Aus beiden Hypothesen kann geschlussfolgert werden, dass bei Ausbleiben der auslösenden Reize im Rahmen einer effizienten Analgesie die Voraussetzungen zur Entwicklung des "Schmerzgedächtnisses" entfallen und somit die PZN verhindert werden kann.
| Differenzialdiagnostik von Varizellen und Zoster | Atypische Krankheitsbilder bei Immundefizienz Bläschenbildende Dermatosen anderer Ursache ZNS-Infektionen durch VZV VZV-Pneumonie |
| Diagnostik während der Schwangerschaft | Fragliche Immunität nach VZV-Kontakt Intrauterine Infektion (pränatale Diagnostik) Fetales Varizellensyndrom Neonatale Varizellen |
| Diagnostik im Zusammenhang mit Varizellenimpfung | Unterscheidung von Wild- und Impfviren bei Varizellen nach Impfung Erkennung von empfänglichen Personen Kontrolle des Impferfolgs bei immundefizienten Impflingen und Beschäftigten im Gesundheitsdienst |
Tab. 1: Indikationen für eine Labordiagnostik von Varizellen und Zoster
| Allgemeine Indikation | Seronegative Frauen mit Kinderwunsch |
|---|---|
| Medizinische Indikation |
1. Seronegative Patienten:
2. Empfängliche3Patienten mit schwerer Neurodermitis 3. Empfängliche3 Personen mit Kontakt zu 1. und 2. |
| Berufliche Indikation |
1. Seronegatives Personal im Gesundheitsdienst, insbesondere in Pädiatrie, Onkologie, Gynäkologie/ Geburtshilfe, Betreuung von Immundefizienten 2. Seronegatives Personal bei Neueinstellungen in Gemeinschaftseinrichtungen für das Vorschulalter |
|
1. Impfung nicht unter intensiver immunsuppressiver Therapie durchführen (z.B. in der Anfangsphase der Behandlung). 2. Voraussetzung ist: (a) Abschluss der immunsuppressiven Therapie und vollständige klinische Remission =12 Monate; (b) vollständige hämatologische Remission (Gesamtlymphozytenzahl =1.200/mm3 Blut). 3. Empfänglichkeit bedeutet: keine Varizellenanamnese, keine Impfung und seronegativ |
|
Tab. 3: Indikationen zur Varizellenimpfung
Die Diagnose von Varizellen und Zoster basiert grundsätzlich auf dem typischen Verlauf und dem charakteristischen klinischen Erscheinungsbild. Die Indikationen für labordiagnostische Untersuchungen sind in Tab. 1 zusammengefasst.
Zur Abklärung fraglicher Erkrankungen an Varizellen bzw. Zoster ist der Virusnachweis mittels Polymerasekettenreaktion zu führen, da serologische Parameter keine Frühdiagnostik erlauben7. Als Untersuchungsmaterial eignen sich der Inhalt von Hautbläschen, Liquor, bronchoalveoläre Lavage, EDTA-Blut oder Gewebe. Eine Virusanzüchtung aus frischen Hautbläschen sollte versucht werden, wenn es um spezielle Fragestellungen wie der Genotypisierung des VZV zur Unterscheidung von Wild- und Impfviren8 und der Resistenzbestimmung gegenüber Virostatika geht. Der Transport des Untersuchungsmaterials ins Labor sollte gekühlt in einem Virustransportmedium erfolgen. Eine serologische Diagnostik zur Bestätigung von Varizellen oder Zoster ist nur dann zu empfehlen, wenn keine Möglichkeit des Virusnachweises besteht. In diesem Fall sollten 2 Serumproben im Abstand von 7-10 Tagen eingesandt werden, wobei die erste Probe so früh wie möglich entnommen werden kann. Varizellen gehen mit einer Serokonversion des Anti-VZV-IgG sowie mit der Bildung von Anti-VZV-IgM und Anti-VZV-IgA einher. Die serologische Absicherung eines Zoster erfolgt gewöhnlich über die Bildung von Anti-VZV-IgA, den signifikanten Anstieg von VZV-IgG und den Nachweis von VZV-IgM, der jedoch nur bei maximal 50-60% der Patienten positiv ausfällt7.
Für die Klärung des spezifischen Immunstatus wird die Bestimmung der Anti-VZV-IgG-Antikörper eingesetzt. Im Allgemeinen korreliert das virusspezifische IgG mit der zellulären Immunität, die zwar hinsichtlich des Schutzes vor VZV-Infektionen dominiert, aber methodisch schwierig zu bestimmen ist. Zur Antikörperbestimmung sind Immunfluoreszenzteste und Enzymlinked Immunosorbent Assays (ELISA) gebräuchlich. Unabhängig vom verwendeten Test kann jedes von einem Labor als VZV-IgG positiv interpretierte Untersuchungsergebnis als Kriterium für eine Immunität gewertet werden. Personen mit grenzwertigen Befunden sollten als "nicht immun" eingestuft werden. Die handelsüblichen Teste unterscheiden sich bezüglich der Sensitivität, so dass sehr niedrige Antikörpertiter teilweise nicht erfasst werden. Zur Kontrolle des Impferfolgs und für Impfstudien werden deshalb hochempfindliche Teste wie der Fluoreszenz-Antikörper-Membran-Antigen-Test (FAMA)14 und ein spezieller Glykoprotein (gp)-ELISA11 eingesetzt, die kommerziell nicht verfügbar sind.
ANTIVIRALE CHEMOTHERAPIE
Zur antiviralen Behandlung von Risikopatienten mit Varizellen ist Aciclovir (i.v., p.o.) sowie zur Therapie des Zoster sind Aciclovir (i.v., p.o.), Brivudin (p.o.), Famciclovir (p.o.) und Valaciclovir (p.o.) zugelassen (Tab. 2). Bei einem Therapiebeginn innerhalb von 72 Stunden nach Auftreten der Hauterscheinungen sind diese Virostatika hinsichtlich einer schnelleren Abheilung der Zostereffloreszenzen nahezu gleichwertig. Klinische Studien weisen in Bezug auf die Reduzierung des zosterassoziierten Schmerzes (akuter Zosterschmerz und PZN) jedoch eine signifikant bessere Wirksamkeit von Brivudin, Famciclovir und Valaciclovir im Vergleich zur oralen Gabe von Aciclovir auf12. Die parenterale Aciclovir-Therapie ist Standard bei immunsupprimierten Patienten. Behandelt werden sollten immundefiziente Personen mit Zoster oder Varizellen, Patienten mit Zoster ab dem 50. Lebensjahr, Zoster im Kopf-Halsbereich, schwerem Zoster an Stamm und Extremitäten, Patienten mit schwerer Dermatitis atopica und ausgedehnten Hautkrankheiten sowie Kinder und Jugendliche, die Kortikosteroide als Dauertherapie benötigen. Eine antivirale Therapie ist auch bei Schwangeren (Aciclovir) mit schweren Varizellen, Neugeborenen mit neonatalen (konnatalen) Varizellen und bei VZV-Enzephalitis indiziert. Der Therapieerfolg wird im Allgemeinen anhand klinischer Parameter beurteilt. Bleibt der Erfolg aus, ist die Diagnose zu überprüfen. Bei Immunsupprimierten kann versucht werden, ein Virusisolat zur Resistenzbestimmung zu gewinnen.
Prof. Dr. Andreas Sauerbrei
Institut für Virologie und Antivirale Therapie
Friedrich-Schiller-Universität Jena
Hans-Knöll-Straße 2 · D-07745 Jena
Email: Andreas.Sauerbrei@med.uni-jena.de
Literatur
1. Banz K, Wagenpfeil S, Neiss A, Hammerschmidt T, Wutzler P. The burden of varicella in Germany. Potential risks and economic impact. Eur J Health Econ 2004;5:46-53
2. Oxman MN, Levin MJ, Johnson GR, Schmader KE, Straus SE, Gelb LD et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005;352:2271-84
3. Robert Koch-Institut. Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut (Stand: Juli 2004). Epidemiol Bull 2004;30:235-50
4. Robert Koch-Institut. Neuerungen in den aktuellen Impfempfehlungen der STIKO. Epidemiol Bull 2005;31:273-6
5. Robert Koch-Institut. Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut (Stand: Juli 2006). Epidemiol Bull 2006;30:235-50
6. Robert Koch-Institut. Neuerungen in den aktuellen Impfempfehlungen der Ständigen Impfkommission (STIKO) am RKI vom Juli 2006. Epidemiol Bull 2006;32:271-6
7. Sauerbrei A, Eichhorn U, Schacke M, Wutzler P. Laboratory diagnosis of herpes zoster. J Clin Virol 1999;14:31-6
8. Sauerbrei A, Uebe B, Wutzler P. Molecular diagnosis of zoster post varicella vaccination. J Clin Virol 2003;27:190-9
9. Sauerbrei A, Wutzler P. Varicella-Zoster-Virus-Infektionen: Aktuelle Prophylaxe und Therapie. 2. Auflage. Uni-Med, Bremen London Boston 2007
10. Shinefield H, Black S, Digilio L, Reisinger K, Blatter M, Gress JO, Brown ML, Eves KA, Klopfer SO, Schodel F, Kuter BJ. Evaluation of a quadrivalent measles, mumps, rubella and varicella vaccine in healthy children. Pediatr Infect Dis J 2005;24:665-9
11. Wasmuth EH, Miller W. Sensitive enzyme-linked immunosorbent assay for antibody to varicella-zoster virus using purified VZV glycoprotein antigen. J. Med. Virol. 1990;32:189-93
12. Wutzler P, Gross G, Doerr HW. Antivirale Therapie des Zoster. Dt Ärztebl 1997;94:B-1129-33
13. Wutzler P, Hülsse C. Varizellenimpfung - Standardimpfung seit Juli 2004. Pädiat Prax 2006;68:369-77
14. Zaia JA, Oxman MN. Antibody to varicella-zoster virus-induced membrane antigen: immunofluorescence assay using monodisperse glutaraldehyde-fixed target cells. J Infect Dis 1977;156:519-30
15. Zepp F. Erste Erfahrungen mit einem Kombinationsimpfstoff gegen Masern, Mumps, Röteln und Varizellen. Kinderärztekongress Bremen 2005; Abstract K14.04V











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
