7. Europäischer HIV Resistenzworkshop in Stockholm
 Resistenzupdate auf Europäischer Ebene: Testsysteme im
Fokus
Resistenzupdate auf Europäischer Ebene: Testsysteme im
Fokus
Der 7. Europäische HIV Resistenzworkshop fand dieses Jahr vom 25.-27. März in Stockholm statt. Mit insgesamt 136 Beiträgen übertraf die Veranstaltung ihre Vorgänger, ließ dafür jedoch an manchen Stellen auch die Qualität vermissen. Im Mittelpunkt standen weniger neue Mutationen oder neue Medikamente, sondern eher die Frage nach dem Einsatz der ultrasensitiven Sequenzierung („Ultra-Deep Sequencing“) und der Interpretation der Ergebnisse sowie die Frage nach dem Stellenwert des genotypischen Tropismus-Tests.
Die Europäische Zulassung für Maraviroc ist auf den ersten Blick eindeutig. Der Test zur Bestimmung des viralen Tropismus muss eine „… ausreichend validierte und empfindliche Testmethode…“ sein (http://www.emea.europa.eu/humandocs/PDFs/EPAR/celsentri/H-811-PI-de.pdf). Der phänotypische Trofile-Test von Monogram ist in seiner ersten Version in den MOTIVATE-Studien durchaus validiert worden. Mit der zweiten Generation, dem Trofile Enhanced Sensitivity, wurde die MERIT-Studie retrospektiv analysiert, eine pro-spektive Validierung gibt es nicht.
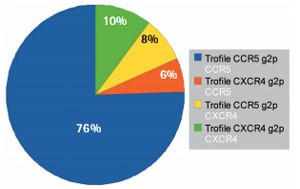
Abb. 1: Übereinstimmung der phänotypischen mit der genotypischen Tropismustestung in der Berliner Maraviroc-Kohorte (Abstract 79, mit freundlicher Genehmigung von M. Obermeier)
Genotypischer Tropismus-test ausreichend?
Der genotypische Tropismus-Test, der in diversen Beiträgen mit dem Trofile-Test als „Gold-Standard“ verglichen wurde, zeigte eine sehr gute Korrelation mit den phänotypischen Resultaten, unabhängig davon, ob der genotypische Test mit RNA aus Plasma oder proviraler DNA aus Zellen durchgeführt wurde; ebenso gut korrelierten die Vergleichsdaten des genotypischen Tests aus RNA und proviraler DNA (Abstracts 49-51, 80, 81, 93).
Einen wichtigen Beitrag zur Validierung des genotypischen
Tropismus-Tests lieferte dabei die Berliner Maraviroc Kohorte. Es konnte
gezeigt werden, dass in ihrem klinischen Kollektiv kein signifikanter
Unterschied hinsichtlich der Vorhersage des klinischen Ansprechens zwischen
genotypischem Tropismus-Test und Trofile-Test bestand (Abstract 79). Trotz
dieser zahlreichen Daten konnte man sich nicht auf eine Europäische Empfehlung
zu Gunsten des genotypischen Tropismus-Tests einigen (Abstract 104). Da sind
die Deutschen Virologen weiter. Die aktuellen Empfehlungen zum Tropismus-Test
finden Sie auf der Webseite des Nationalen Referenz-Zentrums unter www.viro.med.uni-erlangen.de/nrz/recommendations_tropismus_090409.pdf (PDF  )
)
„Ultra-Deep Sequencing“
Schon lange ist bekannt, dass mit der „klassischen“ Sequenzanalyse Varianten mit einem Anteil unter 20% nicht mehr reproduzierbar detektiert werden können. Verschiedene alternative Methoden haben eine höhere Sensitivität. Diese konnten sich bisher jedoch nicht für die routinemäßige genotypische Resistenzbestimmung durchsetzen. Auch das „Ultra-Deep Sequencing“, welches in der Lage ist, einen Genabschnitt über ca. 400 Basen zu sequenzieren und dabei minoritäre Varianten auch deutlich unter 1% zu detektieren, ist aktuell nicht für den Routine-Einsatz geeignet, könnte aber nach Meinung einiger Experten in drei bis fünf Jahren die Methode der Wahl für die genotypische Resistenzanalyse bzw. den genotypischen Tropismus-Test sein. In mehreren Arbeiten lagen Virusvarianten, die nach einem virologischen Versagen mittels „klassischer“ Genotypisierung detektierbar waren, schon vor Therapiebeginn als Minoritäten vor, waren jedoch nur mit Hilfe von „Ultra-Deep Sequencing“ nachweisbar (Abstracts 83, 88).
Auch bei der genotypischen Tropismustestung mittels „Ultra-Deep Sequencing“ fanden sich vielfach minoritäre CXCR4-trope Varianten (Abstract 84). Zusätzlich scheint es im Bereich der dual/mixed-tropen Viren Varianten zu geben, die auf eine Maraviroc-Therapie ansprechen dürften (Abstract 77). Diese Varianten waren jeweils mittels „klassischer“ Analyse nicht detektierbar.
Eine eher wissenschaftlich interessante Arbeit demonstrierte mit Hilfe von „Ultra-Deep Sequencing“ sehr elegant, wie sich die Verhältnisse der verschiedenen Quasispezies zueinander unter dem Selektionsdruck einer antiretroviralen Therapie verändern, welche Varianten nach einem Therapieversagen dominant waren und welche Varianten in der Therapiepause wieder die dominante Spezies darstellten (Abstract 56). Diese Daten sind insbesondere zum Verständnis der Virusdynamik interessant und wichtig.
Allel-spezifische
PCR
Dass es nicht immer „Ultra-Deep Sequencing“ sein muss, zeigen zwei Arbeiten aus Deutschland und England, die die Prävalenz von minoritären Varianten mittels allel-spezifischer PCR untersucht haben. Mit Hilfe dieser Technik kann man eine vergleichbare Sensitivität zum „Ultra-Deep Sequencing“ erzielen, beschränkt sich aber auf einzelne Mutationen. Beide Arbeiten konnten zeigen, dass minoritäre Varianten mit NNRTI-Resistenz assoziierten Mutationen vor Beginn einer Therapie mit NNRTIs häufig mit einem Therapieversagen korreliert waren (Abstracts 71, 113). Es stellt sich jedoch die Frage, ab welchem Anteil eine Minorität auch eine klinische Relevanz hat. Diese Frage konnte keine der aufgeführten Studien beantworten. Die klinische Relevanz wird sicherlich nicht nur vom Anteil der Minorität an der Gesamtpopulation abhängen, sondern auch von der Aktivität der anderen Substanzen im Therapieregime.
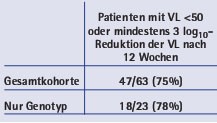
Tab. 1: Klinisches Ansprechen einer Maraviroc-haltigen antiretroviralen Therapie (Woche 12) in Abhängigkeit des zugrunde liegenden Tropismustests (Abstract 79)
Neue Targets – neue Resistenzen
Eine nicht ganz neue Diskussion hat auch in Stockholm trotz zahlreicher Beiträge keine neuen Erkenntnisse gebracht: Liefert die Analyse weiterer Regionen im HIV-Genom zusätzliche relevante Informationen, die die Interpretation der Resistenz basierend auf den „klassischen“ Regionen verändern? Fakt ist, dass bei virologischem Therapieversagen trotz nachweisbarer Einnahme der Medikamente zu einem je nach Therapieregime nicht unerheblichen Prozentsatz nur eine medikamenten-sensitive Virusvariante detektierbar ist. Eine Erklärung dafür wären Mutationen in anderen Genregionen. Die gag-Spaltstellen – die Positionen, an denen die virale Protease die Vorläuferproteine in aktive Bausteine spaltet – sind eine solche Region. Die Abstracts 2, 57, 59 und 109 hinterließen insgesamt jedoch den Eindruck, dass Mutationen in den Spaltstellen wohl eher kompensatorischen Charakter haben, d.h. den negativen Effekt von Mutationen in der Protease auf die virale Fitness ausgleichen.
Neue Bereiche analysieren?
Eine Arbeit (Abstract 62) versuchte, einen Zusammenhang von Mutationen in der C-terminalen Region der Reversen Transkriptase mit einer NNRTI-Therapie zu korrelieren. Die Autoren postulierten ein möglicherweise geringeres Ansprechen einer Etravirin-Therapie nach virologischem Versagen mit Nevirapin oder Efavirenz als mittels Analyse des bisher verwendeten RT-Bereichs. Eine zweite Arbeit (Abstract 70) konnte keinen eindeutigen Zusammenhang zwischen Mutationen in der RNase-H Region der RT und Thymidinanalog-assoziierten Mutationen feststellen. Die Schlussfolgerung dieser Studie steht aktuell stellvertretend für alle in diesem Abschnitt genannten Arbeiten: Es ist aktuell nicht nötig, routinemäßig andere Bereiche des HIV-Genoms zu analysieren, allerdings sollten die bisherigen Daten in größeren Kollektiven weiter untersucht werden.
In diesem Sinne: An die Arbeit!!!