 Robert Koch-Institut
Robert Koch-Institut
Späte HIV-Diagnose und später Behandlungsbeginn in Deutschland
Als im Jahr 1996 die HIV-Kombinationstherapie möglich und zugleich zum Behandlungsstandard wurde, bestand zunächst die Hoffnung, durch eine Behandlungsstrategie des ‚hit hard and early‘ eine HIV-Infektion ausheilen zu können. Dies führte dazu, dass die Empfehlungen für einen Therapiebeginn anfangs sehr breit gefasst wurden: So wurde den meisten Infizierten nach bestätigter HIV-Diagnose eine Therapie empfohlen. In den darauf folgenden Jahren musste die Hoffnung auf eine vollständige Viruseradikation durch antiretrovirale Therapie jedoch aufgegeben werden. Bei einem erheblichen Teil der Therapierten zeigten sich unerwartete Nebenwirkungen der Langzeittherapie, vor allem Fettgewebsverteilungsstörungen, die unter dem Begriff „Lipodystrophie“ bekannt wurden. Gleichzeitig erwies sich aber die virologische Wirksamkeit der Kombinationstherapie bei guter Adhärenz der Patienten als beeindruckend.
Es kam daher im Zeitraum 1999/2000 zu einer Veränderung der Therapiestrategie, indem der Therapiebeginn nach hinten verlegt wurde. Um Therapienebenwirkungen zu vermeiden und nicht vorzeitig Behandlungsoptionen – durch eine für viele Patienten hohe Ansprüche an die Therapieadhärenz stellende Behandlung – zu verlieren, wurde ein Grenzwert von T-Helferzellen festgelegt, bei dessen Erreichen erst mit der Therapie begonnen werden sollte. Dieser Grenzwert lag zunächst bei 250-200 CD4-Zellen/µl.
In der Folgezeit wurde die antiretrovirale Kombinationstherapie durch Einführung weiterer Medikamente, Neuformulierungen bereits eingesetzter Substanzen und neue Kombinationsstrategien zunehmend wirksamer, nebenwirkungsärmer und patientenfreundlicher im Sinne geringerer Anforderungen an eine exakte Befolgung von Dosierungsintervallen und Diätvorschriften. Wesentliche Probleme, die mit der Einführung der Kombinationstherapie einhergingen, wie Langzeitnebenwirkungen und zu hohe Anforderungen an die Therapieadhärenz wurden dadurch entscheidend vermindert. Ein bleibendes Relikt dieser Zeit ist ein schlechtes „Image“ der Kombinationstherapie bei vielen Patienten.
350 CD4-Zellen/µl Grenzwert für Therapie
Die klinische Testung von Alternativoptionen zur ‚hit hard and early‘ Therapiestrategie, vor allem die Versuche mit intermittierender, z.B. CD4-Zellzahl-gesteuerter Therapie, führten in den letzten Jahren zu überraschenden Ergebnissen. Unterbrechungen der einmal begonnenen Therapie wirkten sich klinisch nachteiliger für die Patienten aus als eine Dauertherapie. Nicht nur die bekannten HIV-assoziierten Krankheitskomplikationen traten bei Patienten mit Therapieunterbrechungen häufiger auf als bei Patienten unter kontinuierlicher Therapie, sondern auch andere klinische Komplikationen, die man bis dahin teilweise als Nebenwirkungen der Medikamente interpretiert hatte. Zugleich hat die Vereinfachung und Optimierung der Therapie zur Folge, dass Therapieversagen auf Grund von schlechter Adhärenz und Resistenzentwicklung unter kontinuierlicher Therapie nicht häufiger war als unter intermittierender. Auf Grund dieser Erkenntnisse schwingt das Pendel der Therapiestrategie wieder in Richtung eines frühen Behandlungsbeginns. Gegenwärtig wird als Grenzwert für den Therapiebeginn in ressourcenreichen Ländern allgemein ein Wert von 350 CD4-Zellen empfohlen. In Studien wird geprüft, ob angesichts besserer Verträglichkeit, patientenfreundlicherer Einnahmeregeln und hoher Langzeitwirksamkeit der aktuell verfügbaren Therapien eine weitere Anhebung auf 500 CD4-Zellen/µl sinnvoll wäre.
Angesichts der erwiesenen höheren klinischen Wirksamkeit eines Behandlungsbeginns bei einem CD4-Grenzwert von 350 und der offenen Diskussion, ob ein noch früherer Therapiebeginn sinnvoll wäre, stellt sich die Frage, wie viel Chancen auf Verbesserung der Lebensqualität und Verlängerung der Lebensdauer von HIV-Infizierten dadurch vergeben werden, dass die Diagnose einer HIV-Infektion zu spät erfolgt, d.h. erst bei CD4-Zellzahlen deutlich unter 350. Ein weiteres, derzeit schwer quantifizierbares Problem liegt darin, dass Patienten, deren HIV-Infektion bereits diagnostiziert ist, ein Therapiebeginn zu spät nahegelegt wird oder dass Patienten aus Angst vor Nebenwirkungen der Therapie, psychischen oder sozialen Konsequenzen eines Therapiebeginns die Entscheidung zur Aufnahme einer Therapie zu lange hinauszögern.
Im Folgenden soll versucht werden, auf der Grundlage von Auswertungen des HIV-Melderegisters, ergänzender epidemiologischer Studien zur Bestimmung des Infektionszeitpunktes bei frisch HIV-diagnostizierten Personen, von klinischen Kohortenstudien mit HIV-infizierten Patienten und von Ergebnissen aus Studien zur Verhaltenssurveillance zu beschreiben, wann derzeit in Deutschland HIV-Infektionen diagnostiziert werden und wann mit einer Therapie begonnen wird.
Klinischer und immunologischer Status zum Zeitpunkt der HIV-Diagnose
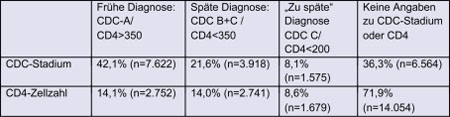
Tab.1: Verteilung der in Deutschland seit dem Jahr 2001 gemeldeten gesicherten HIV-Erstdiagnosen nach CDC-Stadium und CD4-Zellzahl zum Zeitpunkt der Diagnose (Datenstand 30.06.2009)
Im Rahmen der Routine-HIV-Surveillance werden bei Meldung einer HIV-Diagnose Angaben zum klinischen Status, dem sog. CDC-Stadium (Stadium A=asymptomatische HIV-Infektion, Stadium B=HIV-assoziierte Symptome und Erkrankungen, aber keine AIDS-definierenden Erkrankungen, Stadium C=AIDS-definierende Erkrankungen) und zur Anzahl der CD4-Zellen im Blut erfragt. Die Angaben hierzu erfolgen unvollständig (Tab. 1): Bei den seit dem Jahr 2001 gemeldeten gesicherten HIV-Erstdiagnosen fehlen Angaben zum klinischen Status bei etwas mehr als einem Drittel (36%) der Meldungen, Angaben zur CD4-Zellzahl fehlen sogar bei 72%. Der hohe Anteil fehlender Angaben ergibt sich wahrscheinlich daraus, dass eine Bestimmung der CD4-Zellzahl nach der HIV-Diagnose oft erst nach Überweisung an eine spezialisierte Einrichtung vorgenommen wird. HIV-Diagnose und CD4-Zellzahlbestimmung erfolgen also zu unterschiedlichen Zeitpunkten und durch unterschiedliche Ärzte. Ggf. erhobene ergänzende Angaben auf Folgemeldungen des HIV-Therapeuten können bisher aus datentechnischen Gründen nicht ausgewertet werden. Bei einem hohen Anteil fehlender Angaben stellt sich die Frage, ob die verfügbaren Daten repräsentativ für die Grundgesamtheit sind oder ob sich diejenigen mit Angaben in wichtigen Charakteristika von denjenigen unterscheiden, bei denen keine Angaben vorliegen. Bezüglich der klinischen Stadieneinteilung in CDC A, B oder C stellt sich die Frage, wie vertraut die den Meldebogen ausfüllenden Personen mit dieser Stadieneinteilung sind. Der teilweise geringe zeitliche Abstand zu einem berichteten negativen Vortest auf HIV bei Neudiagnosen mit Stadiumangabe CDC B oder C lässt an die Möglichkeit denken, dass Patienten, bei denen eine HIV-Diagnose im Rahmen einer primären HIV-Infektion erfolgt, fälschlich als bereits im Stadium B oder C befindlich klassifiziert werden. Bei Meldungen, bei denen sowohl eine Stadiumangabe als auch eine Angabe zum letzten negativen HIV-Testergebnis vorliegt, betrifft dies immerhin ca. ein Drittel der Meldungen. Dasselbe gilt auch für die CD4-Zellgrenze von 350 Zellen/µl: Diese kann auch vorübergehend im Rahmen einer HIV-Primärinfektion unterschritten werden. Dies bedeutet, dass für beide Parameter – Stadieneinteilung und CD4-Zellzahl – der Anteil später Diagnosen bei Analyse von Daten des HIV-Melderegisters überschätzt wird.
Wenn man diese Einschränkungen der Aussagekraft der Angaben außer Acht lässt und annimmt, dass Meldungen, bei denen die Angaben fehlen, sich gleich oder ähnlich verteilen wie Meldungen mit Angaben, würde dies bedeuten, dass unter dem Aspekt des nach heutigen Erkenntnissen optimalen Behandlungsbeginns (vor Auftreten HIV-assoziierter Krankheitssymptome, bei Erreichen eines CD4-Wertes von 350 Zellen/µl) je nach Maßstab 30-50% der HIV-Infizierten zu spät diagnostiziert werden.
Drogengebraucher werden früh diagnostiziert

Tab. 2: Anteil von späten Diagnosen (CDC-Stadium B/C zum Zeitpunkt der Diagnose) in den verschiedenen Betroffenengruppen und Zeittrends 2001-2009
Entgegen der Erwartung, dass die Verbesserung der Behandlungsmöglichkeiten automatisch zu einer deutlich höheren Testbereitschaft und zu einer früheren Diagnose von HIV-Infektionen führen, lässt sich zumindest in den Jahren seit 2001 keine wesentliche Veränderung des Diagnosezeitpunktes bzw. des Anteils der Infizierten feststellen, bei denen erst spät mit einer Behandlung begonnen wird: Der Anteil der im CDC-Stadium B oder C diagnostizierten HIV-Infizierten bleibt in den meisten Betroffenengruppen über die Zeit relativ stabil (Tab. 2), er steigt sogar in zwei Gruppen – bei Drogengebrauchern und Migranten aus Hochprävalenzländern – eher an. Die Zunahme des Anteils später Diagnosen in diesen beiden Gruppen muss jedoch nicht unbedingt als negative Entwicklung interpretiert werden. Sie kann – bei sinkender Absolutzahl von Neudiagnosen – auch einen Hinweis auf einen Rückgang der Neuinfektions-Inzidenz (bzw. des Zuzugs bei Immigranten) darstellen.
Bezüglich des Anteils später Diagnosen werden deutliche Unterschiede zwischen den verschiedenen Betroffenengruppen erkennbar: Drogengebraucher werden am raschesten diagnostiziert, gefolgt von MSM. Menschen, die sich über heterosexuelle Kontakte infiziert haben und die aus Hochprävalenzregionen stammen werden etwa gleich häufig erst im symptomatischen Stadium der HIV-Erkrankung diagnostiziert. Am spätesten erfolgt die Diagnose bei denjenigen, bei denen offenbar die Kommunikation zwischen Patient und Arzt am schwierigsten ist, bei denjenigen Patienten, bei denen auch keine Angaben zum Übertragungsrisiko erhoben werden (konnten) (Tab. 2 und 3).
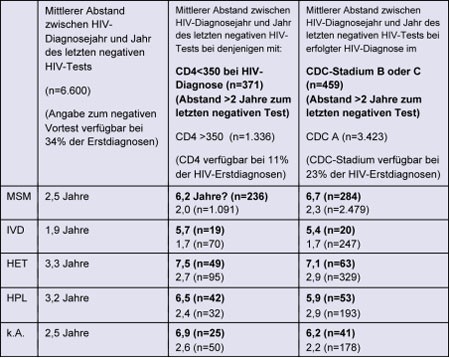
Tab. 3: Mittlerer Abstand zwischen HIV-Diagnosejahr und Jahr des letzten negativen HIV-Tests bei HIV-Erstdiagnosen zwischen 2001 und Mitte 2009 mit entsprechender Angabe (nach Ausschluss von Meldungen, bei denen ein Stadium B oder C innerhalb von zwei Jahren nach einem negativen HIV-Test berichtet wird)
Für die vergleichsweise frühe Diagnose bei Drogengebrauchern spielen wahrscheinlich häufige Arztkontakte eine entscheidende Rolle, z.T. auch im Rahmen von Eingangsuntersuchungen in Justizvollzugsanstalten.
Dass die Kommunikationsfähigkeit über Übertragungsrisiken zwischen Patient und Arzt eine wichtige Rolle für die rechtzeitige Diagnose spielt, legt der hohe Anteil später Diagnosen bei den Patienten nahe, bei denen diese Kommunikation offenbar nicht gelingt.
Ein nennenswerter Einfluss der Ortsgröße auf den Anteil später Diagnosen lässt sich in keiner Betroffenengruppe erkennen – mit Ausnahme der Gruppe ohne bekanntes Transmissionsrisiko: Er steigt hier von ca. 48% in den größten Städten auf 55% in ländlichen Regionen.
Eine späte Diagnose bei Personen mit Angabe eines negativen Vortestes (ca. 34% der Erstdiagnosen) korreliert mit längeren Testintervallen (2 bis 3-mal so lange wie bei Diagnose im CDC-Stadium A). Im Mittel liegt ein negativer Vortest bei Neudiagnostizierten im Stadium B oder C etwa 6 Jahre zurück (Tab. 3). Der Anteil später Diagnosen nimmt mit steigendem Lebensalter zu: Bei unter 30-jährigen beträgt er etwa 20% und steigt relativ kontinuierlich auf 60% bei den über 60-jährigen. Dies stimmt gut überein mit der Beobachtung längerer Testintervalle mit zunehmendem Alter.
Anteil der HIV-Infektionen, die innerhalb des ersten halben Jahres diagnostiziert werden
Über die bundesweite
HIV-Inzidenzstudie des RKI stehen in Deutschland erstmals für das Jahr 2008
Angaben zur Verfügung, wie hoch die Anteile kurz zurückliegender Infektionen
(innerhalb der letzten 6 Monate) bei HIV-Neudiagnosen in verschiedenen
Betroffenengruppen sind. Insgesamt werden ca. ein Drittel der Infektionen
innerhalb des ersten halben Jahres nach Infektion erkannt. Der Anteil liegt mit
ca. 37% bei
MSM und i.v.-Drogenkonsumenten etwa gleich hoch, bei heterosexuell Infizierten
mit 30% etwas niedriger, und am niedrigsten bei Menschen aus Hochprävalenzländern
mit 15%. Das bedeutet, dass insgesamt etwa ein Drittel der HIV-Infektionen sehr
früh, ein Drittel ‚zu spät‘ und ein Drittel in der Zeit dazwischen
diagnostiziert werden, wobei die unterschiedliche mittlere Testfrequenz und der
Anteil der überhaupt Getesteten im Wesentlichen die gruppenspezifischen
Unterschiede im Anteil der spät
diagnostizierten Personen bestimmen.
Später Behandlungsbeginn bei bekannter HIV-Diagnose
Neben einer späten Diagnose spielt für einen späten Behandlungsbeginn auch das Hinauszögern des Therapiebeginns bei bereits diagnostizierten Infizierten eine Rolle. Der Umfang dieses Problems ist derzeit in Deutschland schwer einzuschätzen, weil in den beiden größeren Kohortenstudien (Kompetenznetz-Kohorte, ClinSurv-Kohorte des RKI) die Verlässlichkeit von Angaben zur Testvorgeschichte bei neu in die Kohorten aufgenommenen Patienten nicht überprüft ist. Zwar wird in der Regel das Datum des ersten Testes bei dem behandelnden Zentrum dokumentiert, ob der Patient bereits vorher andernorts getestet worden war, bleibt aber häufig unbekannt.
Eine Analyse dieses Aspektes des verzögerten Behandlungsbeginns bei bekannter HIV-Diagnose auf Grundlage von Daten des HIV-Kompetenznetzes ergab, dass diese Problematik verstärkt bei i.v.-Drogenkonsumenten, bei Menschen mit Alkoholproblemen und bei arbeitslos gewordenen HIV-Infizierten auftritt. In dieser Analyse, die allerdings auf relativ kleinen Fallzahlen beruht, war verzögerter Therapiebeginn für etwa ein Drittel, später Diagnosezeitpunkt für etwa zwei Drittel des zu späten Therapiebeginns verantwortlich.
Die Hauptursache für einen späten Behandlungsbeginn liegt daher wahrscheinlich in der späten Diagnosestellung der HIV-Infektion.
Es bleibt abzuwarten, ob die in den letzten zwei Jahren erfolgte Heraufsetzung des CD4-Grenzwertes für den Behandlungsbeginn (350 Zellen/µl) dazu führen wird, dass der Anteil der spät mit einer Therapie beginnenden Patienten sinkt: Wenn es sich bei dem späten Behandlungsbeginn in größerem Umfang um ein Problem der rechtzeitigen Überweisung in spezialisierte Behandlungseinrichtungen handelte, sollte der Anteil eigentlich sinken. Sollte es primär ein Problem der späten Diagnose sein, würde sich dagegen wenig ändern.
Was tun, um HIV-Infektionen früher zu diagnostizieren?
Am 22. Oktober 2009 trafen sich ca. 40 Expertinnen und Experten auf Einladung des Vorsitzenden des Gemeinsamen Wissenschaftlichen Beirates des BMG, Herrn Prof. Schmidt und dem Vorsitzenden der Deutschen AIDS-Gesellschaft, Herrn Prof. Rockstroh zu einem Fachaustausch in Hannover. Die Teilnehmerinnen und Teilnehmer kamen aus den Bereichen Medizin, Public Health und Ethik/Recht und repräsentierten Kliniken, Schwerpunktambulanzen, AIDS-Hilfen, Betroffenenorganisationen, wissenschaftliche Institute, die Länder sowie internationale Organisationen (UNAIDS, WHO, ECDC, Europäische Kommission).
Ausgangssituation
Die Prävalenz von HIV-Infektionen ist in Deutschland relativ niedrig: nach Schätzung des Robert Koch-Instituts liegt die HIV-Prävalenz in der erwachsenen Allgemeinbevölkerung (15-60 Jahre, ~51 Mio. Menschen) bei 0,12%. Je nach Definition („späte“ Diagnose: T-Helferzellzahl zum Zeitpunkt der Diagnose <350 Zellen/µl; „fortgeschrittene HIV-Erkrankung“: T-Helferzellzahl zum Zeitpunkt der Diagnose <200 Zellen/µl) werden derzeit ca. die Hälfte bzw. ein Drittel der HIV-Infektionen spät bzw. zu spät diagnostiziert, oder die Betroffenen gelangen aus anderen Gründen erst in einem fortgeschrittenen Stadium der HIV-Infektion in eine qualifizierte medizinische Betreuung. Die Prävalenz „unentdeckter“ HIV-Infektionen liegt demnach in der Allgemeinbevölkerung in einer Größenordnung von ca. 0,06%.
In den letzten Jahren wurden HIV-Testangebote im Rahmen der Schwangerschaftsvorsorgeuntersuchungen und durch zielgruppenspezifische Kampagnen für MSM ausgebaut und verbessert. Die epidemiologischen Daten und Erkenntnisse in Deutschland weisen darauf hin, dass i.v. Drogenkonsumenten, die in anderen Ländern teilweise einen schlechten Zugang zum medizinischen Versorgungssystem haben, in Deutschland gut erreicht werden und relativ häufig auf HIV getestet werden, so dass HIV-Infektionen in dieser Gruppe vergleichsweise früh diagnostiziert werden.
Dagegen erfolgt die HIV-Diagnose bei einem überdurchschnittlich hohen Anteil von Migranten aus Hochprävalenzregionen und bei Menschen mit heterosexuellem Transmissionsrisiko spät. In absoluten Zahlen jedoch bleiben Männer mit gleichgeschlechtlichen Sexualkontakten auch bei den „Spätdiagnosen“ die zahlenmäßig größte Gruppe.
Die bisherige Testpraxis in Deutschland beruht überwiegend auf klienten-initiierter HIV-Testung (client initiated counselling and testing: CICT), die in der Regel in Gesundheitsämtern, AIDS-Hilfen und Arztpraxen nach einer individuellen Beratung durchgeführt wird. Diese Testangebote werden auch zielgruppenadaptiert im Rahmen von Aktionswochen und Kampagnen beworben. Durch Ärzte empfohlene Tests (provider-initiated testing) finden statt im Rahmen der Schwangerschaftsvorsorgeuntersuchungen, in Therapie- und Substitutionseinrichtungen für i. v. Drogenkonsumenten/innen und in der klinischen Versorgung zur Differentialdiagnostik. Im Rahmen der Schwangerschaftsvorsorge wurde sie durch entsprechende Änderung der Richtlinien ausgebaut. Darüber hinaus empfehlen medizinische Fachgesellschaften die HIV Testung bei Vorliegen einer Tuberkulose, einer weiteren sexuell übertragbaren Infektion oder einer chronischen Hepatitis B oder C. Derzeit existieren in Deutschland jedoch außer den STI-Beratungsstellen der Gesundheitsämter nur wenige Einrichtungen, die sich auf die Diagnose und Behandlung von sexuell übertragbaren Infektionen und die Beratung Betroffener spezialisiert haben. Zur Reichweite des provider-initiated testing insgesamt liegen keine Daten vor. In welchem Ausmaß außerhalb dieser Indikationen in klinischen Einrichtungen getestet wird, ist nicht bekannt.
Bisher bieten Ärzte selbst bei Vorliegen von Erkrankungen, die auf eine HIV-Infektion hinweisen (HIV-Indikatorerkrankungen, z.B. Herpes zoster bei jungen Patienten) noch zu selten einen HIV-Test an; die in Deutschland bereits bestehenden Leitlinien und Empfehlungen für eine ärztlich initiierte Testung werden daher nur unzureichend umgesetzt.
Ein HIV-Test ist ein medizinischer Eingriff und darf in Deutschland nur nach vorheriger Aufklärung durch den behandelnden Arzt und nach erfolgter Einwilligung durch den Patienten durchgeführt werden. Lediglich im Rahmen von strafrechtlichen Ermittlungen dürfen Blutuntersuchungen auch ohne das Einverständnis des Betroffenen durchgeführt werden. Entsprechend wären Screening-Untersuchungen auf HIV, die ohne bewusste Einwilligung des Patienten durchgeführt werden (z.B. Einverständniserklärung im Kleingedruckten eines Behandlungsvertrags ohne expliziten Hinweis auf die Möglichkeit, diese Passage zu streichen), mit dem derzeit geltenden deutschen Recht nicht vereinbar. Der Testende muss den Getesteten über das Ergebnis des Testes aufklären. Bei einem positiven Testergebnis insbesondere auch über die mögliche Infektiösität.
Unter den Experten bestand Konsens darüber, dass
- die gegenwärtige Situation, in der geschätzt ein Drittel der HIV-Neudiagnosen erst in einem fortgeschrittenen Stadium der HIV-Infektion erfolgen, nicht befriedigend ist
- fortgesetzte Anstrengungen erforderlich sind, um die Testrate und -frequenz bei Menschen mit erhöhten Risiken für eine HIV-Infektion zu erhöhen.
Empfehlungen
- Ein allgemeines HIV-Screening in medizinischen Einrichtungen in Deutschland ist angesichts der vergleichsweise niedrigen HIV-Prävalenz in der Gesamtbevölkerung weder sinnvoll noch wünschenswert.
- Eine gezielte Vermehrung von Angeboten zur freiwilligen Testung auf HIV verknüpft mit einer qualifizierten
Beratung ist erwünscht und notwendig. Die Durchführung der HIV-Testung ist dabei kein eigenständiges Ziel sondern Teil
einer HIV/AIDS Gesamtstrategie, die auch präventive, gesundheitsfördernde und kurative Maßnahmen einschließt.
- Angeboten werden sollten Testmöglichkeiten wie bisher durch den Öffentlichen Gesundheitsdienst, Nicht-Regierungs-Organisationen und das medizinische Versorgungssystem. Anonyme und kostenlose Testangebote können die Akzeptanz eines Testangebots erhöhen.
- Zielgruppenspezifische Testermutigung und möglichst niedrigschwellige Testangebote sollten gestärkt und weiter ausgebaut werden. Die ‚Testwochen’ im Rahmen der Kampagne ‚Ich weiß was ich tu’ der Deutschen AIDS-Hilfe, bei denen in Institutionen-übergreifender Zusammenarbeit Beratung und HIV-Ak-Tests in geeigneten Settings für besonders betroffene Gruppen angeboten werden, weisen in die richtige Richtung.
- Die Testermutigung für Migranten/innen aus Hochprävalenzregionen muss in einen breiteren Kontext gesundheitsfördernder Maßnahmen für diese Personengruppe eingebettet werden. Insbesondere muss sichergestellt sein, dass alle Personen, bei denen eine HIV-Infektion diagnostiziert wird, einen ausreichenden Zugang zum medizinischen Versorgungssystem in Deutschland erhalten – auch Personen ohne gesicherten Aufenthaltsstatus und Krankenversicherungsschutz sowie Inhaftierte. Dies erfordert unter anderem eine engere Zusammenarbeit zwischen dem medizinischen Versorgungssystem, dem öffentlichen Gesundheitsdienst und Nichtregierungsorganisationen.
- HIV-Testung muss grundsätzlich freiwillig und mit informiertem Einverständnis der Getesteten erfolgen. Die Testung muss begleitet sein von einer den konkreten Umständen angepassten Beratung vor dem Test und einer ausführlichen Beratung zum Testergebnis nach dem Test, oder, falls dies nicht möglich ist, von der Weiterverweisung an eine andere Einrichtung, wo eine solche qualifizierte Beratung erfolgen kann. Zur Testberatung gehört auch, die Notwendigkeit wiederholter Testung bei Fortbestehen von Infektionsrisiken anzusprechen. Etwa die Hälfte der neu mit HIV diagnostizierten Personen in Deutschland hat sich vor der HIV-Diagnose bereits mindestens einmal mit negativem Ergebnis auf HIV testen lassen.
- Möglichkeiten ärztlich initiierter Testung sollten stärker als bisher genutzt werden. Dies erfordert folgende
Maßnahmen und Strukturen:
- Anlässlich der Untersuchung auf andere sexuell übertragbare Erkrankungen sollte die Frage eines HIV-Testes regelmäßiger als bisher üblich angesprochen werden.
- Niedrigschwellige STI-Test- und Beratungsangebote sollten ausgebaut werden und ihr Angebot sollte sich vor allem an besonders betroffene Gruppen und Gruppen richten, für die Zugangsbarrieren zum regulären Versorgungssystem bestehen
- Das Wissen nicht-HIV-spezialisierter Ärzte/innen über HIV-Indikatorerkrankungen muss verbessert werden.
- Die Fähigkeit zur Kommunikation mit Patienten/innen über HIV-Risikofaktoren und die Kompetenz der Ärzte/innen zur Testberatung und Testmitteilung muss gestärkt werden.
- Die Deutsche AIDS-Gesellschaft (DAIG) wird gebeten, im Kontakt mit anderen Fachgesellschaften und Organen der ärztlichen Selbstverwaltung entsprechende Fortbildungsmaßnahmen für Ärzte/innen zu implementieren.
- Diskriminierung und soziale Ausgrenzung von HIV-Infizierten wirken sich demotivierend auf die
HIV-Testbereitschaft von gefährdeten Personen und Personengruppen aus. Zwar ist beim Abbau von Diskriminierung
HIV-Infizierter in Deutschland schon viel erreicht worden, weitere Anstrengungen sind aber notwendig. Sowohl innerhalb
betroffener Bevölkerungsgruppen als auch im medizinischen Versorgungssystem, beim Kontakt mit Behörden, am Arbeitsplatz
und im sozialen Umfeld erfahren auch heute noch in Deutschland viele HIV-Infizierte bei der Offenlegung ihrer Infektion
Diskriminierung und Ausgrenzung. Weitere und kontinuierliche Anstrengungen zum Abbau der Diskriminierung von Betroffenen
sind daher notwendig.
Es besteht ein Recht auf Nichtwissen. Eine Entscheidung gegen die Durchführung eines angeratenen HIV-Testes ist zu akzeptieren und darf nicht zu Benachteiligungen führen. - Es besteht die Notwendigkeit, die Weiterentwicklung von HIV-Testangeboten in Deutschland wissenschaftlich zu evaluieren und zu begleiten und somit ihre Qualität zu sichern. Dazu müssen auch Daten zur Reichweite, Inanspruchnahme und Qualität bestehender und neuer Testangebote erhoben und ausgewertet werden.








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
