Joachim Richter1*,
Tarik El Scheich2, Emilie Liot1, Irmela Müller Stöver1,
Dieter Häussinger1, Jörg Heukelbach3
Bilharziose (Schistosomiasis)
Die Bilharziose ist eine durch Trematoden der Gattung Schistosoma (syn. Pärchenegel) hervorgerufene Erkrankung. Entsprechend der Lokalisation der adulten Würmer im Körper und deren Eiablagerung äußert sich die Bilharziose in Veränderungen des Harntraktes und der Genitalorgane (urogenitale Bilharziose), des Darmes (intestinale Bilharziose) und/oder der Leber und Milz (hepatolienale Bilharziose). Andere Organe können ebenfalls betroffen sein und zu kardiopulmonalen, neurologischen und anderen ektopischen Krankheitsbildern führen.
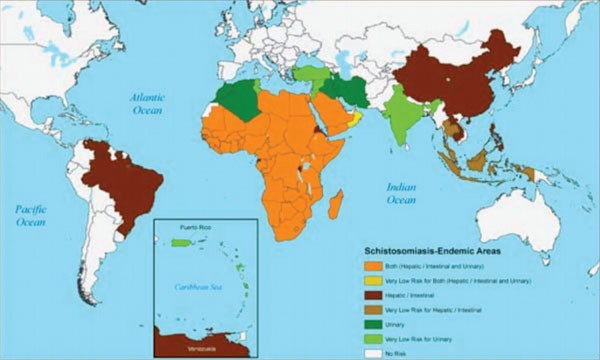
Abb. 1: Verbreitung der Bilharziose
Epidemiologie
Fast 800 Millionen Menschen sind dem Risiko einer Infektion durch eine oder mehrere Schistosomenarten ausgesetzt. Mehr als 230 Millionen Menschen in 76 tropischen und subtropischen Ländern sind von der Bilharziose betroffen, von denen 10% an einer schweren Verlaufsform leiden. Das kontinentale Afrika und Madagaskar tragen die Hauptlast der Parasitose. In Afrika sind drei der fünf humanpathogenen Schistosomen-Arten, nämlich S. haematobium, (Verursacher der urogenitalen Bilharziose), S. mansoni und S. intecalatum (Verursacher der intestinalen Bilharziose) endemisch. S. haematobium-S. mansoni-Doppelinfektionen kommen in vielen Regionen Afrikas vor. S. intercalatum ist auf Zentralafrika beschränkt. Die Charakteristiken der Zwischenwirte erklären in hohem Maße die geographische Verbreitung der Bilharziose. In Regionen mit längeren Trockenperioden herrschen zum Beispiel S. haematobium-Infektionen vor, da Bulinus-Schnecken, die diese Form der Bilharziose übertragen, zur Anhydrobiose befähigt sind. Bei konstanter Bewässerung (Staudammbau) werden diese durch Biomphalaria-Schnecken verdrängt, die S. haematobium-Zwischenwirte sind.
Südasien ist bilharziosefrei mit Ausnahme eines kleinen, noch nicht klar definierten Herdes in Hyderabad in Indien. In Ostasien wird die intestinale Bilharziose durch S. japonicum, in Laos und Kambodscha durch S. mekongi hervorgerufen. In Südamerika und der Karibik ist nur S. mansoni endemisch. In Südeuropa wurde die S. haematobium-Infektion in der Nachkriegszeit endgültig ausgerottet (Abb. 1).
Ätiologie und Parasitologie (Abb. 2a, b)
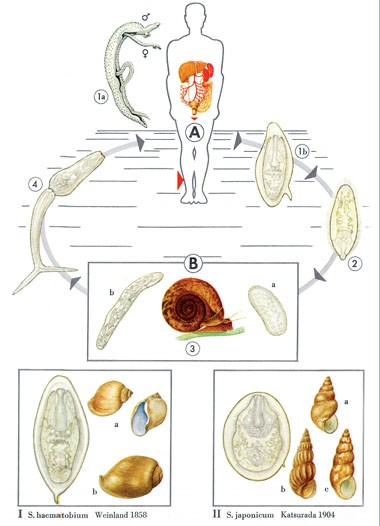
Abb. 2a: Lebenszyklus der Schistosomen

Abb. 2b: Typische Süßwasserexposition in Mali
Die adulten Schistosomen sind etwa 6 bis 20 mm lang und leben überwiegend in den peripheren Mesenterialgefäßen des Darmes, in den Verzweigungen der Pfortader und den Gefäßen der Organe des kleinen Beckens. Der Entwicklungszyklus ist bei den verschiedenen Schistosomenarten ähnlich. Die Weibchen legen täglich zwischen 100 bis 3.000 Eier in das Kapillarbett der Harnblase oder des Darmes des Wirtes. In den von den weiblichen Würmern abgelegten Eiern entwickeln sich innerhalb von zehn Tagen Mirazidien (Wimpernlarven). Nach Durchwanderung der Organwand und -schleimhaut gelangen die Eier mit dem Urin oder Stuhl ins Freie. Bei Kontakt mit Süßwasser schlüpfen die Mirazidien und erreichen durch die Bewegung ihrer Zilien eine geeignete Überträgerschnecke. Aquatische bzw. amphibische Lungen- und Kiemenschnecken sind die obligaten Zwischenwirte der Schistosomen. Die meisten dieser Schnecken leben in vegetationsreichen Uferzonen stehender oder langsam fließender Gewässer. Die ostasiatischen Schnecken der Gattung Oncomelania leben amphibisch im unmittelbaren Uferbereich und fressen hier den algenbewachsenen Boden ab. Die Schistosoma mekongi-übertragende Schnecke Neotricula aperta ist an Gewässer mit relativ schneller Strömung angepasst. Das Mirazidium dringt in die Schnecke ein und formt sich innerhalb von 48 Stunden zur sogenannten Sporozyste um. In der Schnecke entwickeln sich die infektiösen Larven (Furko-Zerkarien=„Gabelschwanzlarven“). Sie verlassen die Schnecke und steuern von ihrem gegabelten Schwanz angetrieben den definitiven Wirt an. Zerkarien sind 24 bis maximal 48 Stunden im Süßwasser lebensfähig. Sie bleiben auch nach einem freien Fall bis zu 10 m in einem Wasserfall infektionsfähig. Beim aktiven Eindringen einer größeren Anzahl von Zerkarien durch die Haut in den menschlichen Endwirt kommt es zu einer Hypersensibilitätsreaktion vom Typ I, der Zerkariendermatitis. Die einwandernden Zerkarien wandeln sich nach Abwerfen des Schwanzes zu Schistosomula um.
Vier bis sieben Wochen nach Erstinfektion kann eine fieberhafte Krankheitsphase auftreten (akute Bilharziose). Sie wird als eine hyperergische Allgemeinreaktion des sensibilisierten Wirtsorganismus im Sinne einer Hypersensibilitätsreaktion Typ III angesehen.
Nach einer Dauer von einer bis mehreren Wochen wird das Invasionsstadium von dem chronischen Stadium abgelöst. Die intravaskulär lebenden inzwischen adulten Würmer setzen zwar eine große Menge sekretorischer und exkretorischer Substanzen frei, die eine Immunantwort induzieren, jedoch richtet sich diese überwiegend gegen Schistosomula bei einer Reinfektion („konkomitierende Immunität“). Daher nimmt die Reinfektionsrate mit zunehmendem Alter ab. Die adulten Würmer werden nicht beeinträchtigt, da sie in der Lage sind, sich der Immunantwort zu entziehen. Während die adulten Würmer kaum eine Rolle für pathologische Veränderungen spielen, hängt die Ausprägung von Krankheitserscheinungen von der täglichen Eiproduktion und der Interaktion zwischen parasitären Antigenen und dem Immunsystem des Wirtes ab. Die von den im Ei reifenden Mirazidien produzierten Eiantigene lösen die Bildung von Granulomata aus. An Stellen, an denen mehrere Granulomata konfluieren, ist die Entstehung größerer Wucherungen möglich, die polypenartig in das Lumen der Ausscheidungsorgane vorspringen können. Am Ende dieser Reaktionen steht die fibröse Vernarbung des betroffenen Gewebes. Bei einer Infektion mit Schistosoma haematobium treten nach etwa drei Monaten chronische Erscheinungen auf. Die makroskopischen Veränderungen der Blasenschleimhaut sind in der Nachbarschaft der Ureteröffnungen und am Trigonum am stärksten ausgeprägt. Es zeigen sich hyperämische Flecken und Gruppen von gelblichen Knötchen von Stecknadelkopfgröße. Ältere Läsionen haben eine sandkornähnliche Struktur und sind pathognomisch. Sie enthalten massenweise verkalkte Eier und fühlen sich daher wie Sand an (englisch: „sandy patches“, französisch: „grains de sable“). Geschwüre und Papillomata treten auf. Im Spätstadium schwerer Infektionen verliert die Blase infolge der dichten Durchsetzung mit verkalkten Eiern immer mehr ihre natürliche Kontraktionsfähigkeit. Durch Verschluss der Ureterenöffnung und Stenose des Harnleiters im distalen Drittel kann es zur Hydronephrose und Niereninsuffizienz kommen. Langjährige Infektionen können zusammen mit anderen Karzinogenen zu einem Blasenkarzinom führen, das vor allem bei Männern im mittleren Lebensalter auftritt und in endemischen Gebieten die häufigste Krebsart darstellt. Granulomata, fibrotische und kalzifizierende Veränderungen können sich in unterschiedlichem Maße im Genitaltrakt ausbilden. Beim Jugendlichen und Mann treten entsprechende Veränderungen in den Samenbläschen, Nebenhoden, und der Prostata, seltener im Hoden auf. Bei Mädchen und Frauen führt dies zu ulzerierenden und papillomatösen Veränderungen der äußeren Genitalorgane, zu fibrösen Massen des Uterus und der Adnexe. Eine bilharziöse Salpingitis kann durch Tubenverschluss zur Infertilität führen bzw. zu extrauterinen Schwangerschaften. Vesikovaginale Fisteln können neu entstehen bzw. die Abheilung vorbestehender Fisteln kann erschwert werden. In der Schwangerschaft kann die Plazenta betroffen sein, das intrauterine Wachstum des Foetus beeinträchtigt sein.
Bei Infektionen durch Schistosoma mansoni, Schistosoma japonicum und S. mekongi können schwere Kolitiden mit hyperämischen Flecken, „sandy patches“, Knötchen, polypenartige Wucherungen, Kalzifikationen bis hin zu obstruierenden Pseudotumoren auftreten. Schistosoma intercalatum-Infektionen verlaufen relativ blande und bleiben auf das Rektum beschränkt. Während in allen Teilen des Dünn- und Dickdarmes Schistosomeneier gefunden werden können, bleiben schwere fibrotische Veränderungen zumeist auf den Dickdarm begrenzt. Die Darmveränderungen können in seltenen Fällen soweit gehen, dass pseudoneoplastische Massen entstehen. Die Vernarbungen des Darmes führen dazu, dass Schistosomeneier vom Darmkapillarbett nicht mehr ins Darmlumen gelangen können und in den Pfortaderkreislauf zurückgeschwemmt werden. In 5-10% der Patienten kommt es zur Beteiligung der Leber und Milz. Das Konfluieren der fibrösen periportalen Vernarbungen führt zur portalen Leberfibrose, die für die S. mansoni-Infektion charakteristisch ist. Bei der S. japonicum-Infektion kann sich außerdem eine septale Fibrose ausbilden (Netzwerkfibrose). Leberzellnekrosen treten nur in geringem Maß auf, auch bei fortgeschrittener hepatischer Beteiligung bleibt die Leberfunktion erhalten. Das Milzvolumen nimmt als Folge einer reaktiven Immunreaktion und portalen Hypertension zu.
Durch die Bildung spontaner porto-cavaler Anastomosen kommt es bei 10-35% der Fälle mit portaler Hypertension zur Abschwemmung von Eiern auch in die Lungenkapillaren, wo die Lungefibrose zur pulmonalen Hypertonie und Cor pulmonale führen kann. Eier können in zahlreiche andere Organe geschwemmt werden: ektope Lokalisationen treten beispielsweise im zentralen Nervensystem, in der Appendix, im Pankreas, der Haut und in der weiblichen Brust auf. Bei S. mansoni-infizierten Kindern und Jugendlichen treten gehäuft Glomerulonephritiden auf, die zum nephrotischen Syndrom führen. Kinder mit schwerer Leberfibrose gedeihen schlecht. Nanismus und eine verspätete sexuelle Reifung können die Folge sein.
Klinik
Leichte Infektionen bleiben in der Regel asymptomatisch. Die Zerkariendermatitis äußert sich durch urtikarielle Reaktion der Haut kurze Zeit nach Exposition. An den exponierten Hautstellen können sich rote Flecken und Papeln bilden, die innerhalb von einer Woche abheilen. Die Zerkariendermatitis kann auch in unseren Breiten auftreten („Badeseedermatitis“). Sie wird dann allerdings von Spezies, die an Vögel, z.B. Enten adaptiert sind, hervorgerufen, und der Mensch fungiert als Fehlwirt.
Die akute Bilharziose verläuft meist asymptomatisch. Dies gilt in besonderem Masse für die subklinische akute Infektion von kleinen Kindern endemischer Regionen. Dagegen kommt es bei Erstinfektion immunologisch naiver Individuen wie Touristen und Migranten einige Wochen nach Infektion zu einem hochfebrilen Krankheitsbild mit Hepatosplenomegalie und urtikariellen Symptomen. Laborchemisch liegen eine deutliche Beschleunigung der Blutsenkung sowie eine ausgeprägte Eosinophilie vor. Die akute Bilharziose kann im Einzelfall lebensbedrohlich sein.
Die Klinik der chronischen Bilharziose hängt vom befallenen Organsystem ab: Die ersten Zeichen der Blasenbilharziose (durch S. haematobium hervorgerufen) sind Dysurie, Pollakisurie und perineale Schmerzen. Gleichzeitig tritt bei vielen Patienten eine terminale Hämaturie auf. Harnabflussstörungen entwickeln sich schleichend, deren Vorliegen häufig erst im Rahmen einer akuten bakteriellen Pyelonephritis oder einer terminalen Hydronephrose festgestellt wird. Das bilharziose-assoziierte Harnblasenkarzinom tritt meist im frühen Erwachsenenalter auf. In Ägypten ist das Plattenepithelkarzinom der Blase das häufigste Malignom. Bilharziose-induzierte Genitalveränderungen werden oft nicht mit der Erkrankung in Verbindung gebracht, da sie unspezifisch sind. Bei der Mädchen und Frau treten im unteren Genitaltrakt ulzerierende oder papillomatöse-polypöse Schleimhautveränderungen auf. Vesikovaginale Fisteln können auftreten. Gefährlichste Komplikation eines Befalles der inneren Genitale ist eine durch inflammatorischen Verschluss der Tuben hervorgerufene extrauterine Schwangerschaft. Bei Jungen treten Hydrocele und Scrotalschwellung auf, die mitunter zur Hemiorchektomie wegen eines Tumorverdachtes führen. Leitsymptom der Genitalbilharziose beim Mann ist die Hämatospermie.
Die intestinale Bilharziose äußert sich durch intermittierendes Auftreten von schleimig-blutigen Stühlen und Diarrhoen. Die Portalfibrose, die bereits bei Jugendlichen auftreten kann, wird oft erst bemerkt, wenn sie zur Ösophagusvarizenblutung im Rahmen einer portalen Hypertension geführt hat. Die kardiopulmonale Bilharziose äußert sich nicht nur durch Zeichen der Rechtsherzbelastung, sondern auch durch Trommelschlegelfinger. Eine Fehlabsiedlung von Würmern in das zentrale Nervensystem kann sowohl während des akuten als auch während des chronischen Stadiums der Bilharziose auftreten. Spastische Monoplegien oder Hemiplegien, Zeichen einer Enzephalitis, einer transversen Myelitis oder Krampfanfälle deuten auf eine Neurobilharziose hin.

Abb. 3: Anzeichen für Blasenbilharziose: trüber oder blutiger Urin

Abb. 4: Bilharziosediagnostik in Mali: Mikrofiltration des Urins
Genitale Ulzerationen können die Übertragung von Koinfektionen wie beispielsweise HIV, HTLV-1, Hepatitis B und C begünstigen. Eine mit viraler Hepatitis assoziierte hepatolienale Bilharziose verläuft deutlich schwerer, und das Bild der portalen Hypertension wird durch den hepatitisbedingten Leberparenchymschaden kompliziert. HIV hat einen im Vergleich zu HTLV-1 geringeren Einfluss auf den Krankheitsverlauf. HIV- und HTLV-1-positive Patienten scheiden eine geringere Anzahl Eier im Stuhl aus und sind für Reinfektionen besonders empfänglich. HTLV-1-positive Patienten haben ein geringeres Risiko an einer tropischen spastischen Paraparese zu erkranken, wenn sie gleichzeitig an Bilharziose leiden. Bilharziose-Kranke haben ein geringeres Risiko eine Leberfibrose zu entwickeln, aber erleiden häufiger ein Therapieversagen, wenn sie außerdem mit HTLV-1 infiziert sind.
Diagnose
Der Verdacht auf eine akute Bilharziose stellt sich nach entsprechender Exposition eines immunologisch naiven Patienten, der zwei bis sechs Wochen zuvor mit Süßwasser Kontakt hatte und eine febrile Hepatosplenomegalie mit ausgeprägter Eosinophilie, IgE-Erhöhung und Entzündungszeichen aufweist. Anamnestisch ist auch das Beobachten einer Zerkariendermatitis von Bedeutung. Sowohl der serologische Nachweis als auch der direkte Nachweis von Eiern kann meist erst einige Zeit nach Auftreten der Symptomatik geführt werden.
Laborbefunde im chronischen Stadium umfassen eine mehr oder weniger ausgeprägte Eisenmangelanämie und eine insbesondere bei Hypersplenismus auftretende Thrombozytopenie bzw. Panzytopenie, eine mäßige Eosinophilie und IgE-Erhöhung. Bei der Blasenbilharziose sind eine terminale Makro-Hämaturie und eine Trübung des Urins (Abb. 3), bei weniger starkem Befall Mikrohämaturie, Proteinurie, Leukozyturie nachweisbar. Urinuntersuchungen sind um die Mittagszeit am ergiebigsten, da in dieser Zeit die maximale Eiausscheidung stattfindet. Die maximale Sensitivität des direkten mikroskopischen Nachweises von Wurmeiern wird durch das Filtrieren eines über 24 Stunden gesammelten Urins durch besondere Filter, deren Porengröße so ausgelegt ist, dass die Eier auf ihnen zurückbleiben („Nucleopore-Filter“), erreicht (Abb. 4). Bei der intestinalen Bilharziose wird die Sensitivität der Stuhluntersuchung durch Anreicherungsverfahren und Untersuchung mehrerer Stuhlproben erhöht. Schistosomeneier können auch im Quetschpräparat aus Rektum-, Blasen- oder Genitalschleimhaut nachgewiesen werden.
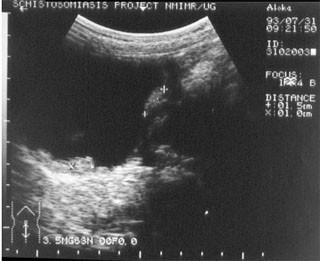
Abb. 5: Kraniokaudales Ultraschallbild der Harnblase. Echogene Wandverdickungen der Blasenwand
Das sonographische Bild der Blasenveränderungen ist charakteristisch (Abb. 5). Diagnostische Leberpunktionen sind nicht indiziert, da der sonographische Aspekt der bilharziosebedingten Leberfibrose pathognomonisch ist (Abb. 6, 7).
Therapie
Die Zerkariendermatitis wird mit Antihistaminika symptomatisch behandelt. Bei schweren Formen der akuten Bilharziose kann eine Therapie mit Antihistaminika und Kortikoiden erforderlich werden, um allergische Begleitsymptome zu beherrschen. Eine spezifisch antiparasitäre Therapie sollte erst später erfolgen und nach einigen Wochen wiederholt werden, da die noch unreifen Würmer schlecht auf die meisten Antihelminthika ansprechen. Das Mittel der Wahl ist Praziquantel, da es gegen alle humanpathogene Schistosomenarten wirksam ist (Verg. Kasten Praziquantel) Die rechtzeitige antiparasitäre Therapie im Kindesalter kann bei der Bilharziose zur vollständigen Rückbildung sogar ausgeprägter Veränderungen führen. Dabei bilden sich Läsionen des Harntraktes und des Darmes zurück, selbst wenn die Patienten sich reinfizieren. Die Rückbildung von Leberveränderungen ist weniger konstant: mindestens zwei Behandlungen müssen im Kindesalter erfolgen, um die Fibrosebildung aufzuhalten bzw. zu einer Rückbildung zu führen. Eine fortgeschrittene Leberfibrose ist oft nicht mehr reversibel.
Behandlung der Komplikationen
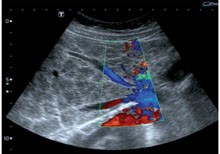
Abb. 6: links: Sonogramm der Gallenblase: echodichte Gallenblasenwandverdickung, rechts: Sonogramm des linken Leberlappens: echogene portale Wandverdickung „Tonpfeifenstielfibrose“
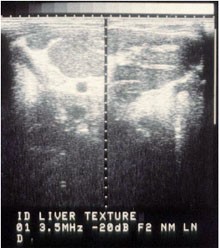
Abb. 7: Netzwerkfibrose der Leber
Wenn möglich, werden Ösophagusvarizenblutungen durch eine endoskopische Bandligatur oder Sklerosierung gestillt. Der protektive Effekt einer Betablockertherapie wurde auch bei der hepatolienalen Fibrose gezeigt. Über den Einsatz transjugulärer intrahepatischer portosystemischer Shunt-Anlagen besteht wenig Erfahrung. Bei trotz konservativer Maßnahmen rezidivierenden Varizenblutungen kann eine Splenektomie in Assoziation mit unterschiedlichen Shunt-Operationen erforderlich werden. Entscheidend bei der Therapie der Neurobilharziose ist, dass die Ätiologie erkannt wird, bevor irreversible Schäden auftreten. Wenn die Therapie rechtzeitig mit Praziquantel erfolgt, kann die Ausbildung von Spätschäden verhindert werden. Die Behandlung sollte unter Kortikoidschutz durchgeführt werden, da das Absterben von Schistosomen zur Ausschwemmung von Antigenmaterial und zu einer erheblichen Aktivierung der Immunantwort führen kann, was die Symptomatik zeitweise zuspitzt.
Bekämpfung und Kontrolle
Die Kontrolle der Bilharziose benötigt einen multidisziplinären Ansatz, da viele Aspekte eine Rolle spielen. Die Übertragungskette kann unterbrochen werden durch: 1. Vermeidung der Exposition des Menschen (für den Tropentouristen bedeutet dies, nicht in Süßwasser in endemischen Gebieten zu baden), 2. Elimination des Zwischenwirtes durch Behandlung befallener Gewässer mit Schneckenvernichtungsmitteln und andere Umweltmaßnahmen, 3. Reduktion der Ei-Ausscheidung beim Endwirt durch konsequente Behandlung mt Praziquantel, 4. Verhinderung der Kontamination der Gewässer durch Stuhl bzw. Urin infizierter Menschen (Verbesserung der sanitären Anlagen und Veränderung des Verhaltens), und bei einigen Schistosomen-Spezies durch Kot infizierter Tiere.
 Praziquantel
(Biltricide®)
Praziquantel
(Biltricide®)
Das
Anthelminthikum Praziquantel (Biltricide®) wirkt gegen Plattwürmer
(Plathelminthes) wie Bandwürmer (Cestoda) und
Saugwürmer
(Trematoda) (einschließlich der Pärchenegel (Schistosoma)). Die durch den Wirkstoff verursachte
Öffnung
der
Calciumkanäle der kontraktilen Zellen der Wurmaußenhaut führt zur spastischen
Lähmung des Wurmes, zu dessen Tod und Austreibung mit dem Stuhl bei
Innenschmarotzern (Endoparasiten).
Dosierung:
Einmalig 40 mg/kg bei S.
haematobium, S. mansoni, S. intercalatum
Über
1-3 Tage 2x 30 oder 3x 20 mg/kg bei S. japonicum, S. mekongi.
Hinweis: Bei akuter Bilharziose und Neurobilharziose kann zu Beginn der Behandlung eine herxheimerähnliche Immunreaktion eintreten, die ggf. mit Cortison behandelt werden muss. Reaktionsvermögen kann beeinträchtigt sein.
Wechselwirkung: Verminderte Serumkonzentration bei gleichzeitiger Dexamethasongabe, verminderte Plasmaspiegel bei gleichzeitiger Gabe von Arzneimittel, die das Enzymsystem Cytochrom P 450 induzieren (z.B. Antiepileptika). Bei gleichzeitiger Gabe von Rifampicin werden keine therapeutisch wirksamen Praziquantel-Plasmaspiegel erreicht. Längere Verweildauer von Praziquantel bei gleichzeitiger Gabe von Arzneimittel, die das Enzymsystem Cytochrom P 450 inhibieren (z.B. Cimetidin) möglich. Gleichzeitige Einnahme von Chloroquin kann Praziquantel-Konzentration im Blut verringern.
Schwangerschaft und Stillzeit:
Strenge Indikation besonders im 1. Trimenon (siehe Stellungnahme der WHO Report of the WHO informal consultation on the use of praziquantel during pregnancy/lactation and albendazole/mebendazole in children under 24 months. Geneva, World Health Organization, 2002 (WHO/CDS/CPE/PVC/2002.4)). Tropenmedizinische Konsultation empfehlenswert.
Anwendungsbeschränkungen: Eingeschränkte Nierenfunktion (verzögerte Ausscheidung). Nicht kompensierte Leberinsuffizienz bzw. Patienten mit hepatosplenaler Schistosomiasis (stationäre Therapie). Überwachung bei Herzrhythmusstörungen und digitalisbedürftiger Herzinsuffizienz.
Nebenwirkungen: Gelegentlich bis häufig treten Leibschmerzen, Myalgien (Muskelschmerz), Übelkeit, Erbrechen, Inappetenz oder Kopfschmerzen als Ausdruck der Wirkungen auf die menschlichen Calciumkanäle auf. Auch Schwäche, Schwindel, Benommenheit, Müdigkeit sowie Temperaturerhöhung und Urtikaria (Nesselsucht) sind häufig. Selten Meningismus und Verwirrtheit.
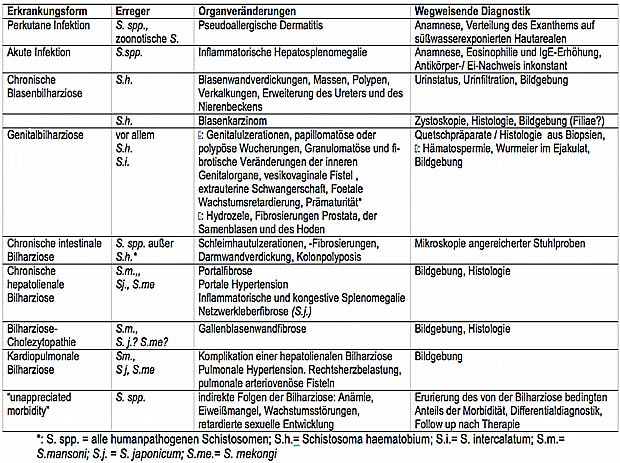
Bilharziose: Krankheitsstadium und -manifestation, kausale Schistosomenspezies, Organveränderungen und entsprechende Diagnostik










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
