Jan Thoden, Freiburg
Regelverstöße: Opportunistische Infektionen trotz
HIV-Therapie
Beim antiretroviral nicht vorbehandelten HIV-Patienten sind opportunistische Infektionen (OI) in bis zu 70% die erste offensichtliche HIV-Manifestation. Dabei treten insbesondere Pneumonien durch Pneumocystis jirovecii (PcP), Candida albicans-Infektionen (rezidivierend oral, ösophageal, tracheal oder bronchopulmonal), zerebrale Toxoplasmosen und Zytomegalievirus (CMV)-Infektionen (insbesondere an Auge, Lunge, Darm) auf. Einige OI treten bevorzugt bei sehr niedrigen CD4-Helferzellzahlen auf (<50/µl). Dies sind insbesondere Infektionen mit atypischen Mykobakterien (NTM) und CMV-Infektionen (v.a. CMV-Retinitis).
Rückgang durch ART
- Candidose von Bronchien, Trachea oder Lungen
- Candidose, ösophageal
- CMV-Infektionen (außer Leber, Milz, Lymphknoten)
- CMV-Retinitis (mit Visusverlust)
- Herpes simplex-Infektionen: chronische Ulzera (> 1 Monat bestehend; oder Bronchitis, Pneumonie, Ösophagitis
- Histoplasmose, disseminiert oder extrapulmonal
- Isosporiasis, chronisch, intestinal, > 1 Monat bestehend Kaposi-Sarkom
- Kokzidioidomykose, disseminiert oder extrapulmonal
- Kryptokokkose, extrapulmonal
- Kryptosporidiose, chronisch, intestinal, > 1 Monat bestehend
- Mycobacterium avium complex oder M. kansasii, disseminiert oder extrapulmonal
- Mycobacterium, andere oder nicht identifizierte Spezies disseminiert oder extrapulmonal
- Pneumocystis-Pneumonie
- Pneumonien, bakteriell rezidivierend (> 2 innerhalb eines Jahres)
- Progressive multifokale Leukoenzephalopathie
- Salmonellen-Septikämie, rezidivierend
- Tuberkulose
- Toxoplasmose, zerebral
Tab. 1 Übersicht opportunistische Infektionen
In der Frühphase der HIV- und AIDS-Epidemie waren OI zu einem beträchtlichen Teil verantwortlich für Morbidität und Mortalität der HIV-Infizierten. Nach Einführung der antiretroviralen Therapie (ART) ging die Inzidenz der OI-Erkrankungen deutlich zurück. In den USA nahm die Rate an OI unter ART von 140/1.000 Patientenjahren (PJ) (1995) auf < 20/1.000 PJ (2007) ab.1 In der Schweizer Kohorte nahmen OI im Zeitraum von 1995-1997 deutlich ab, von 15/100 Patientenjahren in den 6 Monaten vor ART-Beginn auf 7,7/100 in den drei Monaten nach ART, 2,6/100 in den nächsten 6 Monaten auf 2,2/100 Patientenjahre in den Monaten 9-15.2 Die Mortalität bei niedriger CD4-Helferzellzahl ist ebenfalls deutlich erhöht.3
Auch durch den konsequenteren Einsatz von Prophylaxen gab es in den vergangenen Jahren deutliche Fortschritte bei der Prävention von OI. Hierfür sind vor allem die medikamentösen Prophylaxen, insbesondere der Einsatz von Antibiotika, Antimykotika und anti(retro)viralen Medikamenten verantwortlich. Es konnte gezeigt werden, dass sich diese Prophylaxen neben dem verlängerten Überleben auch positiv auf Lebensqualität auswirkten und zudem kosteneffektiv sind.4
Geographische Unterschiede
Es zeigt sich weltweit ein geographischer Unterschied im Auftreten verschiedener OI. Aus diesem Grund ist es bei HIV-Infizierten wichtig, eine ausführliche Anamnese (insbes. Reiseanamnese) zu erheben. Global gesehen spielt die Tuberkulose die wichtigste Rolle, allerdings mit Schwerpunkt im südlichen Afrika und Osteuropa. Die viszerale Leishmaniose tritt bevorzugt in Afrika, Südamerika und Südeuropa auf, Infektionen mit Penicillium marneffei in Südostasien, Kokzidioidomykose im Südwesten der USA und die disseminierte Histoplasmose im Mittleren Westen der USA.5-7
Prognose und Therapie
In der heterogenen Gruppe der OI, haben verschiedene Entitäten.8 Am schlechtesten sind diese für die progressive multifokale Leukenzephalopathie (PML), die zerebrale Kryptokokkose, die zerebrale Toxoplasmose und disseminierte atypische Mykobakteriosen. Die Initiierung einer ART mit dem Ziel der CD4-Rekonstitution, die Senkung der HIV-Last, sowie das Ansprechen auf die spezifische Therapie der OI bzw. deren Prophylaxe tragen alle zur besseren Prognose der Patienten bei.
Es existieren internationale Leitlinien zum Umgang mit OI. Hier sei insbesondere hingewiesen auf die Leitlinien der Centers for Disease Control (CDC).9 Deutsche Leitlinien wurden seit 2009 von der Klinischen Arbeitsgemeinschaft AIDS in Deutschland (KAAD) erarbeitet und im März 2011 von der Deutschen AIDS Gesellschaft (DAIG) konsentiert. Die finale Version wird bald über die Homepage der AWMF (http://www.awmf.org/leitlinien/aktuelle-leitlinien.html) bzw. der DAIG (http://www.daignet.de) abrufbar sein.
Regelverstöße
Gemäß der aktuellen Version der deutsch-österreichischen HIV-Therapieleitlinien vom März 2010 (http://daignet.de/site-content/hiv-therapie/leitlinien-1/Leitlinien_28-05-2010_V_late.pdf) ist der Beginn der ART ab einer CD4-Zahl <350/µl indiziert und von 350 bis 500/µl bereits vertretbar. Damit erfolgt, bei rechtzeitiger Diagnose einer HIV-Infektion, der Behandlungsbeginn weit über der für das Entstehen der OI relevanten Schwelle von 200 CD4-Helferzellen/µl. OI sollten somit faktisch nicht mehr auftreten bzw. beim behandelten HIV-Patienten vermieden werden.
Late Presenter
Allerdings stellen sich je nach Untersuchung ca. 30% der Patienten als sogenannte „Late Presenter“ vor. Damit sind HIV-Infizierte gemeint, die sich (so die gängigste Definition) mit einer CD4-Zellzahl <200/µl bei HIV-Erstdiagnose vorstellen. Ca. 10% stellen sich mit CD4-Zellen <50/µl vor.10 Das RKI schätzt, dass die Rate bei ca. 30-50% der HIV-Erstmanifestationen liegt.11 In den meisten Studien nimmt der Anteil dieser Patienten aber langsam ab.12
Das BfArM lässt Studien an ART-naiven Patienten mit niedrigen CD4-Zellen praktisch nicht mehr zu, da diese gemäß der oben genannten Therapieleitlinien längst behandelt sein sollten. Die Erstvorstellung eines „Late Presenters“ mit einer OI stellt somit eigentlich einen „Regelverstoß“ dar und ist „nicht vorgesehen“. Nichtsdesto trotz braucht es gerade für diese Patienten verlässliche Leitlinien.
Unvollständige Immunrekonstruktion
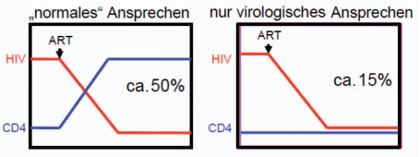
Abb.
1 Unterschiede
im immunologischen Ansprechen unter Initiierung von ART. Im „normalen“ Fall
kommt es zum Abfall der Viruslast und zum Anstieg der CD4-Zellen. In ca. 15%
zeigt sich ein immuno-virologisch diskordantes Ansprechen.14, 18, 20
Die antiretrovirale Behandlung eines HIV-Infizierten führt in der Folge nicht zwangsläufig zu einem Anstieg der Helferzellzahl in den Normbereich (und einem Abfall der HIV-Last). Insbesondere Patienten mit einer initial niedrigen Helferzellzahl <350/µl schaffen die vollständige Immunrekonstitution oft nicht13 (Abb. 1).
Bis zu ein Drittel der Patienten zeigt langfristig keinen adäquaten CD4-Anstieg. Somit kann es im Verlauf trotz antiretroviraler Therapie bei entsprechender CD4-Penie und fehlenden Prophylaxen dennoch zur Entwicklung einer OI kommen.
Je nach ART bzw. OI-Therapie kann es sogar zu einem CD4-Abfall trotz suffizienten Therapien kommen. Auch dies sind „Regelverstöße“, die so nicht vorgesehen sind.
Daten aus der ClinSurv Kohorte zeigen, dass z.B. die Erholung der CD4-Zahlen bei Patienten mit zerebraler Toxoplasmose schlechter ist im Vergleich zu HIV-Infizierten mit einer Pneumozystis-Pneumonie. Dies bedeutet auch, dass ein signifikant größerer Anteil der Patienten die Schwelle von 200 CD4/μl nicht oder erst deutlich verspätet überschreitet. Die Ursache hierfür ist nicht klar, ein Einfluss der jeweiligen Medikamente (insbesondere Pyrimethamin) bzw. Interaktionen mit der ART sind möglich, ebenso ein direkter negativer Einfluss von Toxoplasma gondii auf die Immunrekonstitution oder erhöhte Lymphozytenzahlen in der Pneumozystis-Gruppe durch Einsatz von Prednison zu Beginn der Behandlung.14 Hieraus ergibt sich die Frage, ob man die Dauer der Prophylaxe (primär oder sekundär) alleine an der absoluten CD4-Zellzahl ausrichten soll oder ob die Berücksichtigung einer Kombination verschiedener Einflussgrößen wie Erreger, HIV-Last und CD4-Zellzahl sinnvoll ist.15
Es gibt zudem eine – wenn auch kleine – Patientengruppe, die sich bewusst gegen eine antiretrovirale Therapie entscheidet, bei diesen Patienten stellt sich in der Regel keine Immunrekonstitution ein.
Therapiepausen
Andere Patienten unterbrechen ihre ART. Dies wurde anhand eines großen Patientenkollektivs in der SMART-Studie untersucht, diese Studie verfolgte eine strukturierte CD4-orientierte ART-Unterbrechung in einem Arm (DC) und eine kontinuierliche ART im anderen Arm (CT). Die DC Patienten zeigten dabei signifikant mehr Todesfälle, zudem auch ein häufigeres Auftreten von OI.16 Auch die Schweizer Kohorte konnte zeigen, dass Therapieunterbrechungen das CD4-Recovery behinderten und somit ggf. das Risiko für OI erhöhte.17
Prädiktoren
Generell sprechen je nach Studie und der Regelmäßigkeit der ART-Einnahme 6-27% der Patienten immunologisch nicht ausreichend auf eine ART an und bleiben bei einer CD4-Zahl <200/µl (trotz Virussuppression), knapp ein Drittel der Patienten verbleibt <500/µl.
Patienten mit schlechterem oder fehlendem CD4-Anstieg waren in der Regel älter, hatten mehr CDC-Kategorie C Events, eine länger zurückliegende HIV-Infektion und eine höhere Baseline-Virämie.18-20 Insbesondere bei der ersten Gruppe von Patienten besteht wahrscheinlich ein erhöhtes Risiko für eine OI, dennoch wird in vielen Fällen die Prophylaxe der OI nicht dauerhaft beibehalten.
Diskordanz
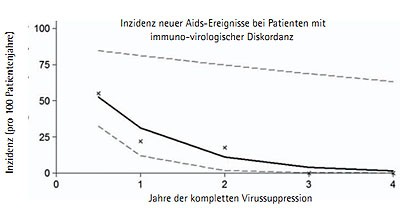
Abb. 2 Inzidenz neuer AIDS-definierender Ereignisse bei immuno-virologisch diskordantem Ansprechen unter ART. Das Risiko nimmt mit Dauer der Virussuppression ab (um 65% pro Jahr vollständiger Virussuppression) (Grafik nach 20 ).
Die ClinSurv-Kohorte, die von deutschen Zentren unterstützt wird, konnte für sogenannte immuno-virologisch diskordante Patienten (Abfall Viruslast, fehlender CD4-Anstieg) ein deutlich erhöhtes Risiko für das Auftreten von AIDS-definierende Erkrankungen in den ersten 6 Monaten nach ART-Initiierung zeigen. Danach kommt es zu einem Angleichen des Risikos im Vergleich zu Patienten, die auch immunologisch mit einem CD4-Anstieg auf die ART reagiert haben. Das Risiko nimmt mit Dauer der Virussuppression in den Folgejahren deutlich ab (um 65% pro Jahr vollständiger Virussuppression)21 (Abb. 2).
Die Ursache der Diskordanz ist nicht geklärt. Interessanterweise haben große Studien, in denen mittels Interleukin-2 die CD4-Zellzahl bei HIV-Infizierten signifikant angehoben wurden, das Eintreten klinischer Endpunkte nicht verhindern können und kein Benefit für die Patienten gezeigt (SILCAAT, ESPRIT).22
IRIS
Unter einem Immunrekonstitutionssyndrom (IRIS) versteht man eine überschießende Immunantwort nach ART-Initiierung, die bei einem Teil der HIV-Infizierten beobachtet werden kann. In der Regel kommt es bei Ansprechen auf eine erste ART und Abfall der HIV-Last zu einer zeitlich damit zusammenhängenden klinischen Verschlechterung mit infektiösem oder inflammatorischen Krankheitsbild. Klinisch kann ein IRIS mit unspezifischen Symptomen verlaufen, es können aber auch Symptome der opportunistischen Infektionen, Autoimmunphänomene oder Malignome23 auftreten.
Es existieren verschiedene Definitionen des IRIS.24, 25 Das IRIS kann als Aggravierung einer bereits bestehenden OI (sog. paradoxes IRIS) oder als „unmasking“ IRIS mit dem Neuauftreten einer OI verlaufen.
Inzidenzen des IRIS liegen je nach Kohorte und Kontinent bei 10-50%, die höchsten Inzidenzraten wurden für Immunrekonstitutions-Uveitis, Tuberkulose, Kryptokokken-Meningitis, PML und weitaus seltener bei Kaposi-Sarkomen oder VZV-Infektionen beschrieben.26
Das rasche Einleiten einer antiretroviralen Therapie nach Beginn der Behandlung der opportunistischen Infektion zeigte in einer großen prospektiven Studie27 kein Unterschied im Auftreten von IRIS, allerdings waren Tuberkulose-Patienten in dieser Untersuchung nicht eingeschlossen. Verschiedene Studien legen nahe, dass frühe ART das Überleben von HIV-Patienten mit Tuberkulose verbessert, im Gegensatz hierzu zeigten Patienten unter früher ART bei Behandlung einer Kryptokokken-Meningitis eine erhöhte Mortalität.28 Daten der STRIDE- und SAPiT-Studien zeigen ebenfalls für Patienten mit CD4-Zellen ≤50/µl bei sofortiger ART-Initiierung eine niedrigere Mortalität.29, 30
Das Auftreten einer OI unter ART als IRIS stellt einen weiteren „Regelverstoß“ dar, es kommt zur Verschlechterung statt zur Besserung des Befundes und ggf. einer Gefährdung des Patienten.
1 Beard JA, Bearden A, Striker R. Vitamin D and the anti1. Brooks JT, Kaplan JE, Holmes KK, Benson C, Pau A, Masur H. HIV-associated opportunistic infections--going, going, but not gone: the continued need for prevention and treatment guidelines. Clin Infect Dis. 2009;48(5):609-11.
2 Ledergerber B, Egger M, Erard V, Weber R, Hirschel B, Furrer H, et al. AIDS-related opportunistic illnesses occurring after initiation of potent antiretroviral therapy: the Swiss HIV Cohort Study. JAMA. 1999;282(23):2220-6.
3 Phillips AN, Staszewski S, Weber R, Kirk O, Francioli P, Miller V, et al. HIV viral load response to antiretroviral therapy according to the baseline CD4 cell count and viral load. JAMA. 2001;286(20):2560-7.
4 Freedberg KA, Scharfstein JA, Seage GR, 3rd, Losina E, Weinstein MC, Craven DE, et al. The cost-effectiveness of preventing AIDS-related opportunistic infections. JAMA. 1998;279(2):130-6.
5 Duong TA. Infection due to Penicillium marneffei, an emerging pathogen: review of 155 reported cases. Clin Infect Dis. 1996;23(1):125-30.
6 Singh VR, Smith DK, Lawerence J, Kelly PC, Thomas AR, Spitz B, et al. Coccidioidomycosis in patients infected with human immunodeficiency virus: review of 91 cases at a single institution. Clin Infect Dis. 1996;23(3):563-8.
7 Wheat LJ, Connolly-Stringfield PA, Baker RL, Curfman MF, Eads ME, Israel KS, et al. Disseminated histoplasmosis in the acquired immune deficiency syndrome: clinical findings, diagnosis and treatment, and review of the literature. Medicine (Baltimore). 1990;69(6):361-74.
8 Mocroft A, Sterne JA, Egger M, May M, Grabar S, Furrer H, et al. Variable impact on mortality of AIDS-defining events diagnosed during combination antiretroviral therapy: not all AIDS-defining conditions are created equal. Clin Infect Dis. 2009;48(8):1138-51.
9 Kaplan JE, Benson C, Holmes KH, Brooks JT, Pau A, Masur H. Guidelines for prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: recommendations from CDC, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. MMWR Recomm Rep. 2009;58(RR-4):1-207; quiz CE1-4.
10 Battegay M, Fluckiger U, Hirschel B, Furrer H. Late presentation of HIV-infected individuals. Antivir Ther. 2007;12(6):841-51.
11 RKI. Epidemiologisches Bulletin Nr. 48. http://wwwrkide/nn_196014/DE/Content/Infekt/EpidBull/Archiv/2009/48__09,templateId=raw,property=publicationFilepdf/48_09pdf. 2009.
12 Late HIV testing - 34 states, 1996-2005. MMWR Morb Mortal Wkly Rep. 2009;58(24):661-5.
13 Robbins GK, Spritzler JG, Chan ES, Asmuth DM, Gandhi RT, Rodriguez BA, et al. Incomplete reconstitution of T cell subsets on combination antiretroviral therapy in the AIDS Clinical Trials Group protocol 384. Clin Infect Dis. 2009;48(3):350-61.
14 Kastenbauer U, Wolf E, Kollan C, Hamouda O, Bogner JR. Impaired CD4-cell immune reconstitution upon HIV therapy in patients with toxoplasmic encephalitis compared to patients with pneumocystis pneumonia as AIDS indicating disease. Eur J Med Res. 2009;14(6):244-9.
15 Benson CA, Kaplan JE, Masur H, Pau A, Holmes KK. Treating opportunistic infections among HIV-infec-ted adults and adolescents: recommendations from CDC, the National Institutes of Health, and the HIV Medicine Association/Infectious Diseases Society of America. MMWR Recomm Rep. 2004;53(RR-15):1-112.
16 El-Sadr WM, Lundgren JD, Neaton JD, Gordin F, Abrams D, Arduino RC, et al. CD4+ count-guided interruption of antiretroviral treatment. N Engl J Med. 2006;355(22):2283-96.
17 Kaufmann GR, Elzi L, Weber R, Furrer H, Giulieri S, Vernazza P, et al. Interruptions of cART limits CD4 T-cell recovery and increases the risk for opportunistic complications and death. AIDS. 2011;25(4):441-51.
18 Kaufmann GR, Furrer H, Ledergerber B, Perrin L, Opravil M, Vernazza P, et al. Characteristics, determinants, and clinical relevance of CD4 T cell recovery to <500 cells/microL in HIV type 1-infected individuals receiving potent antiretroviral therapy. Clin Infect Dis. 2005;41(3):361-72.
19 Kaufmann GR, Perrin L, Pantaleo G, Opravil M, Furrer H, Telenti A, et al. CD4 T-lymphocyte recovery in individuals with advanced HIV-1 infection receiving potent antiretroviral therapy for 4 years: the Swiss HIV Cohort Study. Arch Intern Med. 2003;163(18):2187-95.
20 Egger M, May M, Chene G, Phillips AN, Ledergerber B, Dabis F, et al. Prognosis of HIV-1-infected patients starting highly active antiretroviral therapy: a collaborative analysis of prospective studies. Lancet. 2002;360(9327):119-29.
21 Zoufaly A, an der Heiden M, Kollan C, Bogner JR, Fatkenheuer G, Wasmuth JC, et al. Clinical outcome of HIV-infected patients with discordant virological and immunological response to antiretroviral therapy. J Infect Dis. 2011;203(3):364-71.
22 Abrams D, Levy Y, Losso MH, Babiker A, Collins G, Cooper DA, et al. Interleukin-2 therapy in patients with HIV infection. N Engl J Med. 2009;361(16):1548-59.
23 Haddow LJ, Easterbrook PJ, Mosam A, Khanyile NG, Parboosing R, Moodley P, et al. Defining immune reconstitution inflammatory syndrome: evaluation of expert opinion versus 2 case definitions in a South African cohort. Clin Infect Dis. 2009;49(9):1424-32.
24 Robertson J, Meier M, Wall J, Ying J, Fichtenbaum CJ. Immune reconstitution syndrome in HIV: validating a case definition and identifying clinical predictors in persons initiating antiretroviral therapy. Clin Infect Dis. 2006;42(11):1639-46.
25 Meintjes G, Lawn SD, Scano F, Maartens G, French MA, Worodria W, et al. Tuberculosis-associated immune reconstitution inflammatory syndrome: case definitions for use in resource-limited settings. Lancet Infect Dis. 2008;8(8):516-23.
26 Muller M, Wandel S, Colebunders R, Attia S, Furrer H, Egger M. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis. Lancet Infect Dis. 2010;10(4):251-61.
27 Zolopa A, Andersen J, Powderly W, Sanchez A, Sanne I, Suckow C, et al. Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: a multicenter randomized strategy trial. PLoS One. 2009;4(5):e5575.
28 Meintjes G. ART Use in Acute Opportunistic Infections. CROI 2011, Boston. 2011:Paper # 71.
29 Havlir D IP, Kendall M, Luetkemeyer A, Swindells S, Kumwenda J, Qasba S, Hogg E, Anderson J, Sanne I, and A5521 Team. . International Randomized Trial of Immediate vs Early ART in HIV+ Patients Treated for TB: ACTG 5221 STRIDE Study. CROI 2011, Boston, Paper # 38. CROI 2011, Boston. 2011;Paper # 38.
30 Abdool Karim S NK, Padayatchi N, Grobler A, Baxterc, Gengiah S, El-Sadr W, Friedland G, and Abdool Karim Q. Optimal Timing of ART during TB Therapy: Findings of the SAPiT Trial. CROI 2011, Boston. 2011;Paper #39LB.
Regelverstöße in Zeiten von DRGs
Es gibt immer mehr (internationale und nationale) Leitlinien (LL) zur Behandlung verschiedener Erkrankungen – so auch zur Behandlung von OI. Dabei sind LL für den Behandler in Deutschland rechtlich nicht bindend, stellen aber eine durchaus relevante und hilfreiche Behandlungsempfehlung dar. Verstöße gegen LL können zu Regressen führen. Die Erstellung von LL insbesondere auf Grundlage von guter Evidenz und randomisierten Studien ist insbesondere bei seltenen Erkrankungen schwierig. Auch werden die Empfehlungen, die sich aus LL ergeben teilweise nur ungenügend umgesetzt.
Trotz genauer Vorgaben zur Behandlung von OI in LL und klaren Vorgaben zur Behandlungsdauer einzelner OI beträgt die mittlere Verweildauer für HIV-Infizierte mit OI in der G-DRG S63B nur 12 Tage, obwohl z.B. für Pneumocystis jirovecii Pneumonie (PcP) eine mindestens dreiwöchige Therapie gefordert wird (und dies ab Diagnosestellung!). In der G-DRG S63A ist die Verweildauer 28 Tage (http://drg.uni-muenster.de/index.php?option=com_drgsystematik&view=DRGSystematik&Itemid=49&baserate=2800&showgrafik=0&version=GDRG2009&mdc=18A). Dies stellt (moralische) Regelverstöße und evtl. sogar ärztliche Fehler unter ökonomischem Druck dar, die gegen die Empfehlungen gültiger LL und nicht zum Wohle der Patienten geschehen. Es bleibt zu hoffen, dass im Laufe der Zeit eine sinnvolle Anpassung der Bezahlung der Leistungen und Ausdehnung der Behandlungs- bzw. Liegedauer zur adäquaten Versorgung dieser aufwändigen Patienten erfolgt.








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
