Christian Hoffmann, Hamburg
Was schief gehen kann, geht schief – oder: ein Plädoyer für Proteasehemmer
Die antiretrovirale Therapie (ART) soll heute viele Jahre, ja wahrscheinlich sogar Jahrzehnte halten. Ohne Aussicht auf Eradikation ist eine Langzeit-Strategie vonnöten, die den gegenwärtigen Studien-Horizont von 48, 96 oder 152 Wochen bei weitem übersteigt. Wir alle sind inzwischen mutig geworden, versprechen unseren Patienten selbstbewusst eine weitgehend normale Lebenserwartung. Das Gros der Patienten kommt alle drei Monate zu den üblichen Kontrollen, man schüttelt sich die Hand, vereinfacht, feinjustiert die ART, wenn möglich. Routine macht sich breit. Aber ist wirklich alles in Ordnung? Der folgende, vielleicht nicht besonders spektakuläre, aber dennoch bewusst gewählte Fall soll zeigen, dass auch heute im Zeitalter moderner Therapien, das Eis noch brüchig sein kann. Was schief gehen kann, geht schief.
Der damals 25-jährige, homosexuelle Krankenpfleger stellte sich erstmals Anfang 2007 vor. Zu diesem Zeitpunkt fand sich trotz der Tatsache, dass die (dokumentierte) Serokonversion lediglich ein Jahr zurück lag, bereits ein deutlicher Immundefekt von lediglich 78 (10%) CD4-Zellen/µl, bei einer sehr hohen Viruslast von 1.070.000 Kopien/ml. Abgesehen von Diarrhoen bestanden keine Beschwerden. Der Patient erhielt umgehend eine ART mit Tenofovir, FTC und Nevirapin. Retrospektiv lässt sich nicht mehr ganz genau eruieren, warum genau dieses Regime gewählt wurde. Auf Efavirenz wurde wahrscheinlich aufgrund der Nachtdienst-Tätigkeit verzichtet, auf Proteasehemmer aufgrund der anfänglichen Diarrhoe-Problematik. Nach vier Wochen sank die Viruslast auf 36.000 Kopien/ml, nach 8 Wochen auf 2.000 Kopien/ml, nach 12 Wochen wurde aufgrund einer persistierenden Viruslast von 1.800 Kopien/ml ein genotypischer Resistenztest durchgeführt. Im Gegensatz zum Wildtyp-Befund zur Baseline zeigte dieser die drei Mutationen K65R, M184V und Y181C.
Kommentar:
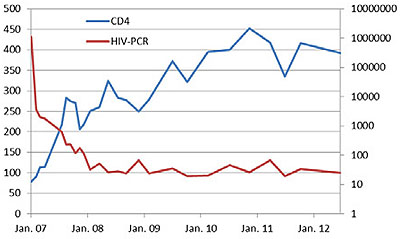 Immunstatus (CD4-Zellen/µl) und Viruslast (HIV RNA-Kopien/ml) bei dem Patienten
Immunstatus (CD4-Zellen/µl) und Viruslast (HIV RNA-Kopien/ml) bei dem Patienten
Bei diesem jungen Mann kommen schon nach wenigen Wochen wesentliche Elemente der antiretroviralen Therapie nicht mehr in Frage. Die beiden Mutationen K65R und M184V beschränken die Optionen deutlich im NRTI-Bereich, im Grunde ist kein gängiger Backbone mehr wirksam. Die Mutation Y181C sorgt für eine hochgradige Resistenz gegen die Erstgenerations-NNRTIs Nevirapin und Efavirenz, wahrscheinlich aber auch für eine Resistenz gegen Etravirin und Rilpivirin.
Nach
diesem erschreckenden Befund wurde auf eine Kombination aus AZT, 3TC, Tenofovir
und dem geboosterten PI Lopinavir/r gewechselt. Diese Therapie wurde einerseits
gewählt, um durch die Konservierung der Mutation M184V die Replikationsfitness
zu reduzieren, und andererseits durch die Kombination aus AZT und Tenofovir dem
Virus divergierende Resistenzpfade zu erzwingen. Darunter kam es in der Folge
zu einem Absinken der Viruslast auf ein Low-Level-Niveau von 30-50 Kopien/ml,
allerdings nicht unter 20 Kopien/ml. Wegen persistierender Diarrhoen wurde
Lopinavir nach einigen Monaten durch Darunavir/r ersetzt. Die CD4-Zellen lagen
ein Jahr nach Therapiebeginn bei 200-300 CD4-Zellen/µl.
Kommentar:
Retrospektiv muss man sich fragen, ob die Resistenzen nicht schon bei Therapiebeginn vorlagen und, vom Wildtyp überwuchert, einfach nur nicht detektiert wurden. Sie ließen sich allerdings auch durch eine intensive Nachuntersuchung konservierter Proben nicht nachweisen.
| Resistenzen unter NNRTI - bzw. PI-haltiger Primärtherapie bei Therapieversagen (Gupta 2008) | |||
|---|---|---|---|
| NNRTI s | PIs | P | |
| M184V | 35,3% (29,3-41,6) | 21,0% (14,4-28,8) | < 0,001 |
| K65R | 5,3% (2,4-9,9) | 0% (0-3,6) | 0,01 |
| Resistenz gegen 3. Substanz (NNRTI oder PI) | 53,0% (46-60) | 0,9% (0-6,2) | < 0,001 |
Zwei Jahre später klagte der Patient über eine zunehmende Lipoatrophie, sowie verstärkte Müdigkeit im Sinne eines Fatigue-Syndroms. Es wurde ein Tropismus-Test aus proviraler DNA durchgeführt, der ein dualtropes Virus ergab. Der CCR5-Antagonist Maraviroc kam somit nicht in Frage. Der Patient erhielt unter der Vorstellung, dass die Kombination aus drei NRTIs letztlich zu der Lipoatrophie geführt hatte und möglicherweise auch das Fatigue-Syndrom mit verursacht haben könnte, eine Nuke-freie Kombination aus Darunavir/r und Raltegravir. Unter dieser ART befindet sich die Viruslast unter dieser Therapie weiterhin auf einem Low-Level-Niveau auf 20-30 Kopien/ml, wenngleich weiterhin nie wiederholt unter der Nachweisgrenze von 20 Kopien/ml. Unter dem subjektiven Eindruck von Patient und Behandler hat sich an der Lipoatrophie bislang nichts geändert.
Kommentar:
In den Statistiken, in denen meist der Anteil der Patienten mit einer Viruslast von unter 50 Kopien/ml berechnet wird, würde dieser Patient vermutlich als Erfolg gewertet. Und dennoch: Dieser inzwischen 29 Jahre alte Mann hat trotz stets guter Adhärenz und einem Beginn der ART im Jahre 2007, nur noch wenige Optionen. Er steht schon jetzt unter einer experimentellen, durch keine größere klinische Studie abgesicherten Kombination. Klar ist auch, dass es für ihn auch mittelfristig nur mit einem geboosterten PI-Regime weiter gehen wird. Die Low-Level-Virämie bereitet Sorgen. Werden sich im Langzeitverlauf weitere Resistenzen entwickeln, insbesondere gegen den Integrase-Inhibitor Raltegravir? Muss die Therapie intensiviert werden, und wenn ja, mit was? Innovationen sind aktuell nicht in Sicht, neue Substanzgruppen auf absehbare Zeit nicht zu erwarten. Mit Elvitegravir und Dolutegravir werden allenfalls neue Möglichkeiten kommen, evtl. auf ein einmal tägliches Regime zu wechseln; die derzeit notwendige zweimal tägliche Einnahme von Raltegravir stört den im Schichtdienst arbeitenden Patienten sehr.
Diskussion
Die wichtigste Frage, die sich der Behandler kritisch stellen muss, lautet: hätte man diesen „virologischen Totalschaden“ verhindern können? Aus Sicht des Autors ist diese Frage zu bejahen. Zwar gibt es diverse Studien, in denen die antivirale Potenz von NNRTIs und PIs in etwa vergleichbar war, zumindest gemessen am Anteil der Patienten mit einer Viruslast unter der Nachweisgrenze. In der vielzitierten ACTG 5142-Studie zeigte sich sogar ein Vorteil von Efavirenz gegenüber Lopinavir/r (Riddler 2008). Allerdings zeigte ACTG 5142, wie auch weitere große randomisierten Studien wie ARTEN (Soriano 2011) oder ACTG 5202 (Daar 2011): wenn die Therapie versagt, waren Resistenzen unter NNRTIs deutlich häufiger nachweisbar als unter Proteasehemmern.
Diese wurde auch in einer systematischen Auswertung von insgesamt 20 Studien mit 7.940 therapienaiven Patienten deutlich (Gupta 2008). Alle Patienten erhielten entweder einen NNRTI oder einen geboosterten PI, alle Patienten zudem 3TC oder FTC. Virologisches Versagen fand sich gleich häufig, nämlich unter NNRTIs in 4,9%, verglichen mit 5,3% unter PIs. Wesentliche Unterschiede zeigten sich bei den Patienten mit virologischem Versagen, bei denen eine genotypische Resistenztestung gelang. Mutationen wurden signifikant häufiger unter NNRTIs beobachtet. Dies galt sowohl für die NRTI-Schlüsselmutationen wie M184 und K65R, aber auch für Resistenzmutationen gegenüber NNRTIs oder PIs (siehe Tabelle).
Ein häufiger Einwand lautet, dass eine solche Resistenzentwicklung heute selten ist. Aber sind diese Patienten mit klassenübergreifenden Resistenzen, einer Konstellation wie in dem hier beschriebenen Fall, wirklich eine Rarität? Wohl eher nicht. Dazu ein paar Beispiele aus den letzten Jahren: in ACTG 5142 entwickelten bei einem frei gewählten NRTI-Backbone unter Efavirenz immerhin 4,8% (12/250) Resistenzen gegen mindestens zwei Wirkstoffklassen, verglichen mit 0,4% (1/253) unter Lopinavir/r (Riddler 2008). In ARTEN lag die Rate unter TDF+FTC plus Nevirapin bei 6,1% (23/376), verglichen mit 0% (0/193) unter Atazanavir/r (Soriano 2011). In ACTG 5202, in der entweder TDF+FTC oder ABC+3TC als Backbone gegeben wurden, fanden sich unter Efavirenz bei 3,9% (36/929) Resistenzen gegen mindestens zwei Klassen, verglichen mit 0% (0/928) unter Atazanavir/r (Daar 2011). Wenn man berücksichtigt, dass nur bei einem Teil der Patienten mit virologischem Versagen die Resistenztestung tatsächlich gelingt und dass dies unter Studienbedingungen beobachtet wurde, dürften die tatsächlichen Raten im Alltag noch höher sein.
Diese wichtigen Daten werden leider meist nicht explizit diskutiert; man muss sie sich oft vielmehr in den kleingedruckten Supplements zusammen suchen. Stattdessen werden heutzutage verschiedenste Auswertungen präsentiert, die den Anteil der Patienten unter der Nachweisgrenze nach immer neuen Methoden bestimmen und den statistischen Laien letztlich überfordern. Wer findet sich in den Analysen „ITT-LOTVR“, „PP- TLOVR“, „ITT-snapshot, ITT-TLOVR non VFeff-censored“ oder „ITT-TLOVR outcome by Self-Reported Adherence Using M-MASRI“ usw. eigentlich noch zu recht und welche Aussage haben sie noch für die Praxis?
Die simple Frage, wie viele Patienten in den einzelnen Therapiearmen klassen-übergreifende Resistenzen entwickelt haben, wird jedenfalls oft nur am Rande, manchmal gar nicht beantwortet. Dies gilt übrigens auch für neuere Arbeiten zu Integrasehemmern.
So wird in den beiden hochrangig publizierten Zulassungsstudien (DeJesus 2012, Sax 2012) zu dem neuen Integrasehemmer Elvitegravir lakonisch konstatiert, Resistenzen wären „infrequent“. Wenn man genau hinschaut, entwickelten immerhin 1,4% (10/706) der Patienten unter der Kombination TDF+FTC und Elvitegravir/Cobicistat nachweislich Resistenzen sowohl gegen Integrasehemmer als auch gegen NRTIs – bei übrigens keiner einzigen Resistenz unter Atazanavir/r. Ist eine Rate von 1,4%, bei der wahrscheinlich lebenslang zwei wichtige Substanzklassen deutlich limitiert werden, wirklich als „infrequent“ zu bezeichnen?
Fazit
In der heutigen Zeit sollte, um im Zweifelsfall bei Nebenwirkungen auch später, nach Jahren, alle Möglichkeiten in der Hand zu behalten, der Resistenzentwicklung in der Primärtherapie mehr Beachtung geschenkt werden. NNRTIs und auch Integrasehemmer sind Medikamente mit einem enormen Potential, einer exzellenten Langzeitverträglichkeit, meist geringen Interaktionspotential, einer einfachen Einnahme und der verlockenden Aussicht auf Single-Tablet-Regime. Aber eben auch zu wertvoll, um in den ersten Wochen einer Therapie ohne Not aufs Spiel gesetzt zu werden. Aus Sicht des Autors gibt es für geboosterte PIs in der Primärtherapie, zumindest in den ersten Wochen, in denen noch eine relevante Replikation stattfindet und damit das Resistenzrisiko am höchsten ist, keine Alternative.
1 Daar ES, Tierney C, Fischl MA, et al. Atazanavir plus ritonavir or efavirenz as part of a 3-drug regimen for initial treatment of HIV-1. Ann Intern Med 2011, 154:445-56.
2 DeJesus E, Rockstroh JK, Henry K, et al. Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir disoproxil fumarate versus ritonavir-boosted atazanavir plus co-formulated emtricitabine and tenofovir disoproxil fumarate for initial treatment of HIV-1 infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet 2012, 379:2429-38.
3 Gupta R, Hill A, Sawyer AW, Pillay D. Emergence of drug resistance in HIV type 1-infected patients after receipt of first-line highly active antiretroviral therapy: a systematic review of clinical trials. Clin Infect Dis 2008, 47:712-22.
4 Riddler SA, Haubrich R, DiRienzo AG, et al. Class-sparing regimens for initial treatment of HIV-1 infection. N Engl J Med 2008, 358:2095-2106.
5 Sax PE, DeJesus E, Mills A, et al. Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir versus co-formulated efavirenz, emtricitabine, and tenofovir for initial treatment of HIV-1 infection: a randomised, double-blind, phase 3 trial, analysis of results after 48 weeks. Lancet 2012, 379:2439-48.
6 Soriano V, Arastéh K, Migrone H, et al. Nevirapine versus atazanavir/ritonavir, each combined with tenofovir disoproxil fumarate/emtricitabine, in antiretroviral-naive HIV-1 patients: the ARTEN Trial. Antivir Ther 2011, 16:339-48.








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
