7TH IAS KONFERENZ 2013 IN KUALA LUMPUR, MALAYSIA
Frühe Therapie ist besser
Zum ersten Mal war eine HIV-Konferenz kleiner als die vorherige. Zur IAS-Konferenz in Kuala Lumpur kamen nicht einmal 5.000 Teilnehmer. Die Tagung in Rom zwei Jahre zuvor hatten doppelt so viele Menschen besucht. Die Gründe für das geringere Interesse könnten der Tagungsort und das zentrale Thema gewesen sein. Die IAS-Konferenz in Malaysia war der erste internationale HIV-Kongress in einem muslimischen Land und die politische Intention dabei war u.a. die Verbesserung der Situation der Drogengebraucher, d.h. Entkriminalisierung und Substitution, in Asien und Osteuropa.
Ernüchterung bei Heilung
Zum wichtigen Thema der Heilung fand noch vor der eigentlichen Konferenz der Workshop „Towards an HIV Cure“ statt. Hier hatte man das Gefühl, dass sich die Euphorie der letzten beiden Jahre etwas gelegt hat. Nach der ersten Begeisterung über den „Berlin-Patient“ und das „Mississippi-Baby“ ist inzwischen klar, dass es keinen Königsweg zur Heilung gibt, sondern dass es ein langer, aufwendiger Prozess wird.
Neue Ansätze
Die ersten Studien mit dem HDAC-Inhibitor Vorinostat verliefen eher ernüchternd. Nun hofft man auf neue, stärker wirksame Substanzen. Erste Daten wurden zu Panobinostat und Entinostat vorgestellt. Ein weiterer Ansatz sieht vor, aus den Viren, die im Körper eines HIV-Infizierten vorkommen, eine Art „Kunstvirus“ (geklont aus drei verschiedenen Sequenzen) zu konstruieren, das latent infizierte Zellen aktiviert. Was macht man nun aber mit aktivierten Zellen, die sich im Gewebe befinden und durch Medikamente teilweise nicht optimal erreicht werden? Um dieses Problem anzugehen, könnten z.B. Immuntoxine eingesetzt werden. Dazu sollen Antikörper an zelltoxische Substanzen gekoppelt werden. Bei Mäusen führte dieses Verfahren in einigen Geweben zu einem stärkeren Abfall der Viruslast als durch die ART, was auf den Verlust aktiv Virus produzierender Zellen zurückgeführt wurde.
Aus für IL-7?
In-vitro ist auch Interleukin 7 (IL-7) in der Lage, HIV aus seiner Latenz zu wecken. In der ERAMUNE 01-Studie wurde überprüft, ob dies auch klinisch messbar wäre, d.h. ob die integrierte HIV-DNA unter einer Behandlung mit IL-7 (zusätzlich zu einer intensiven ART inklusive Maraviroc und Raltegravir) abnimmt. Leider war dies nicht der Fall. Allerdings hatten die Patienten, die IL-7 erhielten, einen deutlichen Anstieg der CD4-Zellzahl, der teilweise bis über ein Jahr anhielt. Ähnliches wurde auch schon bei IL-2 beobachtet. Die zusätzlichen CD4-Zellen hatten aber in Studien keinen klinischen Nutzen gebracht.
Zwei neue „Berlin-Patienten“
Schließlich wurden noch Daten von zwei Lymphom-Patienten mit HIV vorgestellt, die ähnlich wie der
„Berlin-Patient“ eine Knochenmarktransplantation erhalten hatten, aber im Gegensatz zu diesem kein Knochenmark von einem
Spender mit der Delta-32-Mutation. Bei beiden Patienten war nach der Transplantation und auch einige Wochen nach einer
„analytischen Therapieunterbrechung“ keine HIV-DNA in peripheren Blutzellen feststellbar. Grund dafür, so wird
spekuliert, könnte die „Graft-versus-Host“-Reaktion sein, d.h. die Reaktion des transplantierten Immunsystems gegen die
als „fremd“ erkannten Zellen des ursprünglichen
Immunsystems.
Funktionelle Heilung
Besonders spannende neue Daten gab es zur funktionellen Heilung. Hier standen die sogenannten „Post Treatment Controller“ im Mittelpunkt, d.h. Patienten, deren Viruslast nach Absetzen der ART nicht anstieg. Dieser Zustand wird als „funktionelle Heilung“ oder neuerdings auch als „HIV-Remission“ bezeichnet.
Weniger als 1% aller HIV-Infizierten sind Elite Controller, d.h. die Virusreplikation wird durch körpereigene Abwehrkräfte komplett unterdrückt. Wird die akute HIV-Infektion früh und über einige Jahre behandelt, scheinen mehr Patienten dazu in der Lage zu sein. Aufgrund der bisherigen Berichte schätzt man, dass 5-15% der Patienten nach einer Behandlung Post Treatment Controllers (PTC) sein könnten. Die größte Gruppe von PTC sind derzeit die sogenannten Visconti-Patienten.
Die Visconti (Viro-Immunologic Sustained CONtrol after Treatment Interruption)-Patienten der französischen ARNS sind eine Gruppe von 14 Patienten mit folgenden Charakteristika:
- ART-Beginn in den ersten 10 Wochen nach akuter HIV-Infektion
- ART mindestens ein Jahr
- Komplette Suppression während ART
- Viruslast <400 Kopien/ml für mindestens 12 Monate nach Ende der ART
Die meisten der Patienten hatten klinische Symptome während der akuten Infektionsphase (weshalb die Infektion vermutlich auch entdeckt wurde). Im Vergleich zu Elite Controller haben PTC weniger häufig protektive Gene (z.B. HLA-B52/57) und daher auch eine geringere T-Zellantwort. Das HIV-Reservoir scheint dagegen ähnlich wie bei den Elite Controller gering zu sein und im Lauf der Zeit sogar abzunehmen. Die Menge an Zell-gebundener HIV-DNA ist gering, aber nachweisbar.
Hamburger Fall
 Dr. Evi Wolf präsentiert Daten der deutschen New Era Studie
Dr. Evi Wolf präsentiert Daten der deutschen New Era Studie
Ein Fall eines PTC wurde von Jan van Lunzen, Hamburg, vorgestellt. Bei dem mittlerweile 67jährigen Patienten wurde 1999 die Diagnose einer akuten HIV-Infektion gestellt. Der ELISA-Test war positiv, der Western Blot noch nicht ganz. Die Viruslast lag bei >1 Millionen Kopien/ml, die CD4-Zahl knapp <500/µl.
Ein Monat nach der Diagnose begann die Therapie wegen eines akuten Virusinfekts mit AZT/3TC und Efavirenz. Die Viruslast fiel rasch unter die Nachweisgrenze und mit Ausnahme zweier kleiner Blips in den ersten zwei Jahren blieb sie konstant supprimiert über 140 Wochen. Die CD4-Zahl war stabil bei Werten zwischen 900 und 1000/µl.
2004 setzte der Patient die Therapie ab. Anschließend kam es zu einem minimalen Rebound <100 Kopien/ml. Ab dem dritten Monat nach Therapieende lag die Viruslast in den nächsten neun Jahren bis heute)unter der Nachweisgrenze – selbst im ultrasensitiven Assay. In Liquor und Darmbiopsien war keine HIV-RNA und in den peripheren PBMC keine HIV-DNA nachweisbar. Lediglich im Tierexperiment konnte vermehrungsfähiges HIV von diesem Patienten produziert werden.
Anders als in den bisher beschrieben Fällen hatte der Patienten eine starke und breite CD8-Aktivierung sowie CD4-T-Zellantwort. Einige Charakteristika der T-Zellfunktionen waren vergleichbar mit denen bei Elite-Kontrollers (van Lunzen J et al. TUPE246).
Akute Infektion behandeln
Bei einer zweiten Gruppe von Patienten in Bangkok, die sehr früh behandelt wurden (Stadium Fiebig I der akuten Infektion), fand sich eine deutlich geringere Besiedelung von HIV in den Reservoiren und die Zell-gebundene HIV-DNA war während der Therapie noch weiter rückläufig bzw. nicht nachweisbar. Bisher werden diese Patienten noch behandelt.
Aufgrund dieser Daten neigt sich derzeit das Pendel eindeutig zur sofortigen Therapie der akuten HIV-Infektion. Frühere Studien konnten keinen klaren Nutzen dieser Strategie belegen. Das können die jetzt vorgestellten Daten zwar auch nicht, doch die Berichte sind überzeugender und das Ziel funktionelle Heilung erscheint attraktiver. Ob die Patienten initial mit einer herkömmlichen Dreier-Kombination oder zusätzlich mit Maraviroc oder Raltegravir behandelt werden, scheint im Hinblick auf die Viruslast und T-Zell-Erholung keinen additiven Nutzen zu bringen (Wolf E et al., MOPE097).
Neue WHO-Leitlinien
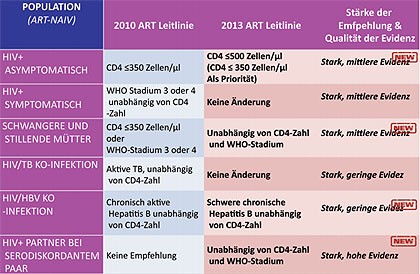 Abb 1Who-Leitlinie zum Therapiestart
Abb 1Who-Leitlinie zum Therapiestart
Ein zentrales Thema der Konferenz war die neue Therapie-Leitlinie der WHO. Die ART soll den neuen Empfehlungen zufolge nicht mehr bei unter 350 CD4-Zellen/µl, sondern schon bei unter 500 CD4-Zellen/µl eingeleitet werden. Ein sofortiger Therapiestart unabhängig von der CD4-Zahl wird zudem empfohlen bei diskordanten Paaren, bei HIV/HBV-Koinfizierten mit fortgeschrittener Lebererkrankung sowie bei Schwangeren und stillenden Müttern (Abb. 1).
Hintergrund der Empfehlung ist (abgesehen von der politischen Intention Transmissionen zu verhindern und mehr Patienten in Afrika zu behandeln) eine Metaanalyse der WHO von 13 Kohorten, in denen der Therapiestart bei unter und über 350 CD4-Zellen/µl verglichen wurde. Die frühere Behandlung verminderte das Risiko zu sterben signifikant um 34%. In vier Untersuchungen wurde auch ein Therapiestart bei unter und über 500 CD4-Zellen/µl ausgewertet. Auch hier war die frühe Therapie besser. Sie senkte das Mortalitätsrisiko um 22% – wenn auch nicht statistisch signifikant (Anglemyer A et al., TUPE302). Ob die Europäische AIDS-Gesellschafte beim nächsten Update im November dem Beispiel der Amerikaner und der WHO folgt und auch den früheren Therapiestart empfehlen wird, bleibt abzuwarten. Die kontrollierte START-Studie zu dieser Frage läuft noch.
26 Millionen brauchen ART
Derzeit werden weltweit knapp 10 Millionen Menschen antiretroviral behandelt. Den größten Zuwachs gab es 2011 mit zusätzlich 1,6 Millionen neuen Behandlungen. Das gesetzte Ziel 15 Millionen in 2015 scheint somit erreichbar. Die neue Leitlinie der WHO legt die Latte aber noch höher. Durch sie steigt die Zahl der behandlungsbedürftigen Menschen von 15 Millionen auf rund 26 Millionen. Die Mehrkosten könnten – so die WHO - durch Einsparungen bei Medikamenten, Strukturvereinfachungen sowie weniger Krankheitskosten geleistet werden. Dies würde nach Berechnungen der WHO bis 2025 3 Millionen Todesfälle und 3,5 Millionen Neuinfektionen verhindern.
Dringender Handlungsbedarf besteht auch bei der Versorgung der HIV-positiven Kinder. Derzeit wird nur ein Drittel der 1,8 Millionen therapiebedürftigen Kinder in Entwicklungsländern behandelt. Bei Kindern wird übrigens ebenfalls ein früherer Therapiestart empfohlen und zwar bei allen Kindern über 5 Jahren ab einer CD4-Zahl <500/µl sowie sofort bei allen Kindern unter 5 Jahren.
Mittel der Wahl
Als Regime der Wahl empfiehlt die WHO neuerdings nur noch die Fixkombination Tenofovir/Emtricitabin/Efavirenz. Dies Regime ist nach Meinung der WHO einfach (für den Patienten sowie für die Logistik), wenig toxisch und für alle Menschen über drei Jahre geeignet. Efavirenz könnte auch in der geringeren Dosierung von 400 mg gegeben werden. Einer kontrollierten internationalen Studie in 13 Ländern und fünf Kontinenten zufolge sind 600 mg und 400 mg Efavirenz virologisch und immunologisch gleich wirksam. Dies könnte nicht nur im Hinblick auf die Kosten günstiger sein. Unter der niedrigeren Dosis wurden auch 10% weniger Efavirenz-assoziierte unerwünschte Wirkungen beobachtet, insbesondere weniger ZNS-Probleme und Hautausschläge, (Puls R et al. WELBB02). 2013.
Kritik an Leitlinie
Das Echo auf die neue Leitlinie war nicht einstimmig positiv. Kritisiert wurde insbesondere die Empfehlung eines einzigen Regimes vor dem Hintergrund, dass es auf der letzten CROI Hinweise auf eine schädigende Wirkung durch Efavirenz in der Schwangerschaft gab. Auch die Empfehlung der Viruslastmessung als Methode der Wahl zur Therapiekontrolle stieß auf Widerstand. Die HIV-PCR ist in armen Ländern aktuell kaum verfügbar, während sich die Helferzell-Bestimmung mittlerweile gut etabliert hat.
Neue Medikamente
Die Pipeline an neuen HIV-Medikamenten ist dünn. Entwickelt werden insbesondere Medikamente, die auch einen
Einsatz im Rahmen der Prävention
versprechen. So beispielsweise der Integrasehemmer GSK 1265744. Dies
Dolutegravir-Analogon wirkt in einer Nanosuspension nach intramuskulärer Gabe vier Wochen und länger. Es wurde in einer
Dosisfindungsstudie zusammen mit TMC278, das auch i.m. gegeben wird, geprüft (Spreen W et al., WEAB0103).
Therapieversagen
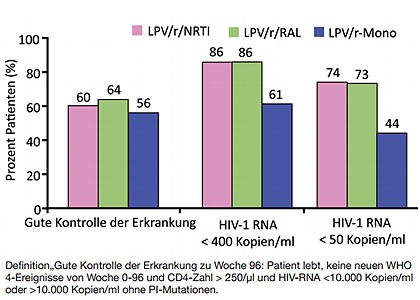 Abb 2ERNEST: Lopinvavir/r plus NRTI vs. plus RAL vs. Mono. 96-Wochen-Daten. Quelle: Paton N et al., WELBB02
Abb 2ERNEST: Lopinvavir/r plus NRTI vs. plus RAL vs. Mono. 96-Wochen-Daten. Quelle: Paton N et al., WELBB02
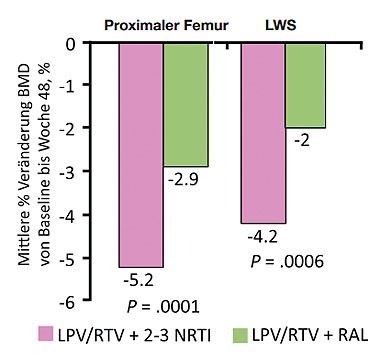 Abb 3SECOND-LINE: Lopinavir/r plus NRTI vs. Lopinavir/r plus Raltegravir. Signifikant weniger Knochenverlust bei dualer Thera-pie. 48-Wochen-Daten. Quelle: Martin A et al., WELBB05
Abb 3SECOND-LINE: Lopinavir/r plus NRTI vs. Lopinavir/r plus Raltegravir. Signifikant weniger Knochenverlust bei dualer Thera-pie. 48-Wochen-Daten. Quelle: Martin A et al., WELBB05
Beim Versagen einer Therapie eines NNRTI plus NRTI-Backbone empfiehlt die WHO die Umstellung auf einen geboosterten Proteasehemmer (PI) mit NRTI. Ob dieses Vorgehen ebenso gut ist wie die Umstellung auf einen geboosterten PI plus Integrasehemmer oder eine PI-Monotherapie, wurde jetzt in der großen Studie ERNEST untersucht. An der Studie nahmen 1.277 Afrikaner teil. Die CD4-Zahl lag im Mittel bei 70/µl und 40% hatten eine Viruslast >100.000 Kopien/ml. 70% der Patienten erhielten Tenofovir in Kombination mit Lamivudin oder Emtricitabin. Nach 96 Wochen war die Monotherapie klar unterlegen. Nur 44% der Patienten hatten eine Viruslast <50 Kopien/ml im Vergleich zu 74% bzw. 73% unter Lopinavir/r plus NRTI- oder Integrase-Backbone (Abb. 2) (Paton N et al., WELBB02).
Nuke-frei schützt Knochen
Nachteil der Umstellung auf ein Tenofovir-haltiges Regime ist allerdings der ungünstige Einfluss auf die Knochendichte. In der Studie SECOND-Line, an der rund 200 vorbehandelte Patienten teilnahmen, kam es unter Lopinavir/r plus NRTI zu einem signifikant stärkeren Verlust an Knochendichte an der Hüfte und LWS als unter Lopinavir/r plus Raltegravir. Die Patienten hatten vorher kein Tenofovir eingenommen, wurden dann aber im Rahmen der Studie auf einen Tenofovir-haltigen Backbone umgestellt (Abb. 3) Manifeste Knochenerkrankungen wie Osteopenie oder Osteoporose wurden in der 48wöchigen Beobachtung nicht festgestellt (Martin A et al., WELBB05).
Die Osteoporose scheint aber dennoch im Lauf der Jahre ein Problem bei HIV-Infizierten zu werden. In einer Arbeit wurden die Daten von einer Million Spanier, davon 2.489 HIV positiv, im Alter von über 40 Jahren ausgewertet. Die HIV-Infektion war dabei unabhängig von Alter, Geschlecht, BMI, Rauchen und Alkohol mit einem 4fach höheren Risiko für Hüftfrakturen und einem fast doppelt so hohen Risiko für alle osteoporotischen Frakturen verbunden (Abb. 4) (Knobel H et al., WEAB0205).
Dolutegravir bei Versagen
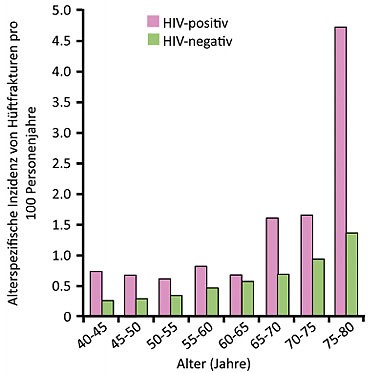 Abb 4HIV ist ein unabhängiger Risikofaktor für Hüftfrak-turen. Quelle: Knobel H et al., WEAB0205.
Abb 4HIV ist ein unabhängiger Risikofaktor für Hüftfrak-turen. Quelle: Knobel H et al., WEAB0205.
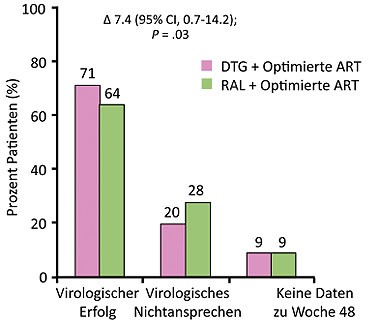 Abb
5SAILING: Optimierte ART plus Dolutegravir vs. plus Raltegravir.
Primärer Endpunkt zu Woche 48 HIV-RNA <50 Kopien/ml. Quelle: Cahn P
et al, WELBB03
Abb
5SAILING: Optimierte ART plus Dolutegravir vs. plus Raltegravir.
Primärer Endpunkt zu Woche 48 HIV-RNA <50 Kopien/ml. Quelle: Cahn P
et al, WELBB03
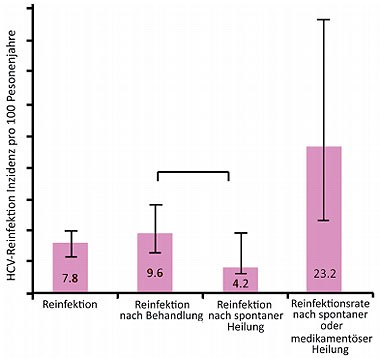 Abb 6HCV-Reinfektionen nach ausgeheilter Hepatitis C bei HIV-positiven MSM in London. Quelle: Martin T et al., TUAB0101
Abb 6HCV-Reinfektionen nach ausgeheilter Hepatitis C bei HIV-positiven MSM in London. Quelle: Martin T et al., TUAB0101
Bei Patienten mit fortgeschrittener Resistenz wird in Zukunft Dolutegravir eine gute Alternative zu Raltegravir sein. Der neue Integrasehemmer war in der Studie SAILING bei 715 Patienten mit mehr als zwei Klassenresistenz in Kombination mit einer optimierten ART Raltegravir signifikant überlegen. Nach 48 Wochen lag die Viruslast bei 71% der Patienten unter Dolutegravir im Vergleich zu 64% unter Raltegravir <50 Kopien/ml. Resistenzentwicklungen gegen den Integrasehemmer waren unter Dolutegravir seltener (1% vs 5%), die Verträglichkeit vergleichbar. Die Nierenfunktion wurde durch Dolutegravir nicht beeinträchtigt. Der leichte Anstieg des Kreatinins geht auf eine Inhibition der Kreatininsekretion durch Blockade des OCT2-Rezeptors zurück (Abb. 5) (Cahn P et al., WELBB03).
Hepatitis C
Zur Tripletherapie wurden von der französischen Arbeitsgruppe ANRS sogenannte „real life“ Daten von HIV/HCV-Koinfizierten vorgestellt. Mit ähnlichen Daten bei Monoinfizierten hatte die Gruppe bei den Hepatologen Furore gemacht, denn die Nebenwirkungsrate war hier insbesondere bei Zirrhotikern deutlich höher als in den Studien. Bei den Koinfizierten scheint das nicht so zu sein. Der Vergleich von 114 Patienten unter Tripletherapie mit 208 Patienten unter konventioneller Behandlung zeigt nach 24 Wochen keine unerwarteten Nebenwirkungen. Zu Woche 24 waren 74% der Telaprevir- und 60% der Boceprevir-Patienten HCV-RNA negativ. Zirrhotiker sprachen schlechter an (60% und 50%). Ein virologisches HCV-Versagen wurde bei 10 Patienten unter Telaprevir und bei vier Patienten unter Boceprevir beobachtet (Poizot-Martin I et al., TUAB0102).
Akute HCV-Infektionen bei HIV-positiven MSM werden mittlerweile in jeder deutschen Großstadt beobachtet. Am Londoner Chelsea and Westminster Hospital wurde analysiert, wie viele Patienten sich nach Ausheilung einer akuten Hepatitis C erneut mit HCV infizierten. In den Jahren 2004 bis 2012 wurden 191 Fälle mit spontan ausgeheilter oder erfolgreich behandelter Hepatitis C dokumentiert. 145 davon hatten im Jahr zuvor negative Antikörper gegen HCV, d.h. es handelte sich um eine akute Hepatitis C. Von diesen 145 MSM infizierten sich im Lauf der Beobachtungszeit von zwei Jahren 32 erneut mit HCV – am häufigsten mit Genotyp 1. 4/27 Reinfektionen heilten von spontan aus, 27 Patienten wurden behandelt. Rechnerisch ergab sich daraus eine Reinfektionsrate von 7,8 pro 100 Personenjahre. Diese ist damit niedriger als die in Amsterdam beobachtete Reinfektionsrate von 15,2 pro 100 Personenjahre (Abb. 6) (Martin T et al., TUAB0101).
Fibroscan zuverlässig
Bislang war die Leberbiopsie und -histologie Leberbiopsie und -histologie Methode der Wahl zur Beurteilung des Schweregrads von Lebererkrankungen. Eine spanische Arbeit zeigt nun, dass der Fibroscan auch bei HIV/HCV-Koinfizierten die Progression der Lebererkrankung vergleichbar gut vorhersagen kann. In der spanischen Studie wurden Daten von Koinfizierten in den Jahren 2005-2011 ausgewertet, bei denen sowohl eine Biopsie als auch ein Fibroscan durchgeführt wurde. 90% der Patienten waren antiretroviral behandelt, hatten Genotyp 1 oder 4. Zwei Drittel hatten eine Hepatitis C-Therapie hinter sich. 27% hatten eine F3 bzw. F4-Fibrose. Insgesamt wurden bei 12 Patienten Aszites, bei vier eine gastrointestinale Blutung und bei zwei eine hepatische Enzephalopathie beobachtet, wobei der Fibroscan insbesondere bei Zirrhose ein besserer Prädiktor war (Macías J et al., TUAB0103).

 Wie mittlerweile gewohnt stand auch bei dieser Tagung die Heilung im Mittelpunkt. Hier geht es in
kleinen Schritten vorwärts. Weitere zentrale Themen waren die neuen WHO-Leitlinien, die einen früheren Therapiestart
empfehlen. Die sofortige Therapie der akuten Infektion könnte sogar zur funktionellen Heilung beitragen.
Wie mittlerweile gewohnt stand auch bei dieser Tagung die Heilung im Mittelpunkt. Hier geht es in
kleinen Schritten vorwärts. Weitere zentrale Themen waren die neuen WHO-Leitlinien, die einen früheren Therapiestart
empfehlen. Die sofortige Therapie der akuten Infektion könnte sogar zur funktionellen Heilung beitragen. 








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
