Sebastian Noe, München
Update Diabetes mellitus
Der Typ-2-Diabetes (T2D) stellt eine enorme gesundheitliche Herausforderung dar. Auch wenn die Datenlage uneinheitlich ist, gibt es Hinweise darauf, dass die Prävalenz des T2D innerhalb der Gruppe HIV-infizierter Patienten unter antiretroviraler Therapie und hier wiederum vor allem bei HIV/HCV-Co-Infizierten noch höher ist als in der Allgemeinbevölkerung.1 Im Folgenden soll daher ein Überblick zu Diagnostik und Therapie des T2D gegeben werden.
In Deutschland sind in der nationalen Versorgungsleitlinie die Empfehlungen von DGAM und DDG/DGIM neben-einander implementiert. Die folgende Zusammenfassung richtet sich dabei im Wesentlichen nach den Empfehlungen der Fachgesellschaften (DDG/DGIM).2
Diagnostik
| Diagnosekriterien des Diabetes mellitus nach 2 | |
|---|---|
| HbA1c: | |
| • HbA1c ≥ 6,5% ( ≥ 48 mmol/mol) | (5,7-6,5% ergänzende Kriterien: s. Plasmaglukose) |
| und/oder | |
| Plasmaglukose: | |
| • Nüchternblutzucker: >125 mg/dl (>6,9 mmol/l) | (100-125 mg/dl sog. „Impaired fasting glucose“, IFG) |
| • 2-Stunden-Wert im oralen Glukosetole- ranztest (75 g): >199 mg/dl (>11,0 mmol/l) | (140-199 mg/dl „gestörte Glukosetoleranz“, IGT) |
| Ein HbA1c im Bereich von 5,7-6,5% schließt das Vorliegen eines Diabetes mellitus nicht aus, hier sollten zusätzliche diagnostische Methoden über die Messung der Plasmaglukose herangezogen werden. Patienten, die die Kriterien einer IFG oder IGT erfüllen, sollten über das Risiko eines Fortschreitens zum T2D aufgeklärt werden. Es sollten eine Beratung zu Ernährung und Lebensstilveränderung (Gewichtsverlust, Raucherentwöhnung, ggf. Anpassung „diabetogener“ Medikamente) sowie weitere Kontrollen erfolgen | |
Tab. 1
Die wohl wichtigste diagnostische Neuerung ist der HbA1c als Diagnosekriterium des Diabetes mellitus. Was heute selbstverständlich ist, hielt erst vor einigen Jahren Einzug in die Empfehlungen der Fachgesellschaften, nachdem dieser „Langzeitblutzuckerwert“ zuvor nur den Stellenwert eines Verlaufsparameters hatte. Die Verwendung des HbA1c ist mittlerweile so implementiert, dass hier noch einmal daran erinnert werden soll, dass selbstverständlich auch Nüchtern- und Gelegenheitsblutzucker sowie oraler Glukosetoleranztest (oGTT) ihre diagnostische Wertigkeit nicht verloren haben und der HbA1c nur eines der verfügbaren Kriterien ist. Insbesondere im Graubereich bei HbA1c Werten zwischen 5,7-6,5% (39 bis <48 mmol/mol) sollten zusätzlich weitere diagnostische Kriterien (Nüchternblutzucker oder pathophysiologisch sinnvoller ein postprandialer Blutzuckerwert, z.B. im oGTT) herangezogen werden (Tab. 1).2
Blutzuckerkontrollsysteme
Das Prinzip der kontinuierlichen Blutzuckermessung (continuous glucose monitoring, CGM) wird bereits seit Jahren verfolgt. Es beruht auf einer im Unterhautfettgewebe platzierten Verweilsonde, die der Patient selbst einbringt und wechselt. Diese misst die Zuckerkonzentration in der Flüssigkeit des Interstitiums in sehr kurzen Abständen (etwa alle 5 Minuten) und kann die Informationen an ein zugehöriges, den konventionellen Messgeräten vergleichbares Gerät weiterleiten. Als problematisch wird hierbei die um ca. 10-20 Minuten verzögerte Anpassung der Zuckerkonzentration im Interstitium gegenüber der Blutglukosekonzentration angesehen. Die „konventionelle“ Blutzuckermessung bleibt dem Patienten allerdings bislang – auch zum Zweck der Kalibrierung des Systems – nicht komplett erspart. Eine Weiterentwicklung sind die sogenannten Flash-Glukose-Messsysteme (flash glucose-monitoring, FGM). Sie funktionieren prinzipiell wie die kontinuierlichen Messgeräte, sind jedoch mit einer Software ausgestattet, die über einen Algorithmus die Zuckerkonzentration der Interstitialflüssigkeit der Blutzuckerkonzentration besser annähert und werks-seitig kalibriert werden kann.
Die Verweildauer der Sonden liegt bei ca. fünf (CGM) bis 14 (FGM) Tagen. Im Juni 2016 stimmte der GBA der Kostenübernahme für CGM-Systeme durch die gesetzlichen Krankenkassen unter bestimmten Umständen für Patienten unter intensivierter Insulintherapie oder Insulinpumpentherapie zu. Auch die FGM-System werden von einigen gesetzlichen Krankenkassen bei Patienten mit Diabetes mellitus Typ 1 übernommen; sie sind allerdings nach wie vor kein Bestandteil der GKV-Regelleistungen.
Orale Diabetestherapie
| therapieziele für Erwachsene mit diabetes mellitus typ 2 (orientierungshilfe) nach 2 |
|---|
| • HbA1c-Korridor: 6,5-7,5% (48-58 mmol/mol) (für ältere Menschen mit hohem Hypoglykämie-Risiko und ausgeprägten Komorbiditäten: 7,5-8,5%) |
| • Nüchtern- und präprandialer Blutzucker: 100-125 mg/dl (5,6-6,9 mmol/l) |
| • LDL-Cholesterin <100 mg/dl (2,6 mmol/l) |
| • Gewichtsabnahme: BMI 27-35 kg/m²: 5% Gewichtsverlust; >35 kg/m²: 10% Gewichtsverlust |
Tab. 2
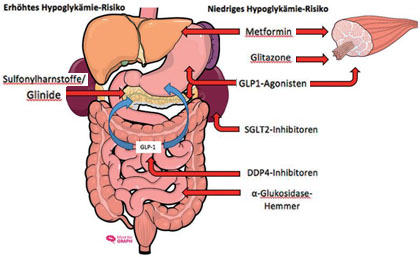
Abb. 1 Übersicht über die (Haupt-)Angriffspunkte der oralen Antidiabetika
| Substanzklasse | Vertreter | Tägliche Dosierung | Bemerkungen |
|---|---|---|---|
| Biguanide | Metformin | 2x 1.000 mg | Prinzipiell kann Metformin bis 3x 1.000 mg angewendet werden, wobei eine weitere Steigerung der Wirkung über 2.000 mg täg- lich kaum zu erwarten ist und praktisch des- halb nicht angewendet wird. DANI, Kontrain- dikation ab GFR <45 ml/min/1,73m² (Gefahr von Laktatazidosen!) |
| Sulfonyl- harnstoffe | Glimepirid (Amaryl®, Glimegamma®) | 1x 1-4 mg | Die empfohlene maximale Tagesdosis von Glimepirid liegt bei 6 mg. Allerdings sind Wirkungssteigerungen bei Dosen >4 mg re- gelhaft nicht zu erwarten. Auch ist in diesen Dosierungen das Hypoglykämierisiko beson- ders zu beachten! DANI. |
| Sulfonyl- harnstoffe | Glibenclamid (Euglucon®, Glibratiopharm, Gliben-CT) | 1x 1,75-7 mg | Die empfohlene maximale Tagesdosis von Glibenclamid liegt bei 10,5 mg einmal täglich, wobei Dosen über meist die Ausnahme 3,5 mg sind. DANI. |
| Glinide | Repaglinid | 0,5-4 mg zu den Hauptmahlzeiten | Die maximale Tagesdosis liegt bei 16 mg. Die Erstattungsfähigkeit ist auf Patienten mit fort- geschrittener Niereninsuffizienz beschränkt. |
| α- Glukosidase- Hemmer | Acarbose (Glucobay®) | 3x 50-100 mg zu Mahlzeiten | Beginn ggf. einschleichend (v.a. bei Kombi- nation mit Metformin) um gastrointestinale Nebenwirkungen zu vermindern; DANI. |
| DDP4-Hemmer | Sitagliptin (Janvia®, Xelevia®) | 1x 100 mg | Als Fixkombination mit Metformin erhältlich (Janumet®, Velmetia®); DANI. |
| DDP4-Hemmer | Saxagliptin (Oglynza®) | 1x 5 mg | Als Fixkombination mit Metformin erhältlich (Komboglyze®); DANI. |
| SGLT2- Hemmer | Empagliflozin (Jardiance®) | 1x 10 mg | „Hinweis auf beträchtlichen Zusatznutzen“ bei Patienten mit hohem kardiovaskulären Risiko; häufig infektiöse Kompliaktionen der ableitenden Harnwege/Genitalien. Steige- rung auf 25 mg meist nicht sinnvoll. Fixkom- bination mit Metformin (Synjardy®). |
| SGLT2- Hemmer | Dapagliflozin (Forxiga®) | 1x 10 mg | Als Fixkombination mit Metformin erhältlich (Xigduo®); DANI |
Tab. 3
Orale Antidiabetika (OAD) werden bereits seit vielen Jahren eingesetzt, doch innerhalb der Gruppe gibt es neue Entwicklungen und Trends. Metformin stellt für die meisten Patienten immer noch die First-Line Therapie dar. Dagegen rücken andere bekannte Vertreter zunehmend in den Hintergrund. Ein gutes Beispiel hierfür sind die Glitazone und die Glinide, die im Wesentlichen nicht mehr zu Lasten der gesetzlichen Krankenkassen verordnet werden können. Ein Grund hierfür dürfte auch die Verfügbarkeit neuer OADs, nämlich der DDP4-Inhibitoren sowie der SGLT2-Inhibitoren darstellen. Therapieziele sind das Vermeiden von symptomatischen Zuckerentgleisungen sowie von Folgeerkrankungen. Der HbA1c-Zielwert ist dabei individuell festzulegen (Vergleiche Tabelle 2).
Metformin
Die langjährige Erfahrung, gute Wirksamkeit und Verfügbarkeit von Studiendaten zu klinischen Endpunkten wie makrovaskulären Komplikationen sorgten dafür, dass Metformin heute Mittel der ersten Wahl für die meisten Patienten mit T2D ist, bei denen keine Kontraindikation oder Unverträglichkeit vorliegt. Günstig ist auch die Tatsache, dass es mit weiteren oralen Antidiabetika (und Insulin) gut kombiniert werden kann.2
Sulfonylharnstoffe
Sulfonylharnstoffe genießen keinen sonderlich guten Ruf, obwohl sie eine der ersten Substanzklassen waren, die zu einer wirklichen Risikoreduktion diabetischer, insbesondere mikrovaskulärer Komplikationen führten. Die zunächst guten Studienergebnisse wurden durch spätere Beobachtungen eingeholt, in denen Patienten unter Sulfonylharnstoffen möglicherweise ein erhöhtes kardiovaskuläres Risiko aufwiesen, was sich nach heutigen Beobachtungen jedoch nicht zweifelsfrei verifizieren lässt.3 Das pathophysiologisch ungünstige Wirkprofil der Substanzen, das Risiko von protrahierten Hypoglykämien sowie die mit der Medikation in Zusammenhang gebrachte Gewichtszunahme haften der Substanzgruppe heute noch an und führten dazu, dass Sulfonylharnstoffe eher ungern eingesetzt werden, aber (auch) aus Kostengründen in den Leitlinien immer noch eine Rolle spielen und als Therapiealternative für Patienten mit Metformin-Unverträglichkeit oder -Kontraindikation angesehen werden.2
α-Glukosidase-Hemmer
Alpha-Glukosidase-Hemmer spielen heute eine untergeordnete Rolle. Gründe hierfür sind die schwache Wirkung auf die Blutzuckerwerte, die fehlende Evidenz zur positiven Beeinflussung klinischer Endpunkte (die allerdings für die meisten oralen Antidiabetika fehlen) sowie ein Nebenwirkungsprofil, welches dem von Metfomin ähnelt und damit in Kombination mit diesem First-Line-Therapeutikum zum vermehrten Auftreten von Beschwerden führt.2
Glitazone
Glitazone werden in Deutschland aktuell nicht mehr von den gesetzlichen Krankenkassen erstattet und spielen daher kaum mehr eine Rolle.2
Glinide
Im Juli 2016 wurde ein bereits 2010 gefasster Beschluss zur Verordnungseinschränkung der Glinide in Deutschland umgesetzt; nur noch Repaglinid ist bei Patienten mit fortgeschrittener Niereninsuffizienz erstattungsfähig, womit auch Glinide de-facto ihre Bedeutung nahezu verloren haben.
DDP4-Inhibitoren
Dipeptidylpeptidase 4 (DDP4)-Inhibitoren verhindern den Abbau von Inkretinen, dessen bekanntester Vertreter das Glukagon-like Peptid 1 (GLP-1) ist. Sie wirken damit über einen indirekten Mechanismus vergleichbar den GLP-1 Agonisten (siehe dort), indem sie die Wirkung des endogenen GLP-1 verstärken. Die Wirkung ist Glukose-abhängig, was erklärt, dass sie kein intrinsisches Hypoglykämie-Risiko aufweisen. In vielen Fällen sind die DDP4-Inhibitoren heute der erste Kombinationspartner von Metformin in der Sequenz der OADs geworden, wohl auch, weil diese Kombination als Fixkombination erhältlich ist.
SGLT2-Inhibitoren
Sodium dependent glucose transporter (SLGT2)-Inhibitoren oder Gliflozine sind die neueste Substanzgruppe im diabetologischen Therapiespektrum der OADs. Der Wirkmechanismus beruht auf einer Hemmung der Glukoserückresorption in der Niere, wodurch es zu vermehrter Glukoseausscheidung durch Glukosurie kommt. Die tägliche ausgeschiedene Zuckermenge beträgt dabei bis zu 70 g (ca. 280 kcal).4 Da der Mechanismus unabhängig von Insulin und Insulinresistenz ist, besteht keine relevant erhöhte Hypoglykämie-Gefahr. Es kommt allerdings häufiger zu Harnwegs- und Genitalinfekten. Die beiden in Deutschland verfügbaren SGLT2-Hemmer scheinen nicht relevant mit CYP450-Isoenzymen oder UGT1A1 zu interagieren.4
Die mit der Glukosurie verbundene osmotische Diurese ist möglicherweise ein Grund für die in der EMPA-REG Studie erstmalig beobachtete, deutliche kardiovaskuläre Risikoreduktion.5 Dies führte dazu, dass Empagliflozin mittlerweile durch den GBA ein „Anhalt für einen beträchtlichen Zusatznutzen“ für Patienten mit kardiovaskulären Vorerkrankungen zugesprochen wurde.6 In Anbetracht des Zusatznutzens und der Preise der SGLT2-Inhibitoren, die zum Teil unter denen der DDP4-Hemmer liegen, könnte es sein, dass zumindest in der Subgruppe der kardiovaskulären (Hoch-)Risikopatienten zukünftig häufiger primär SGLT2-Inhibitoren als Kombinationspartner von Metformin eingesetzt werden.
GLP1-Agonisten
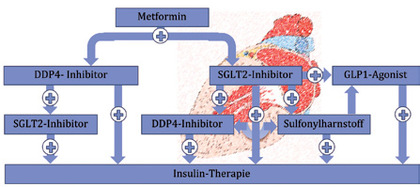 Abb.2
Abb.2
Ein Entscheidungsbaum für Patienten mit normaler Nierenfunktion wie er anhand der verfügbaren Leitlinien und der aktuellen Studienlage aktuell aussehen könnte. Dabei scheinen SGLT-2 Hemmer (nach aktueller Studienlage namentlich Empagliflozin (Jardiance®)) vor allem für Patienten mit hohem kardiovaskulären Risiko der primäre Kombinationspartner der Wahl für Metformin.
Die GLP-1 Agonisten als Gruppe haben einen direkten Effekt auf die Insulinfreisetzung, die Glukose-abhängig verstärkt wird, sowie indirekt positive Effekte wie z.B. eine verzögerte Magenentleerung, frühes Sättigungsgefühl, Hemmung der Glukagon-Sekretion und Hemmung des Appetits. Viele Patienten schildern vor allem zu Beginn der Therapie ausgeprägte Übelkeit, was möglicherweise einen relevanten Beitrag zum Gewichtsverlust leistet, der häufig initial beobachtet wird. Auch diese Substanzgruppe besitzt kein intrinsisches Hypoglykämie-Risiko.2 GLP1-Agonisten sind aktuell die teuersten Substanzen in der Therapie des T2D.
Insuline
Die Insulintherapie ist in ihren Grundzügen seit Jahren unverändert und kann je nach Bedürfnis ergänzend zu oralen Antidiabetika oder GLP1-Agonisten mittels Langzeit-Insulin (Basal-unterstütze orale Therapie, BOT) oder Prandial-Insulin (Supplementäre Inulintherapie, SIT) erfolgen oder (mit und ohne Kombination oraler Antidiabetika) als konventionelle Insulintherapie mit Mischinsulin bzw. intensivierte Insulintherapie mit individuellem Basis-Bolus-Konzept.
Eine
„neuere“ Entwicklung in der Insulintherapie ist die Verwendung
von Insulinen mit einer höheren Konzentration als die üblichen 100
I.E./ml. Dies führt – unabhängig vom verwendeten Insulin – zu
einer Reduktion des zu injizierenden Volumens. Die unmittelbaren
Vorteile sind dabei, dass bei hohen Mengen Prandial-Insulin eine
Dosis-Teilung vermieden werden kann und bei Langzeit-Insulinen ein
„glatteres“ Wirkprofil mit längerer Wirkdauer erreicht wird.
Ferner sind auch die geringe Zuzahlung und das Mitführen weniger
Insulin-Pens (z.B. auf Reisen) für den Patienten von Vorteil.
| Praktische Hinweise zur wirtschaftlichen Verordnung |
|---|
| • Zum Beginn einer Pharmakotherapie soll der ausgebliebene Erfolg der nicht-pharma- kologischen Basistherapie dokumentiert werden. Alternativ können, möchte man gleich mit einer Pharmakotherapie beginnen, die Gründe dokumentiert werden, die einen Erfolg einer alleinigen Basistherapie unwahrscheinlich machen. |
| • Aus Gründen des günstigen Kosten-Nutzen-Risikos sollte Metformin nach Ausschluss von Kontraindikationen das Medikament der ersten Wahl sein. |
| • Antidiabetika unterliegen einer Generika-Quote, wobei DDP4-Hemmer, SGLT2-Inhibitoren und GLP1-Agonisten nicht generisch verfügbar sind, was bei der Verordnung von neu- eren Substanzgruppen ein gewisses Grundproblem hinsichtlich der Wirtschaftlichkeit mit sich bringt. Zu beachten ist auch, dass z.B. eine Fixkombination mit Metformin und DDP4-Hemmer immer als „Originalpräparat“ in die Statistik einfließt, während eine sepa- rate Verordnung in Metformin und DDP4-Hemmer eine 50%ige generische Verordnung (gleichzeitig aber mehr Tabletten und höhere Zuzahlung für den Patienten) bedeutet. |
| • Nach aktuellem Stand gibt es für alle verfügbaren Insuline Rabattverträge mit den Krankenkassen. |
Tab. 4
| Substanz(klasse) | Hypogly- kämie-risiko | HbA1c- Senkung | Gewichtsver- änderung | Tagestherapie- kosten |
|---|---|---|---|---|
| Metformin8,9 | - | 1,0-1,5% | - 2,20 kg | 0,21€ |
| Acarbose9,10 | - | ca. 0,7% | -0,13 kg | 1,00€ |
| Sulfonylharnstoffe11 | + | 1,0-2,0% | +2,80 kg | 0,23€ |
| Glitazone12,13 | - | 1,0-1,6% | +3,10 kg | 1,60€ |
| Glinide14,15 | + | 0,7-2,0% | + ?? kg | 1,80€ |
| DDP4-Hemmer14,15 | - | 0,6-1,0% | ± 0,0 kg | 1,57€ |
| SGLT2-Hemmer4 | - | 0,7-0,9% | - 2,20 kg | 1,18€ |
| GLP1-Agonisten16 | - | 0,5-1,0% | - 3,50 kg | 3,62€ |
Tab.5
Bei der Rezeptierung ist bei höher-konzentrierten Prandial-Insulinen die Verordnungseinschränkung in Abhängigkeit der täglichen Insulin-Gesamtdosis zu beachten. Bei Basalinsulinen sollte man berücksichtigen, dass bei niedrigem Insulinbedarf der angebrochene Pen u.U. nicht vollständig verbraucht werden kann, bevor das Ende der Haltbarkeitszeit nach Anbruch erreicht wird. Beim Toujeo® Solostar® Fertigpen wurde erst kürzlich einer Erweiterung der Haltbarkeit nach Anbruch von 4 auf 6 Wochen zugestimmt, womit ein täglicher Basal-Insulinbedarf von nur noch ca. 11 I.E. erreicht sein muss, um das Präparat innerhalb der Haltbarkeitsdauer vollständig aufzubrauchen (Tab. 4 und 5).
Orale antidiabetische Therapie bei HIV-infizierten Patienten
Grundsätzlich gilt, dass bei HIV-Patienten ähnlich wie bei HIV-Negativen Therapieziel und Medikation gemäß den Leitlinien unter Berücksichtigung von Alter, Komorbidität, usw. festgelegt werden. Auch bei HIV infizierten Patienten darf die Therapie mit Metformin – Fehlen von Kontraindikationen vorausgesetzt – als medikamentöse Therapie der ersten Wahl angesehen werden. Theoretisch bestehende Bedenken in der Kombination mit Substanzen, die eine ähnliche Elimination aufweisen (Dolutegravir (DTG), Elvitegravir (EVG/r)) scheinen praktisch wenig relevant. Da Daten in größerem Umfang fehlen, ist die Kombination aus DTG 50 mg zweimal täglich mit Metformin aktuell nicht zu empfehlen. Pharmakokinetische Daten zur gleichzeitigen Anwendung von Elvitegravir/r und Metformin fehlen.
Bei einer normalen Nierenfunktion dürfte der Meformin-Spiegel bei gleichzeitiger Gabe von 50 mg DTG bzw. EVG/r selbst bei der in der Praxis angestrebten täglichen Dosis von 2.000 mg deutlich unterhalb des Spiegels bei der Tagesmaximaldosis von 3.000 mg liegen, so dass bei normaler Nierenfunktion keine toxische Akkumulation zu befürchten ist. Pharmakinetische Daten zu dieser Metformin-Dosierung fehlen allerdings. In dieser Konstellation sollte man allerdings die Kontraindikationen von Metformin vor allem der Nierenfunktion genau beachten. Spätestens bei einer Nierenfunktion mit einer GFR <45 ml/min/1,73 m² muss eine bestehende Metformin-Therapie beendet werden. Ob im Bereich einer GFR von 45-59 ml/min/1,73 m² die vorgesehene Dosisreduktion auf maximal 1.000 mg Metformin täglich (2x 500 mg) ausreichend ist, ist unklar. In den USA wird eine generelle Dosisbegrenzung auf 1.000 mg Metformin täglich bei Co-Administration von DTG und EVG auch bei normaler Nierenfunktion empfohlen.
Für Patienten unter Proteaseihibitoren, Ritonavir oder Cobicistat muss beim Einsatz von Sulfonylharnstoffen beachtet werden, dass es wenige Daten zur Interaktion gibt. Ein Anstieg der Sulfonylharnstoffkonzentration im Blut ist nicht auszuschließen, was mit einer erhöhten Hypoglykämie-Risiko einher gehen könnte.
Unter Inkretin-basierten Therapien (also GLP1-Inhibitoren und DDP4-Hemmern) ist ein erhöhtes Risiko für Pankreatitiden beschrieben wurde. Daher sollte der Einsatz dieser Substanzgruppen bei Patienten mit Risikofaktoren mit Hinblick auf mögliche Alternativen überdacht werden. Insgesamt bleibt das absolute individuelle Risiko jedoch auch bei Anwendung dieser Substanzen gering.7
Für Patienten mit hohem kardiovaskulären Risiko scheint die Kombination mit einem SGLT2-Hemmer (Datenlage zu Empagliflozin, weitere Studienergebnisse ausstehend) empfehlenswert.
Orale Dreifachtherapien werden in den Leitlinien der DDG/DGIM nicht regelhaft vorgesehen, können bei einigen Patienten aber durchaus in Betracht gezogen werden, da mittlerweile auch eine Polypharmakotherapie ohne deutlich erhöhtes Hypoglykämierisiko möglich ist.
Auch das potentiell diabetogene Potential der ART ist zu berücksichtigen. Obwohl Hyperglykämien unter fast allen Substanzgruppen beobachtet werden, scheinen allenfalls die unter geboosterten PIs beschriebenen Stoffwechselveränderungen, die auch für Diabetiker ungünstige Einflüsse auf den Fettstoffwechsel umfassen, relevant. Selbst hier ist die Diskussion allerdings nach wie vor kontrovers.
1 Brown, T.T., et al., Antiretroviral therapy and the prevalence and incidence of diabetes mellitus in the multicenter AIDS cohort study. Arch Intern Med, 2005. 165(10): p. 1179-84.
2 Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Therapie des Typ-2-Diabetes – Langfassung, 1. Auflage. Version 4. 2013, zuletzt geändert: November 2014. Available from: www.dm-therapie.versorgungsleitlinien.de; DOI: 10.6101/AZQ/000213.
3 Rados, D.V., et al., Correction: The Association between Sulfonylurea Use and All-Cause and Cardiovascular Mortality: A Meta-Analysis with Trial Sequential Analysis of Randomized Clinical Trials. PLoS Med, 2016. 13(6): p. e1002091.
4 Bojunga, J., SGLT2-Inhibitoren: Eine neue Substanzklasse zur Behandlung des Typ-2-Diabetes. Arzneimittelsicherheit, 2015. 33: p. 137-45.
5 Zinman, B., et al., Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med, 2015. 373(22): p. 2117-28.
6 Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Empagliflozin, Gemeinsamer_Bundesausschuss, Editor. 2016.
7 Roshanov, P.S. and B.B. Dennis, Incretin-based therapies are associated with acute pancreatitis: Meta-analysis of large randomized controlled trials. Diabetes Res Clin Pract, 2015. 110(3): p. e13-7.
8 Umpierrez, G., et al., Efficacy and safety of dulaglutide monotherapy versus metformin in type 2 diabetes in a randomized controlled trial (AWARD-3). Diabetes Care, 2014. 37(8): p. 2168-76.
9 Gu, S., et al., Comparison of glucose lowering effect of metformin and acarbose in type 2 diabetes mellitus: a meta-analysis. PLoS One, 2015. 10(5): p. e0126704.
10 van de Laar, F.A., et al., Alpha-glucosidase inhibitors for patients with type 2 diabetes: results from a Cochrane systematic review and meta-analysis. Diabetes Care, 2005. 28(1): p. 154-63.
11 Hermann, L.S., et al., Therapeutic comparison of metformin and sulfonylurea, alone and in various combinations. A double-blind controlled study. Diabetes Care, 1994. 17(10): p. 1100-9.
12 Aronoff, S., et al., Pioglitazone hydrochloride monotherapy improves glycemic control in the treatment of patients with type 2 diabetes: a 6-month randomized placebo-controlled dose-response study. The Pioglitazone 001 Study Group. Diabetes Care, 2000. 23(11): p. 1605-11.
13 Basu, A., et al., Effects of pioglitazone versus glipizide on body fat distribution, body water content, and hemodynamics in type 2 diabetes. Diabetes Care, 2006. 29(3): p. 510-4.
14 Stein, S.A., E.M. Lamos, and S.N. Davis, A review of the efficacy and safety of oral antidiabetic drugs. Expert Opin Drug Saf, 2013. 12(2): p. 153-75.
15 Dicker, D., DPP-4 inhibitors: impact on glycemic control and cardiovascular risk factors. Diabetes Care, 2011. 34 Suppl 2: p. S276-8.
16 Shyangdan, D.S., et al., Glucagon-like peptide analogues for type 2 diabetes mellitus. Cochrane Database Syst Rev, 2011(10): p. CD006423.