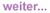Christoph Stephan, Frankfurt
Long-Acting-Medikamente: Option für die PrEP
Die HIV-Präexpositionsprophylaxe (PrEP) mit der fix-dosierten Medikamenten-Kombinationstablette Tenofovir Disoproxil/Emtricitabine (TDF/FTC) ist derzeit die einzige zugelassene und studienerprobte Behandlung für Menschen mit einem hohen Risiko für eine HIV-Infektion. Weil „alternativlose Optionen“ immer schlecht sind, ist eine Alternative für die PrEP grundsätzlich begrüßenswert und die „Long-Acting“ (LA)-Medikamente könnten eine interessante Option sein. So könnte z.B. eine alle 8 Wochen zu injizierende PrEP eine gute Möglichkeit für ein Kollektiv sein, das normalerweise nicht gewohnt ist, regelmäßig Tabletten einzunehmen bzw. Schwierigkeiten mit Medikamententreue hat. Möglicher Nachteil der zu injizierenden PrEP ist der hohe Grad ärztlicher Anbindung ansonsten Gesunder, wenn der Patient das nicht selbst machen kann, z.B. im Fall einer intramuskulären Spritze.
Cabotegravir LA
Auf dem Welt-AIDS-Kongress, der dieses Jahr als virtuelle Konferenz stattfand, wurde (endlich) eine Alternative zu TDF/FTC präsentiert: Der Integrase-Inhibitor Cabotegravir, der alle 8 Wochen als Spritze appliziert wird, zeigte die Nichtunterlegenheit (und damit vergleichbar gute Wirksamkeit) im Vergleich zum PrEP-Standard TDF/TFC.
Die Studie wurde an Männern und Transgender-Frauen, die Sex mit Männern haben, untersucht und schützte mindestens so zuverlässig vor einer HIV-Infektion wie der TDF/FTC, was als Tablette üblicherweise täglich eingenommen wird, alternativ auch „on demand“ (d.h. bedarfsorientiert kurzzeitig). Die vorzeitig entblindete Studie HPTN-083 verglich beide Therapieformen miteinander: Cabotegravir-LA und die Tablette TDF/FTC.1 Der injizierbare Integrase-Inhibitor Cabotegravir wird für die HIV-Therapie voraussichtlich in wenigen Wochen zugelassen, allerdings in Kombination mit dem LA Rilpivirin als vollwertige duale ART-Kombination und nicht zur PrEP.
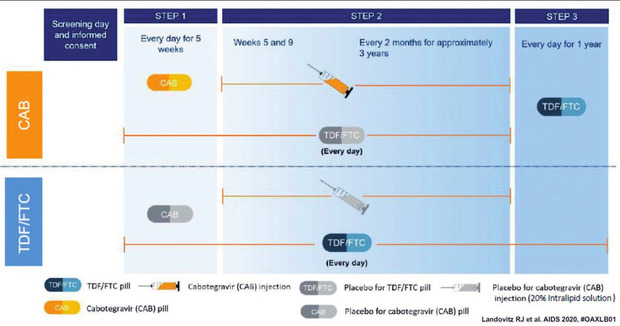
Abb 1 Studiendesign der HPTN-083-Studie
Vorzeitige Entblindung
An der randomisierten, doppelt verblindeten Studie HPTN 083 nehmen seit Ende 2016 insgesamt über 4.500 Männer und Transgender-Frauen teil, geplant waren 5.000. Die Zusammensetzung der Teilnehmer ist repräsentativ für Gruppen mit hohem Risiko für eine HIV-Infektion. Sie bekamen entweder die tägliche Tabletten-PrEP mit TDF/FTC und eine Placebo-Spritze, oder die Spritze mit langwirksamem Cabotegravir und Placebo-Tabletten.
Die Verblindung der Studie wurde im Mai 2020 (auch von Corona getrieben) vorzeitig aufgehoben.
Insgesamt traten im Studienverlauf (6.389 Patientenjahre) 52 HIV-Infektionen auf, 39 im TDF/FTC-Studienarm und 13 unter Cabotegravir (Hazard Ratio 0.34, 95% KI 0.18, 0.62; p=0.0005). Die durchschnittliche Infektionsrate für beide Gruppen gemeinsam lag allerdings unter 1%, was die Effektivität beider Behandlungsansätze belegt.
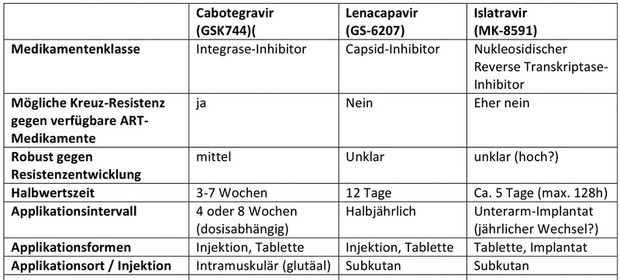
Tab 1 Vergleich pharmakologischer Charakteristika für drei moderne, noch nicht zugelassene, Long-Acting-Medikamente als mögliche Therapie-Optionen für die PrEP (Quelle: NATAP)
Infektion unter PrEP?
Nach der vorläufigen Analyse und Studien-Präsentation ist allerdings noch unklar, warum es in beiden Gruppen zu „Durchbruchinfektionen“ kam. Hinweise auf eine schlechtere Medikamentenadhärenz als Grund für die Infektionen lassen sich derzeit nicht finden. Bei den 13 HIV-Infektionen unter Cabotegravir stellt sich die Frage, ob eine Integraseinhibitor-assoziierte Resistenz der Grund für eine solche Übertragung sein könnte. Eine Integraseinhibitor-Resistenz in der Community ist allerdings selten, was diese Ursache unwahrscheinlich macht. Auch ist Prinzip von Cabotegravir als einzigem Wirkstoff zur PrEP grundsätzlich konsequent, da die prä-Expositionsprophylaxe regulär mit weniger antiretroviralen Medikamenten auszukommen scheint als die post-Expositionsprophylaxe oder vollwertige HIV-Therapie.
Wichtig: Verträglichkeit
Cabotegravir wird intramuskulär (intraglutäal) gespritzt
Unerwünschte Wirkungen sind bei der PrEP von großer Bedeutung. Die Nebenwirkungen der PrEP-Spritze mit Cabotegravir wurden in der Präsentation der HPTN-083-StudIe auch beleuchtet, in einem Punkt allerdings nahm Raphael Landovitz eine frühere Aussage zurück: Entgegen der Publikation der Phase 2-Studie (HPTN-077), deren primärer Endpunkt gar nicht die Gewichtszunahme war und die mit nur etwas mehr als 100 Patienten durchgeführt wurde2, ist nun die unerwünschte Gewichtszunahme in der Cabotegravir-Gruppe signifikant höher. Diese Langzeitnebenwirkung der Integraseinhibitoren ist mittlerweile bekannt und dürfte für das Kollektiv, das die PrEP einnehmen soll, ein Problem darstellen. Die Praktikabilität dieser PrEP-Form wird sich daher außerhalb der Studiensituation noch beweisen müssen.
Lenacapavir (GS-6207)
Diese Substanz ist der erste Vertreter aus der neuen Gruppe der Capsid-Inhibitoren („first-in-class“). Der Eingriff in den Lebenszyklus von HIV geschieht spät, wenn sich das Virus nach Durchlaufen der intrazellulären Replikation bereits wieder extrazellulär aufhält und das Viruskapsid im Ausreifungsprozess formiert. Die Schädigung der Kapsidformation lässt ein nicht infektionsfähiges Virus zurück.
Die Substanz ist interessant für die antiretrovirale Therapie wegen der hohen antiviralen Potenz – relativ unabhängig von Subtypen3 und vorhandenen (erworbenen) HIV-Resistenzmutationen gegen andere ART-Substanzklassen. Sie ist aber auch interessant für die PrEP aufgrund der pharmakologischen Eigenschaften: Ultralange Eliminations-Halbwertszeit (12 Tage!) und einfache Applikationsform (subkutane Injektion). Subkutan spritzen können die Patienten selbst lernen, allerdings erfolgt die Administration in Therapiestudien nach oraler Einleitungsphase nur halbjährlich.4
Islatravir (MK-8591)
Der neue nukleosidische Reverse-Transcriptase-Inhibitor (nRTI ), der bereits in der klinischen Entwicklung geprüft wird, ist charakterisiert durch einen neuen, dualen Wirkmechanismus: Erstens Kettenabbruch (Translokationsblockade) im Schritt der reversen Transkription von viraler RNA zu DNA sowie zweitens verzögerter Kettenabbruch nach Inkorporation und Veränderung der DNA-Struktur.
Charakteristisch für Islatravir ist die lange Halbwertszeit (ca. 120 Stunden = 5 Tage!), die zum Einsatz als Long-Acting-Substanz qualifiziert. Es ist aber auch die seltene orale Einnahme möglich. Außerdem scheint Islatravir eine hohe antivirale Potenz aufzuweisen. In Studien mit einer oralen „Mini-Dosierung“ von täglich 0,25 mg waren quasi nebenbefundlich im Steady-State wirksame Rektal- und Vaginal-Gewebespiegel messbar.5
Ibalizumab (Trogarzo®)
Der monoklonale Antikörper ist als Entry-Inhibitor lange wirksam und wird ausschließlich parenteral angewandt. Zielstruktur ist die Blockade der extrazellulären Domäne des menschlichen CD4-Rezeptors und verwehrt somit HIV den Zugang in die CD4-Zelle. Zum Einsatz im Rahmen der PrEP fehlen nicht nur klinische Daten. Zwei Charakteristika schließen das bereits zur Salvage-Therapie zugelassene Medikament als realistischen Kandidaten für die PrEP aus (auch für den off-Label-Gebrauch):
- Mögliche Resistenzentwicklung unter alleiniger Ibalizumab-Behandlung – so wurden Änderungen der variablen Gen-Region V5 beobachtet, die das HIV-1-Hüll-Glykoprotein 120 exprimiert6,7 und
- Der hohe Preis (Trogarzo® 800 mg i.v. alle 14 Tage) ca. 118.000 U$ pro Jahr.
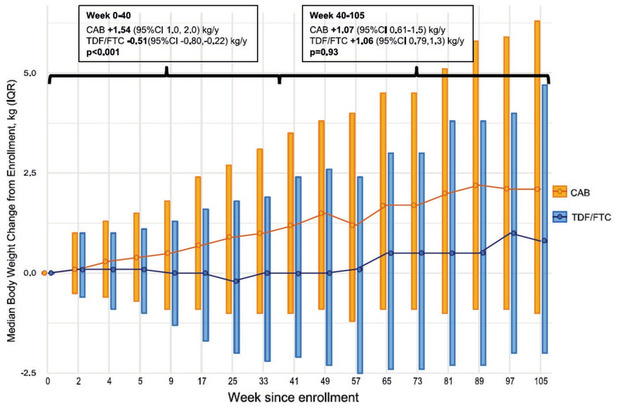
B
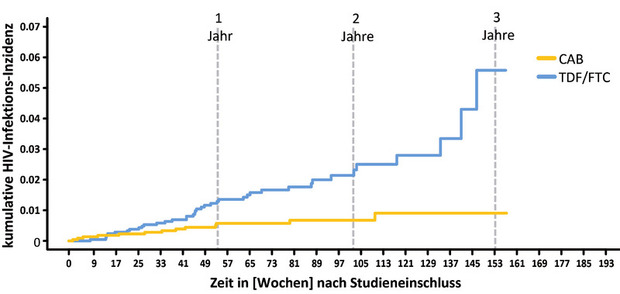
Abb 2 Die wesentlichen Ergebnisunterschiede in der HPTN 083-Studie – bei PrEP-Behandelten mit hohem HIV-Infektionsrisiko, die randomisiert und verblindet entweder alle 8 Wochen eine Cabotegravir-Injektion (gelb) oder täglich eine TenofovirDF/Emtricitabin-Tablette (blau) erhielten
Tafel A zeigt die kumulative Inzidenz der HIV-Infektion beider Studienarme – nach ca. einem Jahr trennen sich die Arme hinsichtlich der HIV-Infektionen, mit einer etwas ungünstigeren HIV-Inzidenz für die täglich einzunehmende PrEP mit TDF/FTC. Dieser Unterschied ist signifikant zwischen beiden Gruppen (Hazard Ratio: 0.34, 95% Konfidenzintervall = 0.18-0.62; P = 0.0005), insgesamt zeigte sich zum Zeitpunkt „Woche 96“ in beiden Armen zusammen eine HIV-Infektionsinzidenz von <1%
Tafel B zeigt die Gewichtsentwicklung der Patienten beider Studienarme, ab Beginn (Wochen 0 – 105). Auch hier sieht man ein Auseinanderdriften beider Gruppen – die Cabotegravir behandelten nehmen durchschnittlich über den Zeitraum kontinuierlich zu, nach 105 Wochen im Median 2 Kilo Körpergewicht, wohingegen die Gruppe der mit TDF/FTC behandelten eine relativ konstante Gewichtsentwicklung aufwiesen. Auch dieser Unterschied zwischen beiden Gruppen ist über den Gesamtzeitraum hochsignifikant (p<0.001)
1 Raphael J. Landovitz, on behalf of the HPTN 083 Study Team. HPTN 083 FINAL RESULTS: Pre-exposure Prophylaxis containing long-acting injectable cabotegravir is safe and highly effective for cisgender men and transgender women who have sex with men. AIDS 2020, #OAXLB01
2 Ladovitz RJ, Zangeneh SZ, Chau G, Grinsztejn B, Eron JJ, Dawood H, Magnus M, Liu AY, Panchia R, Hosseinipour MC, Kofron R, Margolis DA, Rinehart A, Adeyeye A, Burns D, McCauley M, Cohen MS, Currier JS. Cabotegravir Is Not Associated With Weight Gain in Human Immunodeficiency Virus-uninfected Individuals in HPTN 077. Clin Infect Dis. 2020 Jan 2;70(2):319-322
3 Perrier M, Bertine M, Le Hingrat Q et al. Prevalence of gag mutations associated with in vitro resistance to capsid inhibitor GS-CA1 in HIV-1 antiretroviral-naïve patients. JAC 2017;72:2954-5
4 ClinicalTrials.gov - Identifier: NCT04150068
5 Matthews RP, et al. Multiple daily doses of MK-8591 are expected to suppress HIV. In: Program and abstracts of the 2018 Conference on Retroviruses and Opportunistic Infections; March 4-7, 2018; Boston, MA, USA. Abstract 26. Foundation for Retrovirology and Human Health, Alexandria, VA, USA
6 Jacobson JM, Kuritzkes DR , Godofsky E, et al. Safety, Pharmacokinetics, and Antiretroviral Activity of Multiple Doses of Ibalizumab (Formerly TNX-355), an Anti-CD 4 Monoclonal Antibody, in Human Immunodeficiency Virus Type 1-Infected Adults. Antimicrob Agents Chemother 2009; 53(2): 450-7
7 Bruno CJ, Jacobson JM. Ibalizumab: an anti-CD 4 monoclonal antibody for the treatment of HIV -1 infection. J Antimicrob Chemother. 2010 Sep; 65(9):1839-41