Ulrich Seybold, München
Kasuistik: Fostemsavir bei einem „Erwachsenen mit multiresistenter HIV-1-Infektion“
Der Zulassungstext schränkt die Anwendung auch dramatisch ein: „Rukobia® ist in Kombination mit anderen antiretroviralen Arzneimitteln für die Behandlung von Erwachsenen mit multiresistenter HIV-1-Infektion indiziert, für die kein anderes supprimierendes, antiretrovirales Behandlungsregime zur Verfügung steht“.1
Über Aspekte wie „Ultima Ratio“, „Panresistent“ oder gar „Austherapiert“ müssen wir als HIV-Behandler*innen 2021 erfreulicherweise nur noch selten nachdenken. Der aktuelle Zulassungstext und die zugrundeliegende (mittlerweile beendete) BRIGHTE-Studie2 bieten aber einen Anlass, den Blick auf die Menschen zu richten, für die noch bei Studienbeginn 2015 „kein anderes Behandlungsregime“ die bittere Realität war.
Anfang der 2010er-Jahre betreuten wir in unserer Ambulanz drei Patienten mit damals panresistenter HIV-Infektion, für die wir trotz z.T. sehr belastender Vielfach-Kombinationstherapien keine relevante Senkung der Plasmaviruslast (VL) mehr erreichen konnten. Der älteste dieser Patienten verstarb 2012 Mitte 50jährig nach langer Leidensgeschichte an AIDS (panresistente Soor- und CMV-Ösophagitis, Wasting, cerebrale Toxoplasmose). Die beiden jüngeren Patienten konnten wir noch – mit bereits desolatem Immunstatus – in die 2015 beginnende BRIGHTE-Studie einschließen: „A Multi-Arm, Phase 3, Randomised, Placebo-Controlled, Double-Blind Clinical Trial to Investigate the Efficacy and Safety of Fostemsavir in Heavily Treatment-Experienced Subjects Infected with Multi-Drug-Resistant HIV-1“. Da für beide neben FTR auch noch das seit 2014 verfügbare Dolutegravir (DTG) als aktive Substanz einsetzbar war, zählten sie zur „Randomisierten Kohorte“. In dieser Gruppe ging der neu zusammengestellten cART eine 8-tägige Monotherapiephase mit FTR vs. Placebo vor.
Therapieverlauf
Zur Veranschaulichung dieser Therapiesituation soll der Verlauf des Patienten mit den weniger komplexen Begleiterkrankungen kurz skizziert werden. Die HIV-Resistenzsituation ist in der Tabelle, der Verlauf seiner CD4-Helferzellen und VL sowie die eingesetzten Substanzen sind in der Abbildung dargestellt.
Die HIV-Infektion wurde 1984 im Alter von gut 20 Jahren festgestellt und über die Jahre in mehreren Praxen mit diversen Therapieschemata behandelt. Seit den 2000er-Jahren waren eine Reihe von AIDS-definierenden und HIV-assoziierten Erkrankungen aufgetreten, u.a. eine CMV-Retinitis mit Verlust eines Auges, rezidivierende Pneumonien/Pneumonitiden mit Nachweis von CMV und Adenovirus, immer wieder Mundsoor und Soorösophagitis mit z.T. resistenten Candida-Stämmen, eine schwere Zosterepisode mit ausgeprägter Post-Zoster Neuralgie und v.a. einer VZV-/EBV-Encephalitis mit länger persistierender Facialisparese, eine generalisierte M. avium-Infektion mit Knochenmarksbefall und Bakteriämie, chronisch rezidivierende Diarrhoen, hartnäckig rezidivierende anale intraepitheliale Neoplasien bis Grad III, Mollusca contagiosa. Immer wieder schwer beeinträchtigt wurde er durch eine sensible peripher betonte schmerzhafte Polyneuropathie (PNP).
Ein Versuch mit Etravirin (ETR) musste 2007 aufgrund eines massiven Exanthems mit Schleimhaut-Beteiligung umgehend beendet werden, so dass jeweils sofort nach Verfügbarkeit zuerst Maraviroc (MVC) und Raltegravir (RAL) zur nicht ausreichenden Kombination aus Hochdosis-Darunavir/Ritonavir (HD-DRVr) und Tenofovir-DF/Emtricitabin (TDF/FTC) hinzugenommen wurden. Unter RAL entwickelte sich erneut ein (Immunrekonstitutions-)Exanthem, das allerdings mit Steroidgabe kontrolliert werden konnte. Der resultierende Steroiddiabetes sistierte nach Ausschleichen. In enger Kooperation mit der Universitätshautklinik zur allergologischen Abklärung einer möglichen ETR-Allergie inkl. Lymphozyten-Transformations-Testung mit der vom Hersteller zur Verfügung gestellten Substanz erfolgte die stationäre Reexposition von ETR. In der Folge ließ sich die Viruslast durch die Kombination TDF/FTC, ETR, DRV/RTV, MVC für etwas mehr als zwei Jahre supprimieren.
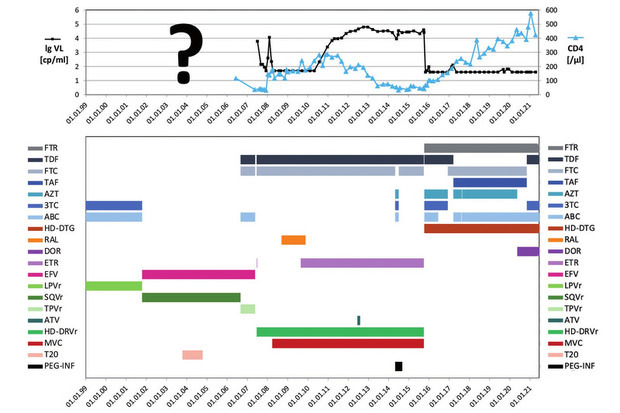
Abb 1 Behandlungsverlauf seit 1999
Panresistenz
Die nach in der zweiten Jahreshälfte 2010 aufgrund erneut ansteigender VL erfolgten genotypischen Resistenzuntersuchungen bestätigten dann aber das Vorliegen einer (damals) panresistenten Viruspopulation. In der Hoffnung auf zumindest Reduktion der Virusreplikation wurde die Behandlung aber fortgesetzt. Außerdem willigte er in zusätzliche Therapieversuche mit Doppel-Proteaseinhibitor (DRV+Atazanavir (ATV) – VL unverändert) sowie einer 4-fach nukleosidische Reverse Transkriptase Inhibitor (NRTI)-Kombination mit TDF, Zidovudin (AZT), Lamivudin (3TC), Abacavir (ABC) und zusätzlich Peginterferon (PEG-INF) ( – VL unverändert und belastende Nebenwirkungen) ein.
| Tropismustestung | |
|---|---|
| 02/2008 | Sequenzanalyse V3-Loop: CCR5 |
| 07/2015 | Phänotypische Analyse (Tropotype): CXCR4 |
| Phänotypische Resistenztestung bzgl. Enfuvirtid | |
| 07/2015 | Phenosense T20: Fold change 88 (99. Perzentile) |
| Bis 2015 identifizierte Mutationen von Reverse Transkriptase, Protease, Integrase | |
| Reverse Transkriptase | I2FIL P4APST K11R E29Q V35I T39A T58N A62V S68G T69I V75I F77L L100I K103N Y115F F116Y V118I K122E I135T Q151M V179L Y181C M184V T200EK I202V L210F F214L K219E H221Y L228Q D237N V245T W252R |
| Protease | L10I V11I T12P I13V K14R I15V K20R V32I L33F E34A E35D M36I N37T R41K M46I I54LV K55R Q58E D60E Q61E L63P I66VA71V I72T G73T V82A I84V I85V R87K N88H L90M I93L C95CVW |
| Integrase | N155H |
Tab 1 Ergebnisse der Resistenztestung
Die CD4-Helferzellen sanken bis 2015 von 200-300/µl auf ein Niveau um 50/µl. Subjektiv stand für den Patienten ein allgemeines Schwächegefühl mit fehlender körperlicher und geistiger Belastbarkeit im Vordergrund. Die erneute Resistenzanalyse bestätigte einzig das bisher nicht eingesetzte DTG als voll wirksame Substanz. Die phänotypische Tropismustestung zeigte im Unterschied zum Ergebnis der 2008 erfolgten V3-Loop-Sequenzierung jetzt den in Anbetracht der weit fortgeschrittenen Erkrankung befürchteten CXCR4-Tropismus. Somit konnte unser Patient aber zusammen mit 271 weiteren Patienten in die randomisierte Kohorte der BRIGHTE-Studie eingeschlossen werden.
Lebensrettende ART
Seine „neue“, mutmaßlich gerade noch lebensrettende Kombinationstherapie begann er schließlich im Oktober 2015: FTR 600 mg 1-0-1, DTG 50 mg 1-0-1, sowie die 4-fach NRTI-Kombination TDF 245 mg 1-0-0, AZT 250 mg 1-0-1, ABC 600 mg 1-0-0 und 3TC 300 mg 1-0-0 zur Nutzung möglicher resensitivierender Effekte (HIV-GRADE: „potential complete HAART“3). Die Virusreplikation konnte schnell vollständig supprimiert werden und es folgte eine bis 2021 anhaltende Immunrekonstitution mit CD4-Helferzellen um 400-500/µl.
Versuche der Verbesserung der Verträglichkeit bei erneut ausgeprägter Kraftlosigkeit und wieder zunehmenden PNP-Beschwerden durch Verzicht auf die NRTI ABC und AZT wurden auch in Anbetracht der Vorgeschichte nach einem umgehenden Anstieg der VL (DD Blip) 2018 vorerst wieder beendet. Bei weiter zunehmender PNP-Symptomatik 2020 ermöglichte dann die Verfügbarkeit von Doravirin (DOR) das Absetzen von AZT. Die letzte Umstellung wurde im Herbst 2020 nötig, als die Kostenübernahme des inzwischen verwendeten FTC/Tenofovir-AF (TAF) durch die Krankenkasse aufgrund der neu eingeführten Festbetragsgrenze nicht mehr gegeben war. Die Therapie mit zuletzt FTR 600 mg 1-0-1, DTG 50 mg 1-0-1, TDF 245 mg 1-0-0, ABC 600 mg 1-0-0, 3TC 300 mg 1-0-0, DOR 100 mg 1-0-0 wird seit April 2021 auch außerhalb der Studie fortgesetzt, die letzte Kontrolle zeigte kein im Plasma nachweisbares Virus („target not detected“).
Kein Therapieversagen
Beide Patienten unserer Ambulanz beendeten die FTR-Zulassungsstudie zumindest virologisch erfolgreich, während ein Protokoll-definiertes virologisches Therapieversagen zu Woche 24 bei 31, zu Woche 48 bei 49 und zu Woche 96 bei 63 Teilnehmer*innen festgestellt werden musste.4 Neue Substanzen und neue Substanzklassen werden damit selbst im Deutschland von 2021 immer wieder für das weitere Überleben von Menschen mit HIV-Infektion entscheidend sein, auch wenn die überwiegende Mehrzahl unserer Patient*innen in absehbarer Zeit Medikamente wir Rukobia® wohl nicht kennenlernen wird.
Literatur
1 ViiV Healthcare GmbH. Fachinformation Rukobia 600 mg Retardtabletten. 2021
2 Kozal M, Aberg J, Pialoux G, et al. Fostemsavir in Adults with Multidrug-Resistant HIV-1 Infection. N Engl J Med 2020;382:1232-1243. 10.1056/NEJMoa1902493
3 HIV-GRADE e.V. HIV-GRADE - HIV-1 Tool. 2015; aktuelle Version verfügbar unter www.hiv-grade.de
4 European Medicine Agency. Rukobia : EPAR - Product information. Last updated 13/04/2021. EMEA/H/C/005011 - IB/0002 2021










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
