Leitlinien Hepatitis B

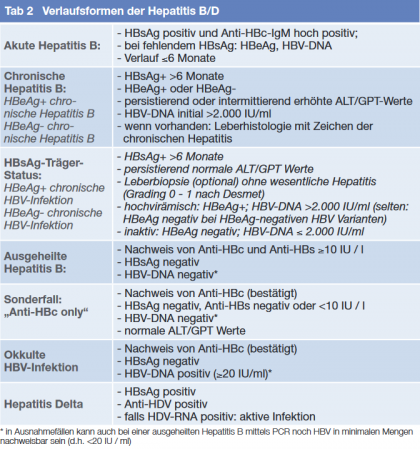

Bei der Erstdiagnose einer Hepatitis B sollte neben Anamnese und klinischer Untersuchung sowie spezifischer serologischer Labordiagnostik (Tab. 1) eine Koinfektion HCV, HDV und HIV bzw. eine HEV-Infektion ausgeschlossen werden. Der Hepatitis-A Immunstatus ist wichtig für die Frage nach einer entsprechenden Impfung. Ferner sollten die Leberfunktion überprüft und ein Ultraschall des Abdomens durchgeführt werden. Entsprechend der Laborkonstellation werden verschiedene Verlaufsformen der Hepatitis B und Hepatitis B/D unterschieden (Tab. 2). Familienmitgliedern bzw. Partnern sowie engen Kontaktpersonen HBV-Infizierter sollen eine HBV-Diagnostik und eine Impfung angeboten werden. Bei positiven anti-HDV sollte ein Virusnachweis mittels HDV-RNA erfolgen.
Verlaufskontrollen
Grundsätzlich sind regelmäßige Kontrollen bei Menschen mit chronischer Hepatitis B indiziert. Die Intervalle der Verlaufsuntersuchungen bei Unbehandelten hängen vom klinischen Verlauf ab und müssen individuell festgelegt werden (Entzündliche Aktivität? Höhe der Virämie? Vorliegen einer Leberzirrhose? Risiko für die Entwicklung eines HCC?) (Tab. 3). Eine quantitative Einpunkt-Bestimmung des HBsAg in Kombination mit der Virämie (HBV-DNA <2.000 IU/ml und HBsAg <1.000 IU/ml) kann mit einem prädiktiven Wert von 90% einen inaktiven HBsAg-Träger identifizieren. Eine quantitative HBsAg Bestimmung kann daher in bestimmten Situationen sinnvoll sein.
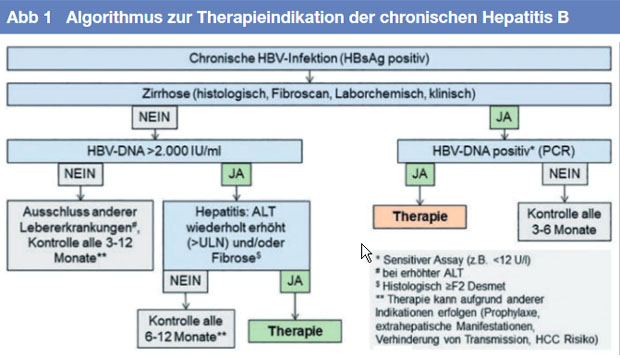
Therapieindikation
Alle Patienten mit chronischer Hepatitis B sind grundsätzlich Kandidaten für eine antivirale Therapie. Eine sichere Indikation zur Behandlung der chronischen Hepatitis B (HBeAg-positiv oder HBeAg-negativ) liegt vor bei
• Virusreplikation von ≥2.000 IU/ml
und
• entzündliche Aktivität mit wiederholt erhöhten Transaminasen
und
• unter Berücksichtigung von Lebensalter und Begleiterkrankungen mit erhöhtem Risiko für eine Leberzirrhose und HCC.
Die Höhe der Transaminasen allein ist kein zuverlässiger Parameter für die Abschätzung der Krankheitsaktivität. Bei nicht eindeutiger Indikation sollten Viruslast und Transaminasen in dreimonatigen Abständen kontrolliert werden. In unklaren Situationen (z.B. HBV-DNA im Serum >2.000 IU/ml und normalen oder nur minimal erhöhten bzw. fluktuierenden Transaminasen) kann eine nichtinvasive transiente Elastographie oder Leberbiopisie sinnvoll sein. Dies gilt insbesondere für Patienten jenseits des 30. Lebensjahres. Auch bei normalen oder nur minimal erhöhten Transaminasen im Serum können eine Entzündung und/oder eine signifikante Fibrose in der Leber vorliegen, die dann eine Therapie-Indikation begründen können. Die Elastographie ist zuverlässig beim Nachweis einer fortgeschrittenen Fibrose/Zirrhose sowie zum Ausschluss einer Fibrose. Die Leberbiopsie ist hilfreich zur Einstufung der entzündlichen Aktivität.
Patienten mit einer Virämie ≥2.000 IU/ml und wiederholt erhöhten Transaminasen sollten therapiert werden. Eine klare Indikation besteht bei Patienten mit Leberzirrhose unabhängig von der Höhe der Virämie sowie bei Patienten mit hepatozellulärem Karzinom (HCC). Die antivirale Therapie hat einen günstigen Einfluss auf die Prognose.
Bei hochvirämischen HBeAg-positive Patienten mit normalen Transaminasen („immuntolerante Patienten“) besteht keine dringende Behandlungs-indikation, lediglich über 30jährige sollten behandelt werden aufgrund eines erhöhten Risikos für histologische Veränderungen und HCC-Entwicklung. Berufliche und soziale Aspekte wie Stigmatisierung, drohendes Berufsverbot, erhöhtes Transmissionsrisiko usw. können ebenfalls eine Indikation zur Behandlung darstellen.
Therapie
Für die Therapie stehen zwei unterschiedliche Therapiekonzepte zur Verfügung: Pegyliertes Interferon alfa (PEG-IFN) und Nukleosid- bzw. Nukleotid-Analoga, vorzugsweise Entecavir (ETV) oder Tenofovir (TDF oder TAF). Bei der Auswahl sollen das Stadium der Lebererkrankung, Komorbiditäten (v.a. Niereninsuffizienz und Knochendichteminderung) und Begleitumstände (z.B. Schwangerschaft, Kinderwunsch, Transplantation), die Höhe der HBV-DNA sowie eventuelle Vortherapien berücksichtigt werden. Eine Kombinationtherapie mit pegyliertem Interferon alfa (PEG-IFN) und einem Nukleos(t)idanalogon kann derzeit nicht empfohlen werden.
Bei einem Abfall der glomerlulären Filtrationsrate, einer Tubulopathie, einer Hypophosphatämie <1 mg/dl und bei erhöhtem Frakturrisiko unter TDF sollte auf eine andere Substanz gewechselt werden.
Therapie-Monitoring
Vor Therapie |
• HBV-DNA quantitativ • klinisch-chemische Labortests • HBeAg / Anti-HBe
• Quantitative
Bestimmung des |
Während der Therapie |
• HBV-DNA
quantitativ: im ersten • nach dem 1. Jahr bei virologischem Ansprechen kann das Intervall auf alle 6 Monate verlängert werden
• Resistenz-Varianten
bei nicht ausreichendem Therapieansprechen
• HBeAg
(falls positiv) alle 6-12 Mo- • HBsAg quantitativ
• Klinisch-chemische
Labortests |
Bei Therapie mit Nukleos(t)id-Analoga werden vor Therapie bzw. zum Therapie-Monitoring folgende Untersuchungen empfohlen:
Resistenz
Bei persistierender HBV-DNA <2.000 IU/ml unter Behandlung mit Tenofovir (TDF oder TAF) oder ETV ist keine Anpassung der Behandlung notwendig, wenn keine Zirrhose und kein Anhalt für Resistenz oder Nicht-Ansprechen vorliegt. Bei partiellem Therapieansprechen oder Nonresponse soll zunächst die Therapieadhärenz des Patienten überprüft werden. In klinischen Kohorten waren bis zu 30-40% aller virologischen Durchbrüche mutmaßlich auf unregelmäßige Medikamenteneinnahmen zurückzuführen.
Therapieende
Bei HBeAg-negativen Patienten ohne fortgeschrittene Leberfibrose kann eine Therapie mit Nukleos(t)id-Analoga vor HBsAg Verlust beendet werden, wenn die HBV-DNA mindestens drei Jahre negativ bzw. nicht quantifizierbar war und eine engmaschige Kontrolle nach Therapiestopp gewährleistet ist.
Bei Patienten mit Leberzirrhose sollte die Therapie aus Sicherheitsgründen erst nach HBsAg-Verlust mit Nachweis von anti-HBs oder nach einer Konsolidierungstherapie von 6-12 Monaten nach Therapieende und HBsAg Verlust abgesetzt werden.
Bei HBeAg-positiven Patienten kann die antivirale Therapie 12 Monate nach HBeAg-Verlust und anti-HBe-Serokonversion beendet werden. Vor Beendigung der Therapie sollte die HBV-DNA negativ bzw. nicht quantifizierbar sein.
Schwangerschaft
BsAg+-Patienten |
• mit
hohem Risiko und mit modera-
• mit
niedrigem Risiko sollen mindes-tens alle 8 Wochen kontrolliert
|
HBsAg- und Anti-HBc+-Patienten |
• bei geplanter B-Zell depletierender Immunsuppression oder Stammzell-/Knochenmarktransplantation antivirale Behandlung
• bei
Immunsuppression mit mode- • bei geplanter lokaler HCC-Therapie (TACE, perkutan/lokal ablative Verfahren, Resektion) Behandlung |
Bei HBsAg-positiven Patientinnen soll eine regelmäßige (mindestens alle drei Monate) Bestimmung von ALT und HBV-DNA während der Schwangerschaft und mindestens bis 6 Monate nach Entbindung durchgeführt werden wegen des Risiko eines Flares.
Wurde bisher keine antivirale Therapie durchgeführt, soll eine Therapie während der Schwangerschaft angeboten werden bei:
a) Aktiver Hepatitis, gemäß den Empfehlungen für nicht schwangere Frauen.
b) Vorliegen einer HBV-DNA Konzentration >200.000 IU/mL, um das Risiko einer vertikalen Transmission (Mutter-Kind Übertragung) zu reduzieren.
Eine Therapie zur Verhinderung der Mutter-Kind-Übertragung sollte hier möglichst früh, idealerweise vor der 32. Schwangerschaftswoche aber nach dem 1. Trimenon begonnen werden, um eine ausreichende Senkung der Viruslast zu erreichen.
Die Nukleos(t)idanaloga, die bei Schwangeren untersucht wurden, sind Lamivudin, Telbivudin und Tenofovir (TDF). Tenofovir (TDF) sollte bevorzugt eingesetzt werden.
Prävention bei Immunsuppression
Das Risiko einer HBV-Reaktivierung hängt vom serologischen Status des Patienten und von der eingesetzten immunsuppressiven Therapie ab und kann grob in hohes (>10%), moderates (1–10%) oder niedriges Risiko (<1%) eingeteilt werden.
Cornberg M et al. S3-Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) Z Gastroenterol 2021; 59: 691-776








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
