STARTVerso: Faldaprevir plus pegIFN/RBV
STARTVerso: Faldaprevir plus pegIFN/RBV
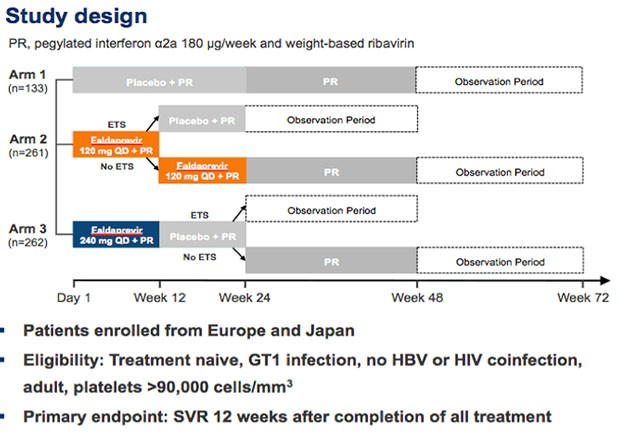
In STARTVerso wurde Faldaprevir in zwei Dosierungen in Kombination mit pegIFN/RBV in Vergleich zur dualen Therapie an 656 Patienten mit GT1 geprüft.
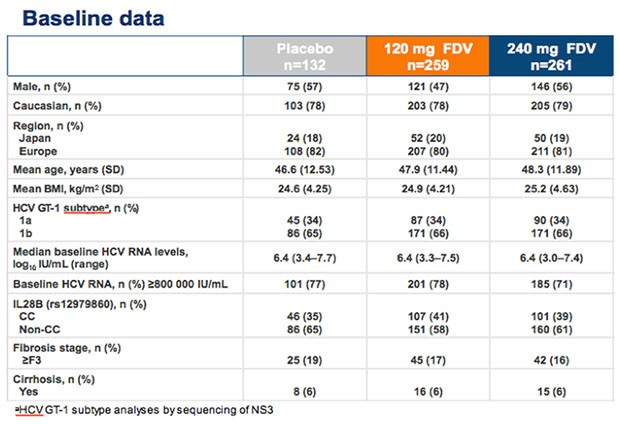
Zwei Drittel hatten einen GT1b, ebenfalls zwei Drittel IL28B non-CC une rund 15% eine Zirrhose.
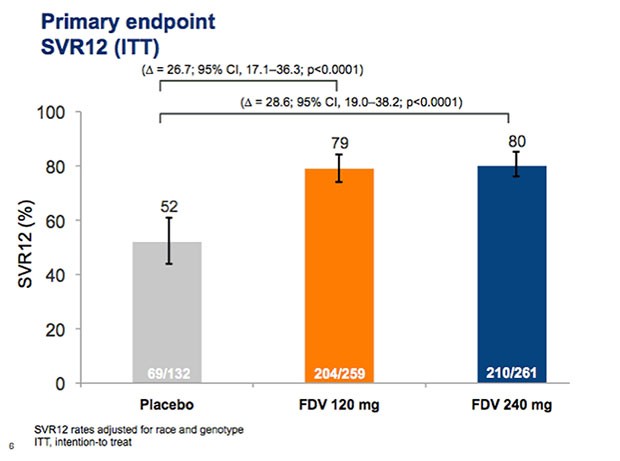
Mit der neuen Tripletherapie erreichten insgesamt 80% der Patienten eine SVR im Vergleich zu 52% mit der dualen Therapie.
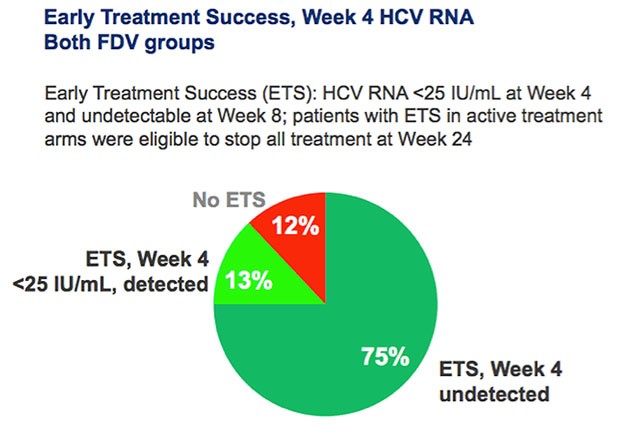
Rund 88% der Patienten konnten die Therapie auf 24 Wochen verkürzen, da ihre HCV zu Woche 4 <25 IU/ml lag und zu Woche 8 nicht nachweisbar war.
Von den Patienten mit nicht nachweisbarer HCV-PCR erreichten 94% eine SVR. Bei den Patienten mit nachweisbarer aber nicht quantifizierbarer HCV-PCR zu Woche 4 waren es 77%.
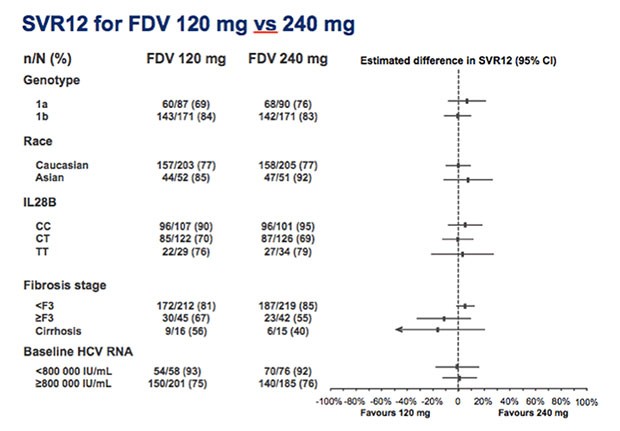
Patienten mit Genotyp 1b und IL28B-CC sprachen etwas besser an. Vorbestehende Polymorphismen hatten keinen Einfluss auf die SVR.
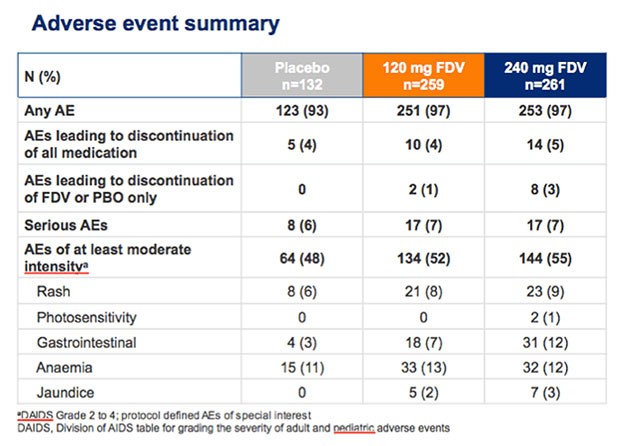
Hinsichtlich der Wirksamkeit waren 120 und 240 mg Faldaprevir vergleichbar, 120 mg war besser verträglich. Nebenwirkungen waren insgesamt jedoch selten. Bei 12% der Patienten wurde eine transiente Hyperbilirubinämie beobachtet.

 PDF Slides zum Download:
PDF Slides zum Download:







 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
