MERIT: Maraviroc in der Firstline
In MERIT wurde die Wirksamkeit des CCR5-Antagonisten Maraviroc bei therapienaiven Patienten im Vergleich zu Efavirenz geprüft. Die Ergebnisse sind schwer zu interpretieren. Die Wirksamkeit beim Endpunkt <400 Kopien/ml war vergleichbar, allerdings schnitten Patienten mit hoher Viruslast und in der südlichen Hemisphäre schlechter ab. Immunologisch hatte wiederum Maraviroc einen günstigeren Effekt.
In MERIT wurden 721 therapienaive Patienten (VL 4,8 log, CD4-Zahl 250/µl) mit R5-tropem Virus entweder mit Maraviroc (300 mg BID) oder Efavirenz (600 mg OD) jeweils in Kombination mit Zidovudin/Lamivudin behandelt. Die Ergebnisse der Studie sind schwer zu interpretieren, da
Uneinheitliches Bild
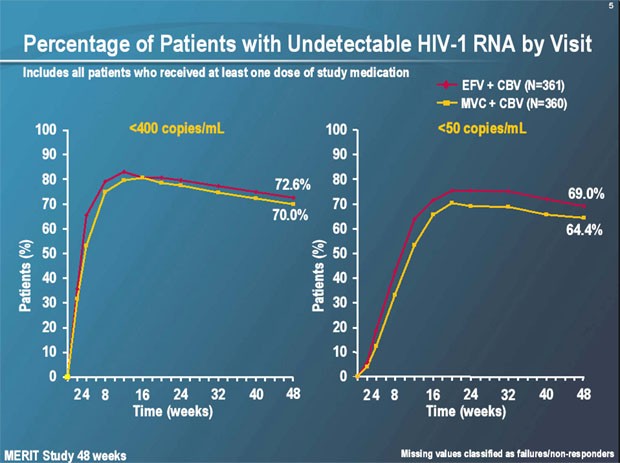
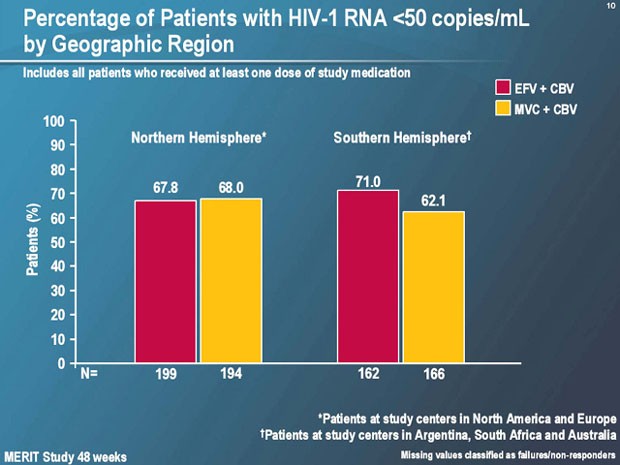
Nach 48 Wochen hatten in beiden Armen gleich viele Patienten eine Viruslast <400 Kopien/ml erreicht (70% vs. 73%), jedoch mehr Patienten unter Efavirenz eine Viruslast <50 Kopien/ml (64% vs. 69%). Diese Differenz war nur bei den Patienten mit einer hohen Ausgangsviruslast nachweisbar (60% vs. 67%), nicht bei Patienten mit <100.000 Kopien/ml bei Therapiebeginn (70% vs. 72%). Ein ähnliches Bild zeigte sich bei der Differenzierung in nördliche und südliche Hemisphere. Im Norden war das Ansprechen vergleichbar (68% vs. 68%), im Süden war Efavirenz besser (62% vs. 71%). "Bisher können wir diesen Unterschied nicht erklären", meinte Michael Saag, Birmingham, und spekulierte über einen möglichen Einfluss des Subtyps, der Adhärenz sowie der Transportwege für den Tropismus-Test.
Gute Verträglichkeit
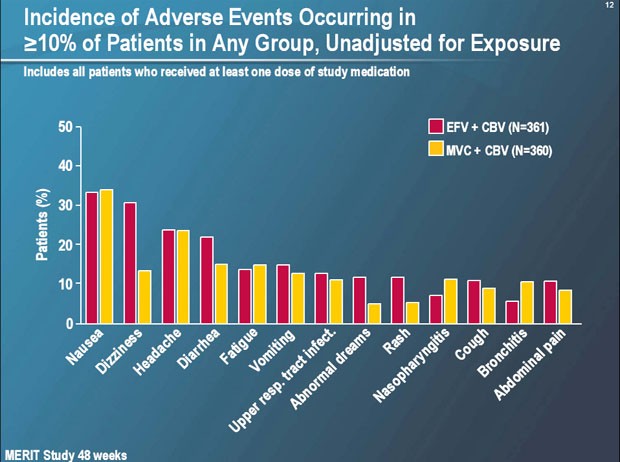
Im Hinblick auf die immunologische Wirksamkeit und die Verträglichkeit war Maraviroc besser als Efavirenz. Unter dem CCR5-Antagonisten waren die CD4-Zellen stärken angestiegen (144 vs. 170/µl). Nebenwirkungen wurden unter Maraviroc nicht beobachtet, unter Efavirenz das übliche Spektrum, d.h. zentralnervöse Probleme, Exanthem und Fettstoffwechselstörungen.
Baldige Zulassung
Die Zulassung für den CCR5-Antagonisten ist eingereicht. Kurz vor der IAS-Konferenz erhielt die Substanz auch ein positives Votum von der Europäischen Zulassungsbehörde EMEA. Maravioc wird somit voraussichtlich schon im Herbst zur Verfügung stehen.
WESS104 Saag M et al, 4th IAS Conference 2007, Sydney 22.-25. Juli 2007








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
