DR. MARTIN STÜRMER, FRANKFURT
Genotypisches Resistenzprofil neuer Proteasehemmer
Für die kürzlich zugelassenen Proteasehemmer Tipranavir (Aptivus®, Boehringer) und Darunavir (Prezista®, Tibotec) sind Algorithmen beschrieben worden, mit deren Hilfe es dem Virologen möglich ist, anhand der Mutationen eine Vorhersage hinsichtlich des virologischen Ansprechens zu treffen. Für beide Substanzen gibt es Kreuzresistenzen, die in der Regel nur moderat sind; ebenso scheint eine Vortherapie mit anderen Proteasehemmern - sofern nicht eine komplette Resistenz vorliegt - ebenfalls keinen oder nur einen moderaten Einfluss auf das virologische Ansprechen von Darunavir und Tipranavir zu haben. Die Kombinationsmöglichkeiten von Darunavir und Tipranavir mit anderen Proteasehemmern sind aufgrund virologischer und pharmakologischer Daten eher eingeschränkt.
Für den Virologen, der antiretrovirale Substanzen hinsichtlich ihrer Wirksamkeit aufgrund vorhandener Mutationsmuster einordnen muss, ist jede neue Substanz eine Herausforderung, denn Daten zu den resistenz-relevanten Mutationen sind anfangs oft sehr spärlich. Im Folgenden werden die zurzeit verfügbaren Daten zu den kürzlich zugelassenen Proteasehemmern Tipranavir (Aptivus®) und Darunavir (Prezista®) diskutiert. Allerdings bleibt in diesem Zusammenhang festzuhalten, dass diese Daten aus klinischen Studien stammen; Daten aus dem klinischen Alltag werden sicherlich weitere Information liefern.
RESISTENZ-RELEVANTE MUTATIONEN
Eine Korrelation von Mutationsmustern mit einem verminderten Darunavir (DRV)-Ansprechen gelang durch Analyse der POWER-Studien 1, 2 und 31. Es konnten elf Mutationen an zehn Positionen in der Protease identifiziert werden: V11I, V32I, L33F, I47V, I50V, I54L/M, G73S, L76V, I84V und L89V (Abb. 1). Von den Patienten ohne relevante Mutation bei Baseline (n=67) erreichten immerhin 64% eine Viruslast unterhalb 50 Kopien/ml. Bei den Patienten mit 1-2 Mutationen (n=94 bzw. n=113) waren es 50 bzw. 42%, während bei 3 (n=58) bzw. 4 oder mehr Mutationen (n=42) nur noch 22 bzw. 10% dieses Ziel erreichten1.
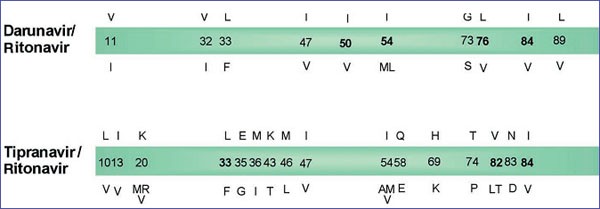
Abb. 1: Resistenz-relevante Mutationen für die kürzlich zugelassenen Proteasehemmer
Darunavir und Tipranavir;
modifiziert nach 9
Die resistenz-relevanten Mutationen für Tipranavir (TPV) wurden in den Analysen der RESIST-Studien beschrieben2. Hier konnten 21 Mutationen an 16 Positionen der Protease mit TPV assoziiert werden: L10V, I13V, K20M/R/V, L33F, E35G, M36I, K43T, M46L, I47V, I54A/M/V, Q58E, H69K, T74P, V82L/T, N83D und I84V (Abb. 1). Patienten mit 0-2 Mutationen (n=205) hatten im Median eine Viruslast-Reduktion nach 24 Wochen zwischen -1,30 und -2,12 log10 Kopien/ml, ein Score von 3-7 (n=479) ergab eine Reduktion um -0,30 bis -0,64 log10 Kopien/ml, während ein Score von 8 (n=4) nur noch eine Reduktion um -0,08 log10 Kopien/ml bewirkte2.
PHÄNOTYPISCHE KREUZRESISTENZ
Die Auswertung großer Datenbanken gibt Auskunft über mögliche Kreuzresistenzen von Substanzen, die bisher hauptsächlich in Studien eingesetzt wurden. Eine entsprechende Untersuchung von über 56.000 phänotypischen Datensätzen zeigt, dass für Isolate mit einer minimalen Aktivität von Amprenavir (APV) - das gleiche sollte für Fosamprenavir (F-APV) gelten - bzw. TPV eine erhöhte Kreuzresistenz zu DRV zu beobachtet ist, während diese bei Atazanavir (ATV) und Nelfinavir (NFV) am niedrigsten ausfällt3. Kreuzresistenz zu TPV scheint am ehesten durch DRV verursacht zu sein, gefolgt von Indinavir (IDV), Saquinavir (SQV), APV und Lopinavir (LPV). TPV zeigt ebenfalls die niedrigste Kreuzresistenz zu ATV und NFV. Hierbei ist noch mal zu betonen, dass diese Auswertungen sich auf Virusisolate beziehen, die eine maximale Resistenz gegenüber den entsprechenden Proteasehemmern aufweisen.
EINFLUSS VON VORTHERAPIEN
Aufgrund der Analysen der POWER-Studien scheint eine versagende Therapie mit entweder F-APV, TPV oder LPV vor Einsatz von DRV keinen Einfluss auf das virologische Ansprechen nach 24 Wochen zu haben4. Aus den RESIST-Daten lässt sich neben der generellen Aussage, Kreuzresistenz zu TPV durch andere Proteasehemmer seien eher eingeschränkt zu beobachten5, auch schließen, dass eine Vortherapie mit LPV erst dann einen negativen Einfluss auf das TPV-Ansprechen hat, wenn eine (fast) vollständige LPV-Resistenz vorliegt6.
In einer weiteren Untersuchung wurde die Veränderung der phänotypischen DRV- bzw. TPV-Empfindlichkeit nach LPV-Versagen anhand von Phase 2- bzw. Phase 3-Studien geprüft, in denen Patienten mit LPV behandelt worden waren7. Im Median stieg bei 18 Patienten mit virologischem LPV-Versagen die phänotypische Resistenz für LPV von 6,9- auf 63-fach, während für DRV nur ein Anstieg von 1,4- auf 2,7-fach und für TPV ein Abfall von 1,9- auf 1,8-fach zu beobachten war.
KOMBINATIONSMÖGLICHKEITEN
Die Kombinationsmöglichkeiten von DRV und TPV mit anderen Proteasehemmern sind in erster Linie durch die pharmakologischen Eigenschaften limitiert. Aufgrund der Mutationen, die in den entsprechenden Algorithmen enthalten sind, sollte DRV eher nicht mit APV/F-APV oder LPV kombiniert werden. Auch die Kombination von TPV und APV/F-APV scheint aus virologischer Sicht eher ungünstig zu sein. Generell sollten beide Substanzen nur in Kombination mit weiteren aktiven Substanzen eingesetzt werden, um eine volle antivirale Wirksamkeit bei vorbehandelten Patienten zu erzielen. Dazu könnten unter anderem auch Kombinationen mit Vertretern der neuen Substanzklassen der Fusionshemmer, Integrasehemmer und Korezeptorhemmer zählen - wie das Beispiel Enfuvirtid zeigt8. Eine Kreuzresistenz von DRV und TPV zu neuen Substanzklassen ist nicht zu erwarten, ebenso nicht für die Klasse der Reversen Transkriptasehemmer.
Dr. phil. nat. Martin Stürmer
Institut für Medizinische Virologie Klinikum
der Johann-Wolfgang-Goethe Universität
Paul-Ehrlich-Str. 40 · 60596 Frankfurt
Email: M.Stuermer@em.uni-frankfurt.de
Literatur
1. De Meyer S, Vangeneugden T, Lefebvre E, et al. Phenotypic and genotypic determinants of TMC114 (darunavir) resistance: POWER 1, 2 and 3 pooled analysis. 8th International Congress on Drug Therapy in HIV Infection. 12-16 November 2006, Glasgow, UK. P196.
2. Baxter JD, Schapiro JM, Boucher CA, et al. Genotypic changes in human immunodeficiency virus type 1 protease associated with reduced susceptibility and virologic response to the protease inhibitor tipranavir. J Virol 2006; 80:10794-10801.
3. Staes M, Van Craenenbroeck E, Vermeiren H, et al. Analyses of Susceptibility and Cross-Resistance between TMC114 and other Protease Inhibitors among > 56,000 Routine Samples, using Linear Regression Model-Based Fold Change Predictors. 15th International HIV Drug Resistance Workshop. 13-17 June 2006, Sitges, Spain. Poster 28.
4. Lefebvre E, de Bethune MP, De Meyer S, et al. Impact of use of TPV, LPV, and (f)APV at screening on TMC114/r virologic response in treatment-experienced patients in POWER 1, 2 and 3. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. 27-30 September 2006, San Francisco, CA, USA. Abstract H-1387.
5. Kohlbrenner VM, Hall DB, Baxter JD, Perno CF, Mayers DL. Limited cross-resistance to TPV in patients previously treated with two or more protease inhibitors. 8th International Congress on Drug Therapy in HIV Infection. 12-16 November 2006, Glasgow, UK. Poster P209.
6. Walmsley S, Hall D, Valdez H, Scherer J, Boucher C. Better treatment response (TR) to tipranavir/r (TPV/r) compared to lopinavir/r (LPV/r) in patients with higher lopinavir (LPV) mutation scores. 8th International Congress on Drug Therapy in HIV Infection. 12-16 November 2006, Glasgow, UK. Poster P197.
7. King M, Young TP, Bernstein B, et al. Phenotypic Susceptibility to TMC-114 and Tipranavir Before and After Lopinavir/ritonavir-based Treatment in Subjects Demonstrating Evolution of Lopinavir Resistance. 15th International HIV Drug Resistance Workshop. 13-17 June 2006, Sitges, Spain. Poster 29.
8. Youle M, Staszweski S, Clotet B, et al. Concomitant use of an active boosted protease inhibitor with enfuvirtide in treatment-experienced, HIV-infected individuals: recent data and consensus recommendations. HIV Clin Trials 2006; 7:86-96.
9. Johnson VA, Brun-Vezinet F, Clotet B, et al. Update of the drug resistance mutations in HIV-1: Fall 2006. Top HIV Med 2006; 14:125-130.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
