SANDRA BÜHLER UND RALF BARTENSCHLAGER, HEIDELBERG
HBV, HCV und HIV Gemeinsamkeiten und Unterschiede aus Sicht des Virologen
HBV, HCV und HIV gehören zu unterschiedlichen Virusfamilien und haben unterschiedliche Strategien der Viruspersistenz. Es gibt jedoch auch Gemeinsamkeiten, z.B. die hohe Replikationsrate, die große Zahl von Mutationen bei der Vermehrung und die damit verbundene Möglichkeit der Resistenzentwicklung gegen Medikamente. Unterschiede und Gemeinsamkeiten müssen jedoch differenziert betrachtet werden und die Übertragung der klinischen Erfahrungen von einer Infektion auf die andere ist nicht ohne weiteres möglich.
VIRUSMORPHOLOGIE
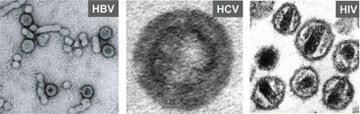
Abb. 1: Elektronenmikroskopische Aufnahmen von HBV, HCV und HIV-1 Partikeln (freundlicherweise zur Verfügung gestellt von Prof. S. Urban und S. Seitz (HBV), A. Merz (HCV) und Prof. H.-G. Kräusslich (HIV))
Auf Grund ihrer Genomstruktur und Vermehrungsstrategie gehören das Humane Immundefizienz Virus (HIV), das Hepatitis B Virus (HBV) und das Hepatitis C Virus (HCV) zu ganz unterschiedlichen Virusfamilien. HBV gehört zu den Hepadnaviridae, HCV zu den Flaviviridae und HIV zu den Retroviridae. Dennoch gibt es eine ganze Reihe von Gemeinsamkeiten, die, bei oberflächlicher Betrachtung, mit dem Aufbau des infektiösen Viruspartikels beginnen. So ist allen drei Erregern gemeinsam, dass es sich um sphärische Viruspartikel handelt, die von einer Detergenzsensitiven Lipidhülle umgeben sind (Abb. 1 und Tab. 1). In diese Hülle eingebaut sind die viralen Hüllproteine, die bei einer Infektion die Aufnahme der Viruspartikel in die Wirtszelle vermitteln. Unterhalb der Virushülle befindet sich eine Proteinkapsel, die aus zahlreichen Kopien desselben viralen Proteins (HBV und HCV) oder verschiedener viraler Proteine (HIV) besteht. Die molekulare Struktur der Viruspartikel ist bei HBV und HIV weitestgehend erforscht. Im Fall von HCV ist das nicht der Fall, was im wesentlichen daran liegt, dass bis vor kurzem das Virus in kultivierten Zellen im Labor nicht vermehrt werden konnte und das infektiöses HCV in hohem Maße mit Lipoproteinen quasi maskiert ist (Tab. 1).
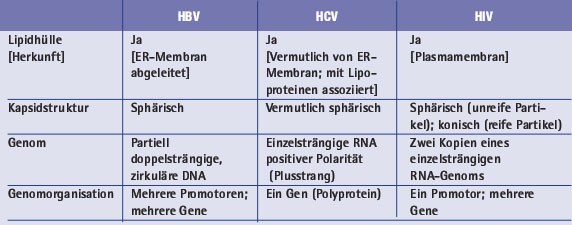
Tab. 1: Vergleichende Eigenschaften von HBV, HCV und HIV
EPIDEMIOLOGIE
Alle drei Erreger zeichnen sich durch eine weltweite Prävalenz aus und sind Verursacher der am häufigsten vorkommenden Virusinfektionen, wobei Endemiegebiete in Afrika, Südostasien und Lateinamerika liegen. HBV ist dabei das weltweit häufigste Virus. Rund zwei Fünftel der Weltbevölkerung haben eine HBV-Infektion durchgemacht und ca. 300 bis 400 Millionen Menschen sind chronisch HBV infiziert. Jährlich sterben ca. 1 Million Menschen an den Folgen einer chronischen Hepatitis B. In Europa liegt die Prävalenz der HBV-Infektion auf Grund der Impfung und Hygienestandards unter 2%. Chronisch mit HCV infiziert sind weltweit etwa 170 Millionen Menschen. Die Prävalenz liegt in Europa bei 0,5-1%, in Deutschland sind ca. 500.000 Personen chronisch HCV-infiziert. Einige Länder wie beispielsweise Ägypten oder die Mongolei haben eine besonders hohe Prävalenz (ca. 30%). Im Fall von Ägypten wurde dies auf den Mehrfachgebrauch von Kanülen im Rahmen der Schistosomiasistherapie zurückgeführt.
Weltweit gibt es ca. 35 Millionen HIV infizierte Menschen. Zweidrittel der Infektionen kommen dabei in Afrika in Regionen südlich der Sahara vor. Auch von den 2,5 Millionen Neuinfektionen jährlich sind allein 1,7 Millionen in diesen Regionen zu verzeichnen, was immense Auswirkungen auf Bevölkerungsstruktur und Lebenserwartung hat. Jährlich sterben etwa 2 Millionen Menschen an den Folgen einer HIV Infektion.
Virusreplikation
Grundsätzlich unterteilt sich der Vermehrungszyklus eines Virus in 6 Phasen, was auch für die drei genannten Erreger gilt:
1. Die ‚Adsorption', d.h. das Virus bindet mittels spezifischer Strukturen auf seiner Oberfläche (die Hüllproteine) an Rezeptoren der Zielzelle.
2. Die ‚Penetration', d.h. das Viruskapsid dringt - auf unterschiedlichem Weg - in die Wirtszelle ein.
3. Das ‚uncoating', d.h. die virale Erbinformation wird in die Wirtszelle freigesetzt.
4. Die ‚Replikation', d.h. das Virusgenom veranlasst, dass die viralen Proteine in der Wirtszelle synthetisiert werden. Diese wiederum katalysieren, unter Mithilfe zellulärer Faktoren, die Vermehrung des Virusgenoms.
5. Die ‚Montage', d.h. neue Viruspartikel bauen sich in der Wirtszelle zusammen.
6. Die ‚Freisetzung', d.h. die Nachkommenviren werden aus der infizierten Zelle ausgeschleust.
ÜBERTRAGUNGSWEGE
Gemeinsam ist allen drei Erregern, dass sie parenteral (durch Blut oder kontaminierte Blutprodukte), perinatal (vor, unter oder kurz nach der Geburt) oder auf sexuellem Weg übertragen werden können, wobei die Rolle, die die einzelnen Übertragungswege spielen, variiert. Die parenterale Übertragung aller drei Viren durch Bluttransfusionen und durch nicht inaktivierte zelluläre Blutprodukte ist nach der verbindlichen Einführung der Untersuchung aller Spender und durch das Einführen von Verfahren zur Virusinaktivierung deutlich zurückgegangen und spielt in Deutschland keine Rolle mehr. Dagegen ist intravenöser Drogenkonsum in Deutschland einer der wichtigsten Übertragungswege bei HCV- und HIV-Infektionen. Beruflich bedingte Infektionen bei medizinischem Personal mit HBV, HCV und HIV kommen im Einzelfall vor und sind auf konkrete Ereignisse, z.B. Nadelstichverletzungen, zurückzuführen. Das Risiko einer Infektion nach Nadelstichverletzung mit einer Hohlnadel liegt bei HBV etwa bei 30%. Bei HCV und HIV ist das Übertragungsrisiko deutlich geringer und beträgt 3% respektive 0,3%. Die perinatale Infektion von einer HBV-positiven Mutter auf das Kind, ist in Endemiegebieten der wichtigste Übertragungsweg. Hauptproblem dabei ist, dass die perinatale HBV Infektion in 90% der Fälle inapparent chronifiziert und die Infizierten ein hohes Risiko für einen Leberschaden in jungen Jahren haben. Bei Infektionen im späten Kindes-/Jugend- und Erwachsenenalter liegt die Chronifizierungsrate hingegen bei etwa 5-10%.
Bei HIV hängt die perinatale Übertragung davon ab, ob die Mutter kurz vor bzw. unter der Geburt einer antiviralen Therapie unterzogen wird. Die Transmissionsrate ohne Prophylaxe von 25% kann durch entsprechende Therapie auf 1-2% reduziert werden. Von ganz entscheidender Bedeutung bei HIV ist die sexuelle Übertragung, die für mehr als 90% der HIV-Neuinfektionen verantwortlich ist und die auch bei den HBV Neuinfektionen in den Industrieländern die Hauptrolle spielt. Im Gegensatz dazu spielt der sexuelle Übertragungsweg bei der Hepatitis C nur eine untergeordnete Rolle.
PERSISTENZSTRATEGIEN
Alle drei Erreger sind in der Lage, eine persistente Infektion zu etablieren. Darunter versteht man das Überdauern des Virus, zumindest des Virusgenoms, im Organismus. Persistenz ist unabhängig von Symptomen und in der Tat sind die Frühphasen nach der akuten Infektion häufig asymptomatisch, obwohl der Erreger durch die Immunantwort nicht eliminiert wurde. Die persistente Infektion ist jedoch die Voraussetzung für die ‚Spätschäden', die sich nach einer langjährigen chronischen Infektion manifestieren können. Dabei verfolgen die drei Erreger unterschiedliche Persistenzstrategien, die durch die jeweiligen Vermehrungszyklen bedingt sind.
HBV
Die HBV-Infektion verläuft nur in seltenen Fällen so aggressiv, dass es zu einem lebensbedrohlichem Leberversagen kommt (fulminante Hepatitis B). Die akute HBV Infektion heilt bei erwachsenen immunkompetenten Personen in 90% der Fälle nach ein bis sechs Monaten aus. Lediglich bei etwa 10% der Infizierten wird die Infektion chronisch. Von zentraler Bedeutung für die Persistenz ist das Erregerreservoir. Im Falle der HBV-Infektion stellt die epsiomale (d.h. nicht in das Wirtsgenom integrierte) und extrem stabile ‚covalently closed circular' (ccc)DNA das zentrale Persistenzreservoir dar. Wie in Tabelle 2 dargestellt wird das partiell doppelsträngige HBV-Genom nach Infektion der Zielzelle in eine vollständig doppelsträngige Ringstruktur, die cccDNA, umgewandelt (daher die Bezeichnung ‚kovalent geschlossen') und in den Zellkern eingeschleust. Sie ist der Ausgangspunkt für die Synthese aller viralen RNAs und damit aller viralen Proteine. Darüber hinaus wird von der cccDNA das RNA Prägenom abgelesen, das wiederum durch das virale Enzym reverse Transkriptase in DNA-Versionen des Virusgenoms umgeschrieben wird. Die Ausheilung der chronischen HBV Infektion erfordert somit die Elimination der cccDNA, was mit aktuell verfügbaren Therapien nicht möglich ist.
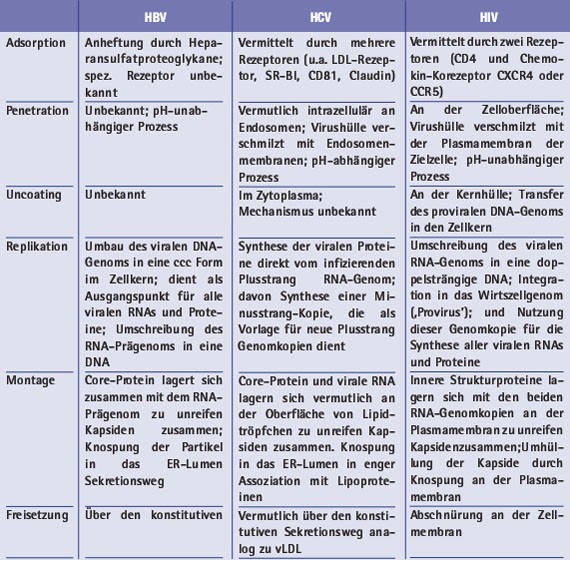
Tab. 2: Vergleich der 6 Schritte der Vermehrungszyklen von HBV, HCV und HIV
HCV
Im Gegensatz zu HBV repliziert HCV ausschließlich im Zytoplasma in eigenen von viralen Proteinen induzierten Replikationskomplexen, die von zellulären Membranen umgeben sind. Diese Replikationskomplexe sind das zentrale Persistenzreservoir des HCV und ihre Aufrechterhaltung erfordert eine kontinuierliche Virusreplikation. Damit ist die HCV Infektion einer antiviralen Therapie relativ gut zugänglich, denn bei Hemmung der Virusvermehrung verschwinden die Replikationskomplexe und damit der Erreger. HCV-Infektionen verlaufen relativ harmlos, bei drei Viertel aller Infizierten sogar inapparent. Problematisch ist jedoch die hohe Chronifizierungsrate von bis zu 80%. Hier kommt es häufig zu einer Entzündungsreaktion in der Leber, die abhängig von Kofaktoren wie Alkoholkonsum oder HIV- bzw. HBV-Koinfektion innerhalb von einigen Jahren bis Jahrzehnten zu einer Leberzirrhose oder einem hepatozellulären Karzinom führen kann.
HIV
Eine ganz andere Persistenzstrategie liegt der HIV Infektion zu Grunde. Nach Infektion der Zielzelle wird das RNA-Genom mittels reverser Transkription in eine DNA-Kopie umgeschrieben, die als ‚Provirus' stabil in das Wirtszellgenom integriert wird. Damit wird das HIV-Genom integraler Bestandteil der Wirtszelle und bei jeder Zellteilung an die Tochterzellen weitergegeben. Besonders problematisch ist die Integration des HIV-Genoms in ruhende, d.h. teilungsinaktive Zellen, da diese keine HIV-Gene ablesen und damit keine viralen Antigene präsentieren, die durch das Immunsystem erkannt werden könnten. Diese Zellen können durch die aktuellen Therapien nicht erreicht werden. Darüber hinaus infiziert HIV vorwiegend CD4-positive T-Helfer Zellen, die eine zentrale Stellung in der Immunantwort haben. Dieser Zelltropismus erklärt auch das Krankheitsbild und den -verlauf der HIV-Infektion. Bedingt durch die Zerstörung der Wirtszellen (durch direkte, virus-induzierte Zelllyse sowie anderer postulierter Mechanismen) kommt es zu einer Schwächung des Immunsystems. AIDS-Patienten versterben letztlich nicht an der HIV-Infektion selbst, sondern an opportunistischen Infektionen, z.B. einer Pneumocysitis carinii-Pneumonie. AIDS ist somit die klinische Manifestation des fortgeschrittenen Immundefekts.
VIRALE STRATEGIEN ZUR ABWEHR DER IMMUNANTWORT
Die Pathogenese der chronischen Hepatitis B und C ist durch die körpereigene Immunantwort bedingt, d.h. die Zerstörung des Lebergewebes wird nicht durch den Erreger verursacht, sondern ist die Folge der Immunantwort auf die viralen Antigene (Immunpathogenese). Dabei führt die Infektion mit HBV oder HCV bei einzelnen Personen zu einer unterschiedlich stark ausgeprägten Immunantwort. Ist diese nicht oder nur schwach ausgeprägt, erfolgt eine nur geringe Zerstörung des Lebergewebes und der Patient ist ein "gesunder" Virusträger. Eine starke Immunantwort hingegen, häufig erkennbar am apparenten Infektionsverlauf, führt mit einer erhöhten Wahrscheinlichkeit zur Viruselimination und somit zur Ausheilung. Hauptproblem sind mittel stark ausgeprägte Immunantworten, die zwar zu keiner effektiven Hemmung der Replikation führen, die infizierten Zellen aber über Jahre oder Jahrzehnte attackieren. Daraus resultieren chronische Entzündungen, die dann zu den oben genannten Spätschäden führen können. Warum die Immunantwort bei den meisten HCV- und bei 10% der HBV-Infizierten versagt, ist nach wie vor unklar. Bei perinataler HBV-Übertragung ist die hohe Chronifizierungsrate vermutlich auf das unreife Immunsystem des Neugeborenen zurückzuführen. Im Erwachsenenalter scheinen HBsAg und HBeAg immunmodulatorische Effekte zu haben. Man nimmt an, dass HBsAg neutralisierende Antikörper abfängt und zusätzlich, wie HBeAg, eine Immuntoleranz induziert (Tab. 3).

Tab. 3: Einige Persistenzstrategien bei HBV, HCV und HIV
Auch HCV und HIV haben eine Reihe von ‚aktiven' Strategien entwickelt, mit denen sie der Immunantwort entkommen und eine persistente Infektion etablieren (Tab. 3). Beide Erreger greifen direkt in den natürlichen Ablauf der Immunantwort ein und interferieren sowohl mit der angeborenen als auch der erworbenen Immunität. Ein bekanntes Beispiel ist die NS3-Protease des HCV, die durch proteolytische Spaltung wichtiger Signaltransduktoren (Cardif und TRIF) die Induktion des Interferonsystems hemmt.
Zweifellos trägt auch die hohe Virusreplikation zur Immunevasion aller drei Erreger bei (Tab. 4). Pro Tag werden in einer infizierten Person zwischen 10 und 1,000 Milliarden Virusnachkommen produziert. Dazu kommt, dass die Polymerasen aller drei Viren keine Korrekturfunktion besitzen und deshalb eine hohe Fehlerrate haben. Die Konsequenz ist eine enorm hohe genetische Variabilität, bei der täglich Milliarden von Virusvarianten entstehen. Darunter sind auch solche, die vom Immunsystem nicht mehr oder nur schlecht erkannt werden (‚immune escape'), beispielsweise wenn Erkennungssequenzen (Epitope) für zytotoxische T-Zellen verändert sind.

Tab. 4: Zusammenfassung wichtiger Zahlen zur Virusdynamik und genomischen Variabilität

Tab. 5: Antivirale Therapie: Gemeinsamkeiten und Unterschiede
CHANCEN FÜR HEILUNG
Die Erfolge der Therapie der HBV-, HCV- und HIV-Infektion im Sinne einer Ausheilung sind sehr unterschiedlich, was im Wesentlichen auf die Art der Persistenzreservoirs zurückzuführen ist (Tab. 5). Bei der HBV-Infektion müsste die Therapie so lange durchgeführt werden, bis alle Zellen mit einer cccDNA eliminiert sind. Es ist unklar, wie lange das dauern würde, man geht jedoch von mehreren Jahren aus. Die besten Aussichten auf Heilung bestehen bei der HCV-Infektion, da dieses Virus kein eigentliches Persistenzreservoir besitzt und sich, nach allem was wir wissen, nur bei kontinuierlicher Replikation im Organismus halten kann. Das macht das Virus für antivirale Therapien angreifbar. Dazu kommt, dass Resistenzmutanten nur dann im Organismus erhalten bleiben, wenn sie eine hohe Replikationskompetenz (‚fitness') besitzen. Das ist ersten klinischen Studien mit Proteaseinhibitoren zufolge nicht der Fall. Im Gegensatz dazu können bei HBV und HIV Resistenzmutanten mit eingeschränkter fitness in Form der cccDNA bzw. dem Provirus archiviert werden und damit über Jahre und Jahrzehnte hinweg erhalten bleiben. Für die erfolgreiche Ausheilung der HIV-Infektion müssten alle Provirustragenden Wirtszellen eliminiert werden, was derzeit nicht möglich ist.
ANTIVIRALE THERAPIE UND RESISTENZENTWICKLUNG
Idealerweise dienen virus-eigene Enzyme als Angriffsziele für eine Therapie. Bei HBV ist dies die reverse Transkriptase (RT). Aktuell verfügbare Inhibitoren der HBV-RT sind Nukleotid- und Nukleosidanaloga wie beispielsweise Lamivudin oder Adefovir. Diese Substanzen imitieren einen DNA-Baustein, sind allerdings so modifiziert, dass sie nach einem Einbau in die DNA die Verlängerung dieser DNA-Kette verhindern (Kettenabbruch). Damit kommt die Synthese der viralen DNA zum Erliegen. Im Falle von HBV wird damit das Umschreiben des RNA-Prägenoms in die virale DNA verhindert und damit die Produktion von Nachkommenviren unterbunden. Trotz dieser Hemmung bleibt die cccDNA in einer vor Therapiebeginn infizierten Zelle unberührt.
Eine weitere Behandlungsoption bei chronischer Hepatitis B ist (pegyliertes) Interferon-alpha. Bei dieser Therapie besteht eine Heilungschance, allerdings liegt die Heilungsrate nur bei 20 bis 25%.
Die aktuelle Therapie der chronischen Hepatitis C besteht aus einer Kombination von pegyliertem Interferon-alpha und Ribavirin. Der Therapieerfolg hängt hier maßgeblich vom infizierenden Genotyp ab. Bei Infektionen mit Genotyp 2 und 3 liegt die Erfolgswahrscheinlichkeit der dauerhaften Elimination des Virus (‚sustained virologic response'; SVR) mit rund 80% deutlich höher als bei Infektionen mit Viren vom Genotyp 1 oder 4. Die zukünftige Therapie der chronischen Hepatitis C wird sich jedoch sehr bald verändern. Zurzeit sind eine große Anzahl von selektiven Inhibitoren in der präklinischen oder klinischen Erprobung, allen voran Inhibitoren der NS3-Protease und der Polymerase. Erste klinische Studien zeigen eine zum Teil sehr eindrückliche Hemmung der Virusvermehrung. Die Virämie kann unter dieser Therapie innerhalb weniger Tage um mehrere Größenordnungen abnehmen. Es zeigt sich allerdings, dass sehr schnell Resistenzen entstehen, vergleichbar der Situation zu HIV.
In der HIV-Therapie werden aktuell 27 verschiedene Inhibitoren aus fünf verschiedenen Wirkstoffklassen eingesetzt. Angriffsziele dieser Wirkstoffe sind der Viruseintritt (Entry-Inhibitoren), die Integrase (Integrasehemmer), die HIV-Protease (Proteasehemmer) sowie die RT (Nukleosid- und Nukleotidanaloga sowie Nicht-nukleosidische Reverse Transkriptase-Inhibitoren). Letztere binden direkt an die RT und hemmen deren Aktivität. Größtes Problem ist die Resistenzentwicklung, die bei der HIV-Infektion besonders ausgeprägt ist.
Die auftretenden Resistenzmutanten werden (analog zur cccDNA bei HBV) im Provirus fixiert und an die Nachkommenviren weitergegeben. Zur Unterdrückung oder Verzögerung der Resistenzentwicklung dient die 1996 eingeführte HAART (Highly Active Anti-Retroviral Therapy), eine Kombinationstherapie aus drei antiviral wirksamen Substanzen mit mindestens zwei unterschiedlichen Wirkprinzipien. Ein weiteres Therapieproblem besteht bei einer HIV-Infektion in den Virusreservoirs. HIV infiziert u.a. auch nicht proliferierende T-Zellen (Gedächtniszellen), die über Jahre oder Jahrzehnte hinweg stabil sind und von wo das Provirus jederzeit reaktiviert werden kann. Auch in diesen Reservoirs können Resistenzmutationen in Form des Provirus archiviert werden.
AUSBLICK
Aus der Erfahrung der HIV-Therapie heraus werden die zukünftigen Therapien der chronischen Hepatitis C sehr wahrscheinlich ebenfalls aus einer Kombination bestehen, initial vermutlich aus pegyliertem Interferon, Ribavirin und einem selektiven Wirkstoff. Fernziel wird sein, zum einen die SVR zu steigern, insbesondere bei Infektionen mit wenig reaktiven Genotypen, zum anderen Interferon und Ribavirin, die beide mit hohen Nebenwirkungen behaftet sind, durch besser verträgliche Medikamente zu ersetzen. Im Falle von HBV ist eine Kombination zurzeit nicht sinnvoll. Alle verfügbaren Wirkstoffe greifen an der RT an und führen zum Teil zu erheblichen Kreuzresistenzen. Glücklicherweise dauert die Entstehung solcher Resistenzvarianten bei HBV relativ lange, vermutlich weil das Virusgenom so kompakt organisiert ist, dass eine Mutation in dem Polymerase-Leseraster automatisch auch eines der überlappenden Lesenraster (insbesondere das für das HBsAg) gleichermaßen betrifft. Ein Beispiel ist das vor kurzem zugelassene Nukleosid-Analogon Entecavir, das in entsprechenden Studien bei therapienaiven Patienten im Lauf von 3 Jahren nur bei 0,7% zur genotypischen Resistenz geführt hat. Dennoch wäre es wünschenswert, dass auch zur Behandlung der chronischen Hepatitis B Wirkstoffe mit unterschiedlichen Angriffszielen zur Verfügung stünden. Eine Möglichkeit hier ist den Zusammenbau des Viruskapsides zu verhindern, wofür ein Wirkstoff entwickelt wurde (Heteroaryldihydropyrimidine), der zumindest in Zellkulturen hochpotent ist. Eine zweite Möglichkeit ist, den Eintritt des Virus in die Leberzellen mittels eines rekombinanten Teilstücks der Virushülle zu blockieren, über das das Virus an Leberzellen bindet.
Abschließend ist festzustellen, dass die auf den ersten Blick sehr unterschiedlichen Infektionen mit HBV, HCV und HIV eine Reihe von Gemeinsamkeiten haben, die Implikationen u.a. für das Verständnis der Pathogenese und die antivirale Therapie haben. So kann beispielsweise das Management der antiviralen Therapieresistenz als Leitmodell für die zukünftige Therapie insbesondere der chronischen Hepatitis C dienen. Es ist offensichtlich, dass sich hieraus Synergien ergeben, die eine verbesserte Bekämpfung dieser heimtückischen Infektionen ermöglichen.
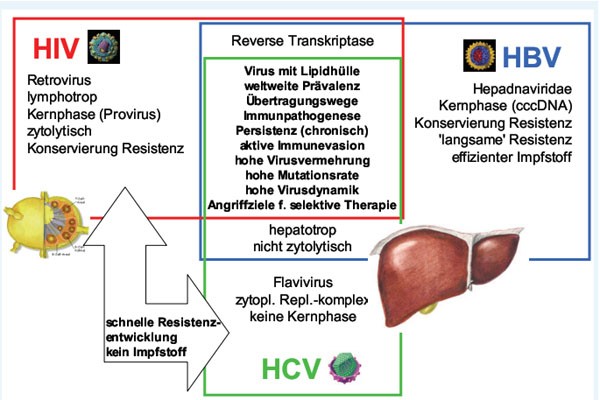
Zusammenfassung der Unterschiede und Gemeinsamkeiten der Erreger HBV, HCV und HIV und der von ihnen
verursachten Infektionen. Die farbigen Kästen sollen die für das jeweilige Virus zutreffenden
Eigenschaften zusammenfassen. Gemeinsame Eigenschaften sind in den jeweiligen Überschneidungen der Kästen
aufgeführt, bzw. im Doppelpfeil. Zytopl. Repl.-komplex, zytoplasmatischer Replikationskomplex.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
