59TH ANNUAL MEETING OF THE AMERICAN ASSOCIATION FOR THE STUDY OF LIVER
DISEASES - 31. OKTOBER-4. NOVEMBER 2008 IN SAN FRANCISCO
Die große Enttäuschung
Bislang galt die Jahrestagung der AASLD als der wichtigste hepatologische Kongress überhaupt. Dies war auf dem diesjährigen "Liver Meeting" nicht zu spüren, denn es gab weniger wissenschaftliche Highlights als erwartet und auch die Besucherzahl scheint rückläufig zu sein. Lediglich in den Postersessions herrschte zu Recht großer Andrang.
"Mehr als 7000 Forscher aus 55 Ländern" verkündeten die Veranstalter, doch das Moscone-Kongresszentrum in San Francisco wirkte keinesfalls überfüllt. Der große Plenarsaal war lediglich bei den Late-Breakern gut besetzt. Ein Grund mag sein, dass die Ergebnisse der klinischen Studien mit neuen Substanzen zum Teil schon bekannt waren. Die Firmen müssen die Daten aus börsenrechtlichen Gründen nach einer bestimmten Zeit veröffentlichen, was meist als Pressemittelung geschieht. Ein weiterer Grund mag die Politik der AASLD sein, die Tagung stärker als früher als amerikanische Plattform zu gestalten. So wurden zahlreiche amerikanische Studien zum Thema Individualisierung der HCV-Therapie anhand der Viruskinetik in Hauptsitzungen präsentiert. Dennoch gab es auch einige wirklich interessante neue Arbeiten.
PROTEASEHEMMER
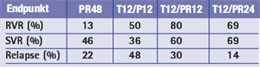
Tab. 1: PROVE-2. RVR, SVR und Relapse unter PR48 (48 Wochen PegIFN/RBV), T12/P12 (12 Wochen TVR/PegIFN), T12/PR12 (12 Wochen TVR/PegIFN/RBV) und T12/PR12 (12 Wochen TVR/PegIFN/RBV und 12 Wochen PegIFN/RBV)
Zu Telaprevir wurden die finalen Daten von PROVE-2 sowie die Zwischenanalyse von PROVE-3, zu Boceprevir eine Interimanalyse von SPRINT-1 präsentiert. Die abschließenden Ergebnisse von PROVE-2 bestätigen die früheren Auswertungen. Der Proteasehemmer Telaprevir führt in Kombination mit pegyliertem Interferon und Ribavirin zu einem besseren Ansprechen bei kürzerer Therapiedauer. Eine SVR erreichten unter Standardtherapie 46% der Patienten im Vergleich zu 60% unter 12 Wochen TVR/PegIFN/RBV und 69% unter 12 Wochen TVR/PegIFN/RBV plus 12 Wochen PegIFN/RBV (Tab. 1). Hauptnebenwirkung von Telaprevir war Hautausschlag. 7% der Telaprevir-Patienten brachen die Therapie wegen Exanthemen ab. Die Anämie stellte dagegen kein größeres Problem dar. Die Abbruchrate wegen Anämie lag bei 1%. Bei zwei Patienten wurde ein ungewöhnlich später Relapse beobachtet, nämlich nach 36 bzw. 48 Wochen. Diese Patienten hatten die Therapie schon früh abgebrochen. Die HCV-Sequenz beim Relapse entsprach dem ursprünglichen Virus, d.h. es waren keine Mutationen nachweisbar (Zeuzem S et al., #243). In der Studie SPRINT-1 zeichnete sich ein ähnlich gutes Ergebnis für den Proteasehemmer Boceprevir ab. Nebenwirkungen von Boceprevir waren insbesondere Anämien und Veränderungen des Geschmacksinns (Kwo P et al., #LB16).
GUTE NACHRICHT FÜR NONRESPONDER
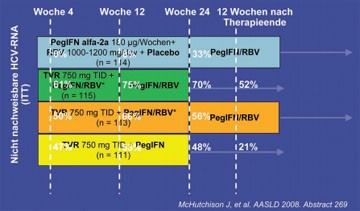
Abb. 1: PROVE 3 - Virologisches Ansprechen
In PROVE-3 werden 453 Nonresponder und Relapser einer Standardtherapie mit der Kombination TVR/PegIFN/RBV behandelt, wobei die Therapiedauer länger ist als bei den Patienten in PROVE-2 ist. Zu Woche 4 hatten 47%- 61% dieser schwer zu behandelnden Gruppe eine negative HCV-RNA erreicht. Eine SVR12 (Virusfrei 12 Wochen nach Therapieende) waren 52% der Patienten, die insgesamt 24 Wochen TVR/PegIFN/RBV erhalten hatten. Die SVR12 unterteilt nach Subgruppen lag bei den Relapsern bei 73%, den Nonrespondern bei 41% und bei den Patienten mit früherem viralen Durchbruch bei 44% (Abb. 1) (McHutchison J et al., #269).
POLYMERASEHEMMER
Zur Phase-2b-Studie Taribavirin (20, 25 und 30 mg/kg) vs. Ribavirin wurden die 24-Wochen-Daten präsentiert. Die virologische Wirksamkeit zu diesem Zeitpunkt war vergleichbar. Unter Taribavirin waren Anämien seltener, dafür aber milde Diarrhoen häufiger (Shiffman M et al., #1146).
Der nukleosidische HCV-Polymerasehemmer R7128 hatte bei 81 therapienaiven Patienten mit HCV GT1 in einer Dosierung von 1.000/1.500 mg/d in Kombination mit PegIFN/RBV bei 88%/85% vs. 19% unter PegIFN/RBV allein zur RVR geführt (Rodriguez-Torres M et al., #1899). In einer weiteren Studie an 25 Nonrespondern mit GT 2/3 war bei 90% nach vier Wochen keine HCV-RNA nachweisbar im Vergleich zu 60% unter Standardtherapie. Der mittlere Abfall der HCV-RNA betrug 5,0 log10 IU/ml (Gane E et al., #LB10).
PF-00868554 ist ein neuer nicht-nukleosidischer HCV-Polymerasehemmer, der in einer Phase-2-Studie über sieben Tage gegeben, die HCV-RNA um bis zu 2 log10 IU/ml verminderte (Hammond JL et al., #LB11).
NEUE SUBSTANZKLASSE
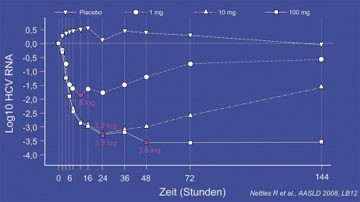
Abb. 2: Abfall der HCV-RNA nach einer Dosis 100 mg BMS-790052
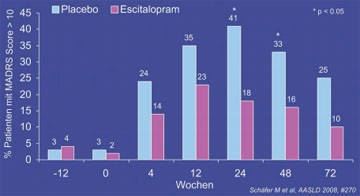
Abb. 3: Depression (MADRS > 10) zu verschiedenen Zeitpunkten
Viele neue Substanzen sind in der Pipeline und zwar nicht nur viele Proteasehemmer (MK-7009/ Lawitz E et al., #211; BI 201335/ Manns M et al., #1849; ITMN191/R7227/ Forestier N et al., #1874; TMC435350/Manns M et al., #1895, #1912 usw.), sondern auch eine komplett neue Substanzklasse. Der NS5A-Inhibitor BMS-790052 ("Replikationsregulator") greift an einer anderen Stelle der HCV-RNA an als die bisher bekannten Substanzen. In einer Proof-of-concept-GT1 Studie erhielten 18 Patienten mit HCV Genotyp 1 einmalig 1, 10 oder 100 mg BMS-790052. Unter 100 mg BMS-790052 fiel die HCV-RNA innerhalb von 48 Stunden im Schnitt um -3,6 log10. Diese Viruslast-Senkung hielt nach der einmaligen Gabe mindestens 144 Stunden (!) an (Abb. 2). BMS-790052 kann einmal täglich gegeben werden. Gravierende Nebenwirkungen wurden nicht beobachtet (Nettles R et al, # LB12).
THERAPIEMANAGEMENT
Ein häufiger Grund für den Abbruch der HCV-Therapie sind Anämie, Thrombopenie und Neutropenie. In den USA ist es durchaus üblich hier Wachstumsstimulierende Faktoren zu geben, doch dies scheint die Heilungsrate nicht zu verbessern. In einer amerikanischen Studie (n=152/ GT1) erhielt die Hälfte der Patienten bei Bedarf adjuvant Erythropoetin und Granlozyten-stimulierenden Faktor. Bei Thrombozytopenie wurden keine Wachstumsfaktoren gegeben, aber die Regeln zur Dosisreduktion weiter gefasst (Reduktion bei Thrombozyten <80.000 vs. <55.000/µl; Abbruch bei Thrombozyten <50.000 vs. <30.000/µl). Nur 16 Patienten (23%) im Wachstumsfaktoren-Arm brauchten eine adjuvante Therapie. Ein Therapieabbruch war in beiden Gruppen gleich häufig, eine Dosisreduktion in der Gruppe mit adjuvanter Therapie seltener (28% vs. 18%). Dennoch fand sich hinsichtlich EVR, ETR, SVR und Relapse kein signifikanter Unterschied (Kugelmas M et al., #209).
Einen klaren positiven Ausgang hatte dagegen die deutsche Studie zur Prävention der Depression mit Citalopram. In CIPPAD, an der 204 Patienten teilnahmen, hatten die Patienten, die zwei Wochen vor Beginn und dann die ganze HCV-Therapie kontinuierlich mit 10 mg/d Escitalopram behandelt wurden, signifikant weniger schwere bzw. milde Depressionen (14% vs. 49% bzw. 17% vs. 35%). Ein interessanter Nebenbefund war hier das lange Anhalten der psychischen Veränderung über das Therapieende hinaus (Abb. 3) (Schäfer M et al., #270).
VERLAUF DER AKUTEN HEPATITIS C


Abb.: Prof. Thomas Berg, Berlin, präsentiert die deutsche CIPPAD-Studie
Der Verlauf der akuten Hepatitis C wurde in einer prospektiven Studie aus Georgien beobachtet. Dazu wurde Blut von insgesamt 7.000 Blutspendern und 3.000 Drogengebrauchern in Gruppen gepoolt und auf HCV-RNA untersucht. Es wurden 16 akute HCV-Infektionen vor der Serokonversion detektiert, sieben bei den Blutspendern und neun bei den Drogengebrauchern (10 GT 1, 3 GT2, 3 GT3). Lediglich vier Patienten waren symptomatisch, wobei drei Patienten neben anderen klinischen Zeichen einen Ikterus entwickelten. 12 Patienten waren klinisch asymptomatisch. Vier Patienten in dieser Gruppe hatten nicht einmal eine erhöhte GPT und zwei Patienten eliminierten HCV bereits vor der Serokonversion. Die HCV-Viruslast stieg im Verlauf der akuten Infektion rasch an, erreichte zu Woche 4 das Maximum und blieb dann stabil bis Woche 9. Danach kam es zum Abfall und 4/16 Patienten waren zu Woche 16-18 HCV-frei (Tsertsvadze T et al., #29).
In einer weiteren Arbeit wurden aufbewahrte Blutproben (retrospektiv 2 Jahre) und aktuelle Blutproben (prospektiv mindestens 1 Jahr nach erster positiver HCV-RNA) einer großen holländischen Kohorte von Drogengebrauchern (IDU) auf HCV-RNA und HCV-Antikörper untersucht. 96 akute HCV-Infektionen wurden dokumentiert. 40% der IDU eliminierten HCV, wobei die Infektion bei Frauen und HIV-Negativen häufiger spontan ausheilte (Von den Berg C et al., #30).
HEPATITIS B
Bei der chronischen Hepatitis B wurden verschiedene Langzeitdaten und Switch-Studien zu Nukleos(t)iden gezeigt, die keine Überraschungen boten. In den Studie 102 und 103, in denen HBeAg-negative bzw. -positive Patienten nach 48 Wochen Tenofovir (TDF) vs. Adefovir (ADF) von ADF auf TDF umgestellt wurden, zeigte sich auch nach 96 Wochen eine anhaltend gute Wirksamkeit von TDF. Bei den HBeAg-positiven Patienten kam es bei gleich vielen Patienten unter TDF und ADF zu HBeAg-Verlust bzw. -Serokonversion. Resistenzen wurden keine beobachtet (Marcellin P et al., #146; Heathcote J et al., #153).
Zu Entecavir wurden ebenfalls zahlreiche Arbeiten präsentiert. Die 5-Jahres-Daten belegen eine nach wie vor gute Wirksamkeit. 94% der HBeAg-positiven Patienten haben eine HBV-DNA <300 Kopien/ml und die Resistenzrate ist mit <1% gleich bleibend niedrig (Han SB et al., #893). In der Leberhistologie zeigte sich zudem, dass die langjährige Suppression der HBV-Replikation die Fibroseprogression in der Leber bremst bzw. sogar zu einem Rückgang des bindegewebigen Umbaus führen kann (Liaw Y et al., #894).
ENTECAVIR IM ALLTAG
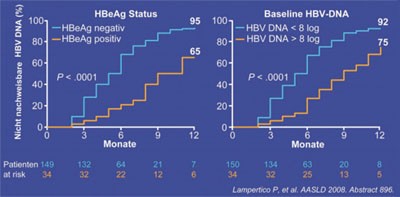
Abb. 4: Entecavir im klinischen Alltag. Virologische Wirksamkeit und Prädiktoren für Ansprechen
Entecavir ist auch im klinischen Alltag gut wirksam. In einer italienischen Untersuchung lag die Viruslast von 199 therapie-naiven Patienten nach einem Jahr bei 89% <12 IU/ml, wobei HBeAg-positive und hochvirämische (HBV-DNA >8 log Kopien/ml) Patienten schlechter abschnitten (Abb. 4). Es wurden kein virologischer Durchbruch und keine Resistenz beobachtet. Vor Therapiebeginn bestehende Polymorphismen hatten keinen Einfluss auf den Therapieerfolg. Lediglich drei Patienten ohne Resistenzmutationen bei Baseline hatten unter Entecavir eine persistierende niedrige Virämie. Die Resistenzanalyse nach sechs und 12 Monaten ergab keine neuen Mutationen. Ein Patienten eliminierte HBsAg (Lampertico P et al., #896).
Dass auch Telbivudin zu den stark wirksamen Nukleosiden gehört, bestätigt eine Arbeit aus Korea. 44 therapienaive HBeAg-positive Patienten wurden entweder mit Telbivudin oder Entecavir behandelt. In den ersten 12 Wochen waren die virale Clearance, die Rate des Abfalls der infizierten Zellen sowie die Effizienz der Suppression der Virusreplikation vergleichbar (Don Jin Suh et al., #921).
VORBEHANDELTE PATIENTEN
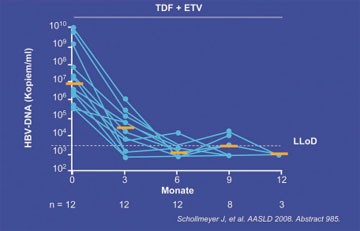
Abb. 5: Tenofovir plus Entecavir bei HBV-Multiresistenz. Virologisches Ansprechen
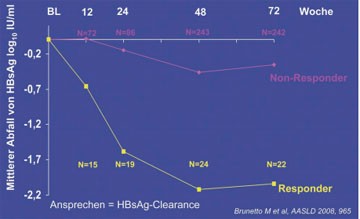
Abb. 6: Zusammenhang zwischen schnellem und frühem Abfall von HBsAg während der Therapie und
HBsAg-Clearance 4 Jahre nach Therapie


Patienten mit Lamivudin-Resistenz und YMDD-Mutation können prinzipiell auch mit Interferon behandelt werden. Das belegt eine Zwischenanalyse einer Untersuchung an 56 Patienten mit YMDD und 82 Patienten ohne Resistenz, die 48 Wochen lang mit pegIFN und im Fall einer YMDD-Mutation in den ersten 12 Wochen zusätzlich mit Lamivudin behandelt wurden. 30% vs. 26% der Teilnehmer verloren HBeAg und bei zwei Patienten in jeder Gruppe fiel die Viruslast unter die Nachweisgrenze (Suh DJ et al., #981).
Eine interessante Möglichkeit bei Multiresistenz untersuchte die Hamburger Gruppe um Petersen. Sie behandelte 12 Patienten (9 HBeAg-positive, 82% GT D, mittlere Viruslast 5x106 Kopien/ml) mit Entecavir plus Tenofovir. Nach sechs Monaten war die HBV-DNA bei 9/12 Patienten <400 Kopien/ml abgefallen (Abb. 5). Die Verträglichkeit der Kombination war gut (Schollmeyer J et al., #985).
Bei Zirrhose-Patienten geht es darum, die Viruslast zuverlässig -und langfristig zu senken. Die deutschen Leitlinien empfehlen deshalb den Einsatz potenter Nukleos(t)ide in Kombination, um Resistenzen zu verhindern. In einer italienischen Studie wurden 82 Lamivudin-resistente Zirrhose-Patienten auf der Warteliste für eine Lebertransplantation anders behandelt. Sie erhielten entweder Entecavir 1 mg/d oder Adefovir 10 mg/d oder Adefovir 10 mg/d plus Lamivudin 100 mg/d. Innerhalb der ersten 6 Monate erreichten mehr Patienten unter Entecavir eine nicht nachweisbare HBV-DNA (85% vs. 40% vs. 60%). Das Leberzirrhose-Stadium besserte vergleichbar sich in allen Gruppen. Resistenz- und Langzeitdaten liegen allerdings nicht vor (Pellicelli A et al., #885).
PRÄDIKTOREN FÜR HBsAg-VERLUST
Der HBsAg-Verlust scheint anhand der HBsAg-Konzentration vorhersagbar zu sein. Die Arbeitsgruppe um Marcellin analysierte die HBsAg-Spiegel von 250 Patienten, die im Rahmen der Studie pegyliertes Interferon (peg-IFN) vs. Lamivudin vs. Kombination aus beidem, 48 Wochen lang mit pegIFN behandelt wurden. 156 dieser Patienten wurden mittlerweile vier Jahre lang beobachtet. Nach vier Jahren hatten signifikant mehr Patienten mit einer HBsAg-Konzentration =1.500 IU/ml (23% vs. 4%) und einer HBV-DNA =80 IU/ml (31% vs. 8%) bzw. =2.000 IU/ml (39% vs. 12%) HBsAg eliminiert. Dieser Unterschied zeigte sich bereits nach 6 Monaten (HbsAg-Verlust 7% vs. 2%, HBV-DNA =80 IU/ml 39% vs. 9%, HBV-DNA =2.000 IU/ml 59% vs. 34%).
Die Wahrscheinlichkeit, HBsAg nicht zu verlieren, lag für Patienten mit einem HBsAg-Spiegel >1.500 IU/ml bei 96%, während die Chance, HBsAg zu verlieren, für Patienten mit HBsAg =1.500 IU/ml 23% betrug (Abb. 6) (Marcellin P et al., #919; Brunetto M et al., #965).










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
