18. Welt Aids Kongress in Wien
Neue Therapiestrategien
Der WeltAidsKongress fand diesmal in Wien statt, und das nicht ohne Grund. Die International Aids Society (IAS) hat den Blick nach Osten gewandt, insbesondere nach Osteuropa. Während weltweit die Zahl der Neuinfektionen von 2001 bis 2008 um 17% gefallen ist, steigt die Zahl der HIV-Neuinfektionen in Osteuropa und Zentralasien (sprich China) stetig weiter. Derzeit leben dort 1,5 Millionen HIV-Infizierte, wobei innerhalb Europas die Ukraine und Russland am stärksten betroffen sind. Die Mehrzahl der Infizierten in diesen Gebieten ist sehr jung, meist zwischen 15 und 29 Jahre alt.
Hauptgrund für die ungebremste Ausbreitung von HIV ist nach Meinung der IAS eine falsche Drogenpolitik, die Drogengebraucher kriminalisiert und diskriminiert. Der Kongresspräsident Julio Montaner bezeichnete die Haltung der osteuropäischen Politiker in dieser Frage als „Vernachlässigung an der Grenze zur Kriminalität“. Kein einziger Politiker war zur Konferenz erschienen und als einzige Repräsentantin eines osteuropäischen Landes hatte die First Lady von Georgien, Sandra Roelofs die „Vienna Declaration“ unterzeichnet. In diesem Papier fordert die IAS einen Evidenz-basierten Umgang mit dem Drogenabusus, d.h. Harm Reduction und Substitution. Derzeit benutzen rund 60% der Drogenabhängigen in Osteuropa Spritzen gemeinsam, Substitutionsprogramme gibt es nur in wenigen Ländern und in den Ländern der ehemaligen Sowjetunion haben Drogengebraucher keinen Zugang zum Gesundheits- und Sozialsystem.

Photos: Ramona Pauli
HIV-Therapie ist Menschenrecht
Das Motto der Konferenz lautete „RIGHTS HERE, RIGHT NOW“. Gemeint ist damit die Bedeutung der Menschenrechte für die HIV-Bekämpfung. „Ohne Menschenrechte wird es keinen weltweiten Zugang zur HIV-Therapie geben“, erklärte die Aids-Aktivistin Paula Akugizibwe aus Südafrika, denn die am stärksten betroffenen Gruppen wie Drogengebraucher, Sexarbeiter, Homosexuelle, Gefangene usw. sind weltweit die am stärksten diskriminierten Menschen und in vielen Ländern werden gerade sie von der Prävention und Therapie ausgeschlossen.
Wer soll das bezahlen?
Ein weiteres wichtiges Thema, das sich durch die ganze Konferenz zog, ist die Finanzierung des weltweiten Zugangs zu ART und Prävention. Die Bekämpfung der HIV-Pandemie, die zumindest in Afrika erste Erfolge zeigt, kostet viel Geld. Heute erhalten rund 5 Millionen Menschen eine antiretrovirale Therapie, doch das ist nicht genug. Auf zwei Patienten, die eine HAART beginnen, kommen fünf Neuinfektionen und allein die neue WHO-Empfehlung, die ART bei <350 Helferzellen/µl einzuleiten, hat die Zahl der Behandlungsbedürftigen verdoppelt. Doch die Gelder fließen nicht mehr wie früher. Der IAS-Präsident Julio Montaner sowie Aktivisten forderten die G8-Länder daher lautstark auf, ihre Versprechen dem Global Fund gegenüber zu halten. Gute Ideen, wie man das Problem lösen kann, fehlen aktuell. Selbst Bill Gates und Bill Clinton schienen ratlos. Außer den üblichen Vorschlägen wie Einsparungen, bessere Kosten-Nutzen-Relation, Abgaben usw. gab es nichts Neues – außer vielleicht dem „Angriff” einer Aktivisten-Gruppe, die das Luxusleben von Politikern in Entwicklungsländern anprangerten.
Heilung auf der Agenda
Das Thema Heilung ist nicht nur gesellschaftsfähig geworden, es steht mittlerweile sogar ganz oben in der Prioritätenliste der internationalen Wissenschaftler-Aktivisten. Bei der Kongresseröffnung sprach Sharon Lewin, Melbourne, zum Thema. Sie benannte zwei Möglichkeiten der Heilung, nämlich die Eradikation und die Remission bzw. funktionelle Heilung sowie drei große Probleme auf dem Weg dahin: Erstens, die Persistenz der latent infizierten Zellen, zweitens die residuelle Replikation trotz potenter HAART und drittens die anatomischen Barrieren für die HAART vor latent infizierten Reservoiren (z.B. ZNS, Darm und Genitaltrakt). Strategien zu Überwindung dieser Hürden seien eine Optimierung der HAART bei früher Therapie, die Elimination der latent infizierten Zellen sowie eine „Resistenzbildung“ der Zellen gegen HIV. Zur Aktivierung von latenten Zellen laufen derzeit Untersuchungen mit IL-7, Histondeactylase- und Methylierungshemmer, zur Resistenzbildung werden gentherapeutische Ansätze verfolgt.
Prävention: Mikrobizide und mehr
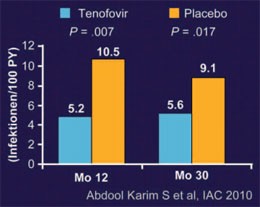
Abb. 1: CAPRISA: Tenofovir-Vaginalgel reduziert HIV-Inzidenz
um 39%
Bei der Prävention gab es Grund zum Feiern. Nach einer langen Reihe von Misserfolgen schützte in der CAPRISA-Studie erstmal ein Mikrobizid Frauen vor einer HIV-Infektion, was bei der Präsentation stehenden Applaus auslöste. Das Vaginalgel, das 1% Tenofovir enthält, wurde an 889 sexuell aktiven Südafrikanerinnen gegen Placebo geprüft. Das Mikrobizid verminderte das Risiko einer HIV-Infektion der Frauen (die alle zudem zu Safer Sex beraten wurden) im Verlauf der 2,5-jährigen Beobachtungszeit insgesamt um 39% (p=0,017) (Abb. 1). Das Konfidenzintervall ist jedoch so weit, so dass die wirkliche Effektivität zwischen 6% und 60% liegt. Frauen, die das Gel bei vier von fünf Sexakten anwandten, hatten sogar ein um 54% geringeres HIV-Risiko. Gleichzeitig wurde das Risiko einer Herpes genitalis-Infektion halbiert. Die Verträglichkeit war gut und im Falle einer HIV-Neuinfektion wurde keine Tenofovir-Resistenz beobachtet (TUSS0504 Sokal D et al.).
PrEP
Auch zur PrEP (Präexpositionsprophylaxe) gab es neue Daten, allerdings immer noch nicht zur Effektivität. In einem Latebreaker der amerikanischen CDC zeigte Tenofovir einmal täglich im Vergleich zu Placebo eine sehr gute Verträglichkeit. Die Studie war jedoch zu klein für eine statistische Aussage zur Wirksamkeit. Es wurden drei HIV-Neuinfektionen (alle in der Placebogruppe) jeweils ohne Tenofovir-Resistenz beobachtet (FRLBC102 Grohskopf L et al.). Zahlreiche weitere Untersuchungen zur PrEP laufen derzeit. Das IAVI (International AIDS Vaccine Initiative) stellte erste Daten einer Pilotstudie vor, in der die Sicherheit und Adhärenz bei Tenofovir/Emtricitabin täglich vs. intermittierend (Montag und Freitag) plus postkoital geprüft wurde. Probleme hinsichtlich der Verträglichkeit gab es nicht. Bei der Adhärenz zeigten sich jedoch Schwächen bei der postkoitalen Dosis (MOPE0369 Mutua D et al.). Möglicherweise hat die PrEP sogar im Falle einer Infektion günstige Effekte. Im Tierversuch jedenfalls kam es bei Infektionen unter PrEP zu einer geringeren Virämie und besseren Immunantwort (THBS0303 Kersh E et al.).
Zur ART als Prävention gab es viel politische Agitation, aber kaum neue Daten. Als Beweis für den günstigen Einfluss der ART auf HIV-Neuinfektionen wurden immer wieder die Beobachtung von diskordanten heterosexuellen Paaren, bei denen die ART das Transmissionsrisiko um 92% verminderte (CROI 2010), sowie die epidemiologischen Zahlen aus Vancouver zitiert. Neu war lediglich die Beobachtung aus Dänemark, dass die Zahl der HIV-Neuinfektionen trotz immer mehr HIV-Infizierter stabil war (MOAC0103, Cowan S et al.). Zudem scheinen viele Übertragungen im Stadium der akuten HIV-Infektion zu passieren. Eine Untersuchung basierend auf den Zahlen aus Malawi kommt hier zu dem Schluss, dass 38% der neuen HIV-Infektionen von Partnern mit einer akuten HIV-Infektion übertragen wurden (FRAX0102 Serna-Bolea C et al.).
Neue und alte Komplikationen
Zu den Langzeitkomplikationen an Herz, Knochen, Niere und ZNS gab es gute Zusammenfassungen und auch viele Arbeiten, die allerdings keine wesentlich neuen Erkenntnisse erbrachten. So wurde in der ACTG 5142 (EFV + 2NRTI vs LPV/r + 2NRTI vs LPV/r + EFV) innerhalb der ersten 48 Wochen ein Abfall der Knochendichte beobachtet, der bis Woche 96 anhielt und unter NRTI (insbesondere Tenofovir) stärker ausgeprägt war (WEAB0304 Huang et al.). Auch eine spanische Arbeitsgruppe fand bei der Analyse von DEXA-Scans (2000-2009) eine hohe Prävalenz von Osteopenie/Osteoporose. Risikofaktoren waren hier neben Alter, Geschlecht, niedrigem BMI die Einnahme von Proteasehemmern und Tenofovir (THPDB104 Bonjoch A et al.).
Interessant war die Beschreibung einer neuen „CD8-Infiltrations-Enzephalitis“, charakterisiert durch schwere neurologische Ausfälle mit typischen radiologischen und histologischen Veränderungen. Die 14 Patienten hatten akute oder subakute Kopfschmerzen, Verwirrtheit, Krämpfe, motorische und kognitive Störungen. Im Liquor fand sich eine nahezu ausschließliche CD8-Lymphozytose. Das MRT zeigte Leukoplakien mit perivaskulären hyperintensiven T2Signalen und in der Hirnbiopsie waren Ödeme, Astrozyten- und Mikroglia-Aktivierung sowie perivaskuläre und intraparenchymatöse CD8-Infiltrationen zu sehen. Das Syndrom trat meist im Rahmen einer Immunrekonstitution, einer HAART-Pause oder einem banalen viralen Infekt auf. Klinisch sprachen die Patienten rasch auf Steroide (meist plus HAART-Intensivierung) an. Dennoch hatten vier Jahre später zwei Drittel der Betroffenen Folgeschäden (WEAB0303 Lescure F-X et al.).
Neue Therapiestrategien
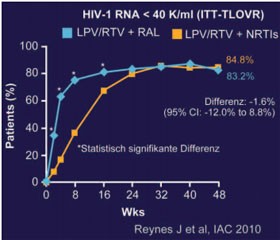
Abb. 2: PROGRESS: 48 Wochen. Virologische Wirksamkeit
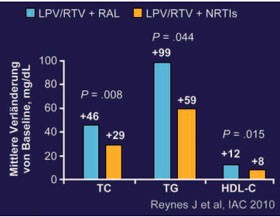
Abb. 3: PROGRESS: 48 Wochen. Lipide
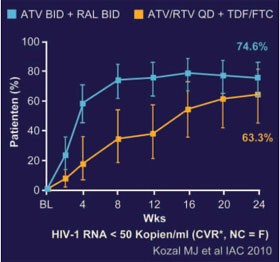
Abb. 4: SPARTAN: 24 Wochen.
Virologische Wirksamkeit
Schon lange wird über mögliche neue Therapiestrategien diskutiert. Endlich wurden dazu Studien vorgestellt, die sich folgendermaßen einteilen lassen:
- Nukefreie Firstline
Firstline mit Raltegravir bzw. Maraviroc - Raltegravir als 3rd Agent
Switch von einem geboosterten
Proteasehemmer auf Raltegravir
Raltegravir plus ABC/3TC - Erhaltungstherapie
Geboosterter PI/r plus FTC
PI/r-Monotherapie
Nukefreie Firstline-Regime
Lopinavir/r + Raltegravir
In der PROGRESS-Studie wurde erstmals ein Nukefreies Proteasehemmer-basiertes Firstline-Regime geprüft, und zwar Lopinavir/r in Kombination mit dem Integrasehemmer Raltegravir vs. dem Nuke-Backbone TDF/FTC. An der kleinen Pilotstudie nahmen 106 therapienaive Patienten teil. Jetzt wurden die 48-Wochen-Daten präsentiert. Nach rund einem Jahr hatten unter beiden Regimen gleich viele Patienten das Therapieziel einer Viruslast unter der Nachweisgrenze erreicht (83% vs. 85%), wobei die Viruslast der Patienten in der Raltegravir-Gruppe ähnlich wie in der STARTMRK-Studie (TDF/FTC plus RAL vs. Efavirenz) initial deutlich rascher abfiel (Abb. 2). Ein virologisches Versagen wurde nur bei 3 Patienten (1,5%) beobachtet. Bei einem Patienten in der Raltegravir-Gruppe wurde N155H nachgewiesen und bei einem Patienten in der NRTI-Gruppe M184V. Die Verträglichkeit der beiden Regime war gleichermaßen gut. Wegen Nebenwirkungen schieden lediglich vier Patienten (1,9%) aus. Eine Diarrhoe wurde bei 8% der Patienten in der Raltegravir-Gruppe und bei 13% in der TDF/FTC-Gruppe beobachtet. Nebenwirkungen, die unter Raltegravir signifikant häufiger auftraten, waren eine Erhöhung der Kreatininkinase (>4xULN 13% vs. 4%) sowie interessanterweise höhere Lipide, insbesondere Gesamtcholesterin, HDL-Cholesterin und Triglyceride (Abb. 3) (MOAB0101 Reynes J et al.).
Atazanavir plus Raltegravir
In der kleinen Pilotstudie SPARTAN wurden 104 therapienaive Patienten entweder mit Atazanavir/Ritonavir 300/100 plus
TDF/FTC oder Atazanavir 600 mg plus Raltegravir behandelt. Bei der ersten geplanten Auswertung nach 24 Wochen lag die
Viruslast bei etwa gleich vielen Patienten unter der Nachweisgrenze (81% vs. 70%, NC=M) (Abb. 4). Unter dem
ungeboosterten Atazanavir in der höheren Dosierung war allerdings ein Anstieg des
Bilirubins und Therapieabbrüche
(6,3% vs. 0) deutlich häufiger. Ferner kam es bei vier Patienten zur Entwicklung einer Raltegravir-Resistenz. Die Studie
wurde daraufhin beendet (THLBB204 Kozal MJ et al.).
Atazanavir/r plus Maraviroc QD
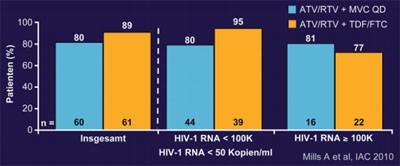 Abb. 5: A4001078: 24 Wochen. Virologische Wirksamkeit
Abb. 5: A4001078: 24 Wochen. Virologische Wirksamkeit
121 therapienaive Patienten erhielten in der Phase-2-Studie A4001078 entweder ATV/r 300/100 plus TDF/FTC oder plus Maraviroc 150 mg QD. Nach 24 Wochen war der virologische und immunologische Effekt vergleichbar (VL <50 K/ml 80% vs. 89%, CD4-Anstieg 195/µl vs. 173/µl) (Abb. 5). Bei fünf Patienten wurde ein virologisches Versagen beobachtet, jedoch ohne Nachweis von Mutationen oder Tropismusshift. Gravierende Nebenwirkungen waren ohne den Nuke-Backbone seltener, relevante Hyperbilirubinämien jedoch häufiger (THLBB203 Mills A et al.).
Fazit
In allen drei Pilotstudien erwies sich das Nukefreie Firstline-Regime mit einem Proteasehemmer als Third Agent virologisch als genauso gut wie das herkömmliche Regime mit einem Nuke-Backbone. Die häufigere Entwicklung einer Raltegravir-Resistenz in SPARTAN geht möglicherweise auf die geringere Resistenzschwelle des ungeboosterten Proteasehemmers zurück. Der Vorteil des rascheren Abfalls der Viruslast unter Regimen mit Raltegravir ist noch unklar. Deutlich zeigen jedoch alle drei Studien, dass Nukefrei nicht gleich Nebenwirkungsfrei heißt.
Raltegravir als Third Agent SHIELD
35 therapienaive Patienten ohne HLA B5701 wurden in der kleinen offenen Pilotstudie SHIELD mit ABC/3TC plus Raltegravir BID behandelt. Nach 48 Wochen hatten 32/35 Patienten eine Viruslast <50 Kopien/ml. 5/35 (14%) Patienten hatten Nebenwirkungen Grad 2-4. Ein Patient brach wegen Nebenwirkungen ab. Es wurde kein virologisches Versagen und kein schweres Ereignis beobachtet (THPE0112 Young B et al.).
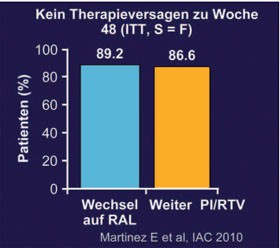 Abb. 6: SPIRAL: 48 Wochen. Virologische
Wirksamkeit
Abb. 6: SPIRAL: 48 Wochen. Virologische
Wirksamkeit
Switch: ODIS/SPIRAL
In der ODIS-Studie wurde bei 222 Patienten (42% früher suboptimal eingestellt, 68% früher virologisches Versagen, 33% mindestens eine NRTI-Resistenz) der geboosterte Proteasehemmer durch Raltegravir BID oder QD ersetzt. Patienten in der BID-Gruppe, die 12 Wochen nach der Umstellung weiterhin supprimiert waren, wurden dann nach Randomisierung entweder mit Raltegravir BID oder QD weiterbehandelt. Nach 12 bzw. 24 Wochen kam es bei insgesamt 6,5% der Patienten zum virologischen Versagen. Patienten mit schlechteren Ausgangsbedingungen versagten noch viel häufiger. So wurde z.B. bei Patienten mit aktuellen NRTI-Resistenzen sogar in bis zu 17,7% der Fälle ein virologisches Versagen beobachtet. Bei Patienten ohne negative Prädiktoren waren Raltegravir BID und QD gleichermaßen gut wirksam. Die Veränderung der Lipide war mit einem Abfall der Triglyceride um rund 10% nur gering ausgeprägt (MOAB0102 Vispo E et al.).
In der Spiral-Studie hat der Switch dagegen gut geklappt. In dieser offenen Studie wurden bei 286 Patienten (im Schnitt sechs Jahre komplett supprimiert, 40% früher virologisches Versagen, 25% NRTI-Mutation) entweder die bisherige Therapie mit einem geboosterten Proteasehemmer plus Nukleosidbackbone unverändert weitergeführt oder der Proteasehemmer durch Raltegravir ersetzt.
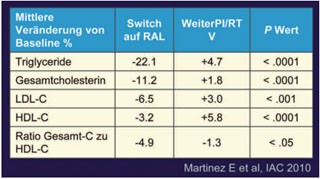 Abb. 7: SPIRAL: 48 Wochen. Lipide
Abb. 7: SPIRAL: 48 Wochen. Lipide
Nach 48 Wochen lag die Viruslast bei gleich vielen Patienten unter der Nachweisgrenze (ITT, S=F) (Abb. 6), und zwar bei allen Subgruppen (Patienten mit früherem virologischen Versagen oder suboptimaler Therapie oder NRTI-Mutationen). Die Verträglichkeit war in beiden Gruppen sehr gut. Die Lipidwerte besserten sich jedoch in der Raltegravir-Gruppe (Abb. 7) (MOAB0103 Martinez et al.).
Fazit
Der Switch von einem geboosterten Proteasehemmer auf Raltegravir bei supprimierten Patienten wurde bereits in der SWITCHMARK-Studie untersucht. Damals hatten insbesondere Patienten mit einem Therapieversagen in der Vorgeschichte schlecht abgeschnitten. In der ODIS-Studie hat der Switch erneut bei Patienten mit alten und bestehenden NRTI-Resistenzen nicht gut geklappt. In der SPIRAL-Studie funktionierte der Wechsel auf Raltegravir dagegen problemlos. Die SPIRAL-Patienten waren nämlich eine „Positiv-Auswahl“. Sie waren im Mittel sechs Jahre supprimiert und nur ein Viertel hatte NRTI-Mutationen in der Vorgeschichte. Im Hinblick auf die Verträglichkeit hatte der Switch keine großen Konsequenzen. Lediglich die Lipide zeigten einen positiven Trend. Offen bleibt somit also die Frage: Warum sollte man Patienten, die ein Regime jahrelang gut vertragen, ohne Not umstellen?
Erhaltungstherapie
ATLAS: ATV/r plus 3TC
Das Konzept einer „schlanken“ Erhaltungstherapie untersuchte eine italienische Arbeitsgruppe in der ATLAS-Studie. Bei
36 Patienten wurde nach mehr als dreimonatiger virologischer Suppression (Mittel 663 Tage) unter Atazanavir/Ritonavir
plus TDF/FTC oder ABC/3TC Tenofovir bzw. Abacavir abgesetzt. Die Patienten hatten in der Vorgeschichte kein vorheriges
virologisches Versagen sowie keine Resistenz gegen Atazanavir bzw. Lamivudin. 24 Wochen später waren alle 36 Patienten
nach wie vor optimal supprimiert. Doch ohne Tenofovir hatte sich die Nierenfunktion erwartungsgemäß gebessert (GFR +0,7
ml/Min, Kreatinin -0,08 mg/dl). Dem gegenüber standen ungünstige Veränderungen anderer Laborparameter. Bei 18/36
Patienten kam es zu einem deutlichen Anstieg des
Bilirubins bzw. der Blutfette und zwar ohne Veränderung der
Atazanavir-Spiegel nach Absetzen von Tenofovir/Abacavir (THLBB207 De Luca A et al.).
MONET: DRV/r
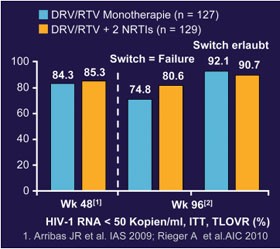
Abb. 8: MONET: 96 Wochen. Virologische Wirksamkeit
In MONET wurden 256 Patienten mit einer Viruslast <50 Kopien/ml für mindestens sechs Monate mit DRV/r 800/100 QD allein oder in Kombination mit einem Nuke-Backbone weiterbehandelt. Nach 48 Wochen war die Monotherapie gleich gut (TLVOR 86, 2% vs. 87,8%), nach 96 Wochen jedoch unterlegen. Den primären Endpunkt einer Viruslast <50 Kopien/ml ohne Therapiewechsel bzw. Intensivierung erreichten unter der Monotherapie 74,8%, unter der Tripletherapie 80,6% der Patienten (Abb. 8). Einziger Prädiktor für das Therapieversagen war eine HCV-Koinfektion, wobei 90% in dieser Gruppe Drogengebrauch in der Anamnese aufwiesen. Bei einem Patienten unter Monotherapie wurde eine Darunavir-assoziierte Mutation (L33F) und bei einem Patienten unter Tripletherapie M184V plus drei PI-Mutationen (I54V, V82T und L90M) beobachtet (THLBB209 Rieger A et al.).
Ein mögliches Problem der Monotherapie ist die Penetration des Genitaltraktes sowie des ZNS durch Proteasehemmer. In
der Swiss Cohort Study wurden 27 Patienten mit einer Viruslast unter der Nachweisgrenze in Blut und Liquor rund fünf
Jahre lang mit einer Monotherapie (LPV/r, ATV/r oder IDV/r) weiterbehandelt. In
dieser Zeit kam es bei 9/27
Patienten zum viralen Rebound im Plasma: bei vier Patienten im Plasma und Liquor, bei zwei nur im Plasma und bei drei
nur im Liquor. Die Schweizer empfehlen daher, bei Patienten mit langfristiger Proteasehemmer-Monotherapie regelmäßig
auch den Liquor zu untersuchen (LBPE20 Kahlert C et al.).
Fazit:
Die Proteasehemmer-Monotherapie scheint trotz anfänglich guter Ergebnisse langfristig der Tripletherapie nicht ebenbürtig zu sein. Der „Mittelweg“ zwischen herkömmlicher Therapie, Monotherapie und Nukefrei mit FTC als alleinigem Nuke-Backbone erscheint verlockend, hatte jedoch im Fall von ATLAS überraschende neue Probleme aufgeworfen.
Neue Medikamente: Es tut sich was...
Nach dem Aus für die Maturasehemmer hatte man den Eindruck, dass jetzt erst mal lange keine neue Substanzklassen in Sicht sind. Erfreulicherweise wurde man in Wien eines Besseren belehrt.
CCR5/CCR2-Antagonist
Das kleine amerikanische Unternehmen Tobira stellte TBR-652 vor, einen CCR5/CCR2-Antagonisten, der gleichzeitig CCR5- und CCR2-Rezeptoren blockiert, was den HIV-Eintritt in die Zelle hemmt und gleichzeitig Entzündungsreaktionen abschwächt. Der neue duale Inhibitor hat in einer Phase-2-Studie an 54 HIV-Infizierten über 10 Tage die Viruslast um maximal 1,8 log gesenkt und bei den Entzündungsparametern zeigte sich ein Anstieg der MCP-1-Spiegel und ein Abfall von hsCRP (MOAB0104 Martin D et al.).
Integrasehemmer GSK 572
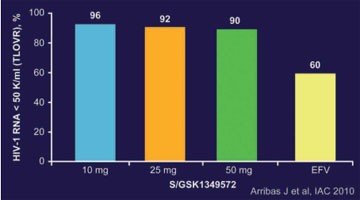
Abb. 9: SPRING-1: Woche 16.
Virologische Wirksamkeit
Der Integrasehemmer S/GSK1349572 (neuer Kurzname 572) ist mittlerweile schon fast auf jeder Konferenz präsent. Auch in Wien wurden zwei Studien vorgestellt, von denen eine allerdings etwas ernüchternd war. Zunächst die gute Nachricht: Die Substanz senkt die Viruslast in Kombination mit den gängigen Backbones TDF/FTC oder ABC/FTC bei 66% innerhalb von vier Wochen und bei über 90% der Patienten innerhalb von 16 Wochen unter die Nachweisgrenze (Abb. 9). Lediglich in einem Fall kam es zum virologischen Versagen nach initial gutem Ansprechen. Es zeigte sich eine M184V-Mutation, was für eine mangelnde Adhärenz spricht (THLBB20 Arribas J et al.). Die schlechte Nachricht: 572 wirkt zwar bei den Raltegravir-Mutationen N155H oder Y143H, jedoch beim Q148-Resistenzweg leider deutlich weniger gut (MOAB0105 Eron J et al.).
Rilpivirin vs. Efavirenz
Zum NNRTI Rilpivirin wurden die beiden Phase-3-Studien ECHO und THRIVE präsentiert. In beiden Untersuchungen wurde Rilpivirin (früher TMC278) 25 mg QD mit Efavirenz 600 mg verglichen, in ECHO in Kombination mit TDF/FTC, in THRIVE konnte der Arzt den Backbone selbst wählen. Rilpivirin hat sich dabei als Efavirenz nicht unterlegen erwiesen und war auch besser verträglich. Neurologische/psychiatrische Nebenwirkungen sowie Hautausschläge waren signifikant seltener (38% vs. 27%/ 23% vs. 15% sowie 14% vs. 3%) und auch Therapieabbrüche wegen Nebenwirkungen, ein Anstieg der Lipide und der GPT waren seltener. Das neue NNRTI hatte aber zwei relevante Nachteile: Unter Rilpivirin kam es häufiger zum virologischen Versagen (9% vs. 4,8%) und zwar sowohl häufiger zum primären Versagen mit nie supprimierter Viruslast (5,5% vs. 2,6%) als auch zum sekundären Versagen mit erneutem Anstieg der Viruslast (3,5% vs. 2,2%). Zudem war die Hälfte der Patienten mit Rilpivirin-Versagen (31/62) phänotypisch gegen das NNRTI resistent und von diesen wiederum waren nahezu alle auch gegen Etravirin resistent. Die häufigste Rilpivirin-Mutation war E138K (Abb. 10) (THLBB206 Cohen C et al.).

Abb. 10: ECHO und THRIVE: 48 Wochen. Therapieversagen und Resistenz
VERxVE: Nevirapin einmal täglich
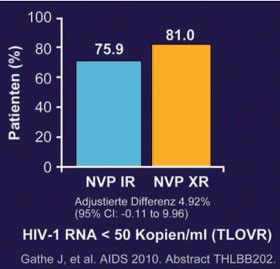
Abb. 11: VERxVE: NVP XR OD vs. NVP IR
BID. 48 Wochen. Virologische Wirksamkeit
In VERxVe wurde die neue retardierte Form von Nevirapin (Nevirapin XR 400 mg einmal täglich) mit der herkömmlichen, schnell freisetzenden Nevirapin-Tablette (Nevirapin IR) verglichen. Die 1.068 therapienaiven Patienten erhielten in der Einleitungsphase 14 Tage lang 200 mg Nevirapin IR einmal täglich und dann nach Randomisierung entweder NVP 400 mg XR plus Placebo oder NVP IR zweimal täglich jeweils in Kombination mit TDF/FTC (Truvada®). Nach 48 Wochen lag die Viruslast in beiden Gruppen bei gleich vielen Patienten unter der Nachweisgrenze (81% vs. 76%) – auch bei Patienten mit hoher Ausgangsviruslast (73% vs. 71%) (Abb. 11). Das Nebenwirkungsprofil war ebenfalls vergleichbar. Insbesondere hepatische Nebenwirkungen (1,6% vs. 2,8%) und Hautausschläge (8,3% vs. 8,8%) waren in beiden Armen gleich selten. Auf die Lipide hatte das NRTI einen nur sehr geringen Einfluss. Und in der pharmakokinetischen Substudie zeigte sich wie erwartet ein stabiler Spiegelverlauf über 24 Stunden (THLBB202 Gathe J et al.).
Hepatitis-Koinfektion – eine Nebensache?
Auch wenn auf der IAC-Konferenz der weltweite Zugang zur HCV-Therapie gefordert wurde, das Thema Hepatitis-Koinfektion war in Wien eher untergeordnet. Es gab nur zwei Vortrags-Sessions zum Thema. Viel Aufsehen erregte dabei eine kleine spanische Arbeit, in der Daten von 165 HIV/HCV-Infizierten ausgewertet wurden. Patienten, die während der HCV-Therapie Nevirapin eingenommen hatten, erzielten signifikant häufiger eine SVR als Patienten unter Lopinavir/r (56% vs. 37%), wobei insbesondere die Nonresponse unter Nevirapin seltener war (7% vs. 23%). Hinsichtlich der HIV-Parameter gab es keine Unterschiede zwischen den Gruppen, doch in der Nevirapin-Gruppe war die Lebererkrankung signifikant weniger fortgeschritten und die HCV-Viruslast niedriger, was möglicherweise Einfluss auf das Ergebnis hatte (TUAB0101 Mira JA et al.). Weitere Arbeiten zeigten, dass die HIV/HCV-Koinfektion das Risiko für ein Leberversagen erhöht, insbesondere ohne ART unabhängig vom Immunstatus (TUAB0102 Towner W et al.), das Risiko für eine Osteoporose erhöht (TUAB0104 Bedimo R et al.) und die HIV-Infektion ein unabhängiger Risikofaktor für Tod auf der Warteliste für die Lebertransplantation ist (TUAB0103 Moreno-Zamoraet A et al.). Bei der nicht-invasiven Diagnostik der Leberfibrose ist der Fibroscan eine zuverlässige Methode, die selbst Ösophagusvarizen vorhersagen kann (WEPDB202 Mausolf MK et al.), während die Hyaluronsäure kein guter Prädiktor für die Progression der Lebererkrankung zu sein scheint (TUAB0105 Rallon NI et al.).
TB-Koinfektion
Ein Drittel der Weltbevölkerung ist mit Tuberkulose (TB) infiziert, und 9,3 Millionen leiden an einer aktiven TB. Die TB ist auch die führende Todesursache bei HIV-Infizierten in Afrika. Dennoch waren bis vor kurzem HIV und TB bei der WHO und anderen organisatorisch getrennt. Das hat sich mittlerweile geändert. WHO und Global Fund bekämpfen mittlerweile beide Erkrankungen und auch Hilfsprogramme wie die BMS-Initiative Secure The Future haben ihr Angebot auf die TB erweitert.
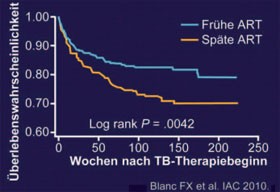
Abb. 12: CAMELIA: Frühe vs. späte HAART bei TB-Therapie
Auch wissenschaftlich gab es viele Vorträge und Poster zur TB/HIV-Koinfektion, wobei die CAMELIA-Studie die bedeutendste war. In dieser amerikanisch-französisch-kambodschanischen Untersuchung erwies sich die frühe Einleitung der HAART zwei Wochen nach Beginn der TB-Therapie als sinnvoll. Die 661 Patienten mit stark fortgeschrittenem Immundefekt (CD4-Zahl 25/µl, Viruslast 5,6 log) und offener Tuberkulose (mikroskopischer Tuberkelnachweis, 90% Lungentuberkulose) erhielten die übliche tuberkulostatische 4er-Kombination und zwei oder acht Wochen später zusätzlich d4T/3TC/EFV. Nach 50 Wochen waren in der frühen Gruppe 59 Patienten, in der späten Gruppe 90 Patienten verstorben. Zu Woche 100 betrugen die Überlebensraten 83% vs. 73% (p=0,006). Bis Woche 150 blieb die Mortalität im frühen Arm stabil, im späten Therapiearm war weiterhin ein Trend zu mehr Todesfällen zu verzeichnen. Der Preis für die bessere Überlebenschance war eine 2,5fach höhere IRIS-Rate durch die frühe Therapie, was sich allerdings laut Studienleiter Francois Blanc auch ohne Steroide managen ließ. Ob diese Ergebnisse auf Patienten mit besserem Immunstatus übertragbar sind, ist unklar (Abb. 12) (THLBB106 Blanc FX et al.).
Die Internationale Aids-Konferenz in Zahlen
- 19.100 Teilnehmer aus 193
Ländern, inklusive
14.325 Delegierte
828 Delegierte aus Österreich
770 freiwillige Helfer
1.261 Journalisten
848 Stipendiaten - 6.238 Abstracts
248 Sessions
19 Plenarreferate
18 Spezielle Sessions
127 Satellitentreffen
HPV-Impfung auch bei Männern wirksam
Der quadrivalente HPV-Impfstoff gegen HPV 6/11/16/18 ist zur Immunisierung von jungen Frauen und in den USA auch für Männer im Alter zwischen 9 und 26 Jahren zugelassen. In einer großen internationalen Studie, deren Ergebnisse Heiko Jessen aus Berlin vorstellte, wurde nun geprüft, inwieweit die Impfung bei noch nicht HPV-infizierten jüngeren Männern die Folgen der HPV-Infektion verhindern kann. An der Untersuchung nahmen über 4.000 Männer teil. Die Vakzine reduzierte bei Patienten, die von Beginn bis Ende des sechsmonatigen Impfzyklus HPV-negativ waren (d.h. keine HPV-Infektion vor/während der Impfung), die genital- und extragenitalen HPV-Läsionen um rund 90%. Am häufigsten wurden Feigwarzen beobachtet. Karzinome traten in der 30-monatigen Beobachtung dagegen nicht auf (THLBB101 Jessen H et al.).











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
