Christian Hoffmann , Hamburg
Long Acting 2.0 – Islatravir und Lenacapavir
Seit
Mai gibt es Long Acting mit Cabotegravir und Rilpivirin, die erste
antiretrovirale Therapie als Depotinjektion.
Eine Innovation,
die von vielen sehr begrüßt wird (siehe Kasten) und die
HIV-Therapie-Landschaft sehr bereichert.
Doch schon stehen
weitere Substanzen mit noch längerem Wirkpotential in den
Startlöchern.
Spritzen
Long Acting:
Wirklich
nur Convenience?
- Maria aus Kolumbien freut sich sehr über die Spritzen. Sie würde auch einmal die Woche kommen, so die 42jährige. Die größte Sorge Marias ist, dass ihre HIV-Infektion, von der niemand weiß, bekannt wird. „Wenn meine Familie das erfährt, bin ich tot“. Die Sorge, in dem Mehrgenerationen-Haushalt „aufzufliegen“ ist ständig präsent. Wird die Mutter, die ihr gerne hinter herräumt, die HIV-Tabletten finden? Sie weiß nicht, wo sie ihre Medikamente verstecken soll. Von den Spritzen verspricht sie sich Sicherheit, weniger Angst.
- Mario aus der Uckermark (29) ist seit Jahren im ICH in der LATTE-Studie. Als einer der Long-Acting-Pioniere fährt er brav seit einigen Jahren jeden Monat nach Hamburg. Die dreistündige Bahnfahrt macht ihm nichts aus. Der eine Tag im Monat ist gelaufen, der Tag danach auch, die Spritzen seien ziemlich schmerzhaft, aber okay. In der Bahn erledige er dann andere unangenehme Dinge. „Dafür habe ich dann den ganzen Monat frei“. Er hat nichts dagegen, auch nach der Zulassung weiter monatlich nach Hamburg zu kommen.
- Georg (61) ist Sternekoch. Er ist (noch) auf einem STR. In die Praxis kommt er nur spät abends, wenn kaum jemand da ist. Er ist froh, dass wegen Corona alle Masken tragen müssen. Auch er hat großes Interesse an den Spritzen und fragt immer wieder. Es erscheint ihm sehr attraktiv, in Hotels, auf Reisen auf die Umetikettierung von Tabletten bzw. Pillendosen verzichten zu können.
Kommentar: Drei typische Patienten aus dem ICH für Long-Acting. Geht es wirklich um „Convenience“? Der Aufwand der Injektionen ist sicher nicht geringer als jeden Tag innerhalb weniger Sekunden eine Tablette zu schlucken: er ist eher grösser (für alle Beteiligten). Seien wir ehrlich: Es geht um Stigmatisierung und Diskriminierung bzw. deren Vermeidung. HIV ist weiterhin keine „normale“ Krankheit. Das sollte zu denken geben. Oder anders gefragt: wie viele Menschen würden wohl auf Long-Acting umstellen, gäbe es Statine als Depotspritze?
Die beiden zugelassenen Pioniersubstanzen Cabotegravir und Rilpivirin sind noch recht umständlich zu handhaben. Zweimonatliche i.m.-Spritzen stellen auch BehandlerInnen vor Herausforderungen. Weitere Substanzen mit noch längerer Halbwertszeit und neue innovative Abgabesysteme wie Implantate sind in der Entwicklung. Vor allem Islatravir und Lenacapavir muss man sich wohl merken. Obwohl sie beide noch mindestens 1-2 Jahre von der Zulassung entfernt sind, lohnt ein Blick auf den aktuellen Stand.
Islatravir
Islatravir (MK-8591 oder EfdA) ist ein nukleosidischer RT Translokations-Inhibitor (NRTTI), der auf komplexe und neuartige Art die Reverse Transkriptase hemmt und sich lange in PBMC und Makrophagen anreichert. Der Wirkmechanismus beruht zum einen auf einem sofortigen Kettenabbruch durch die Hemmung der Translokation, einem Schritt, der für die RT vor jedem Einbau eines neuen Nukleotids notwendig ist, zum anderen auch auf einem verzögerten Kettenabbruch, wenn Islatravir von der RT in den Primärstrang eingebaut wurde.
Die chemische Struktur und der neuartige Wirkmechanismus unterscheiden es damit von allen bisher zugelassenen NRTIs und führen zu einem ganz eigenen Resistenz- und PK-Profil (schöne Übersicht bei Martin Markowitz 2020). Entwickelt wird die Substanz von MSD, das Islatravir in 2012 von der japanischen Firma Yamasa erwarb, eigentlich einem Sojasoßenhersteller. Wahrscheinlich ein kluger Einkauf, wenngleich Islatravir momentan noch ein bisschen wie ein talentierter Zehnkämpfer wirkt, der noch nicht so recht weiß, ob er vielleicht auch in attraktiven Einzeldisziplinen erfolgreich ist.
Schon sehr geringe Dosen schaffen als Einzeldosis über eine Logstufe nach einer Woche, höhere Dosen 1,6 Log (Schürmann 2021). In einer Phase IIa-Studie an therapienaiven Patienten wurde Islatravir in drei verschiedenen Dosen (0,25-2,25 mg täglich) mit Doravirin+3TC kombiniert und gegen eine Standard-Therapie aus Doravirin+TDF+3TC getestet (Molina 2021). Bei ausreichender Wirkung erfolgte zu Woche 24 die Randomisierung auf ein 2DR aus Islatravir+Doravirin. Nach 48 Wochen war die Effektivität vergleichbar mit dem Standardarm, und zwar über alle untersuchten Subgruppen hinweg (Geschlecht, Ethnie, CD4-Zellen, Höhe der Viruslast). Insgesamt 5/90 Patienten entwickelten ein Protokoll-definiertes virologisches Versagen, alle blieben unter 80 Kopien und ohne Resistenz. Die Verträglichkeit war, wie wir jetzt auf der IAS erfahren haben, über bislang 96 Wochen exzellent (Abb. 1) (Cunningham 2020).
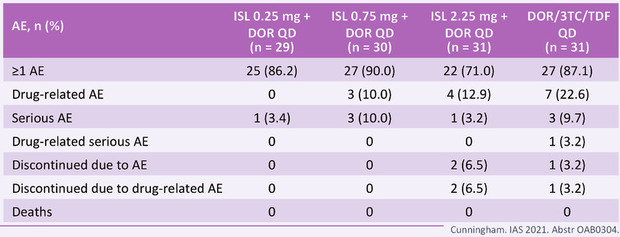
Abb 1 Studie 011: Sicherheit Woche 0-96
Das
2020 aufgelegte Studienprogramm (diverse „ILLUMINATE“-Studien)
ist sehr ehrgeizig. Es beinhaltet mindestens eine Studie für
intensiv vorbehandelte Patienten (P019), zwei Switch-Studien
(017/018), und eine ebenso mutige (wie notwendige) Studie für
therapienaive Patienten (P020). In dieser tritt Islatravir in
Kombination mit Doravirin gegen
Biktarvy®
an.
Auch als „Monats-PrEP“ wird Islatravir entwickelt: Vorläufige Daten einer Ende 2020 voll rekrutierten Studie an insgesamt 242 Erwachsenen mit geringem HIV-Risiko deuten darauf hin, dass mit einmal 60 mg Islatravir pro Monat ausreichend protektive Spiegel gewährleistet wären (Hillier 2021). Im November 2020 starteten MSD und die Bill & Melinda Gates Foundation zwei große Phase-III-Studien namens IMPOWER, die Islatravir monatlich gegen täglich F/TDF bzw. F/TAF testen werden.
In der HIV-Therapie sind momentan nicht monatliche, aber so doch immerhin wöchentliche Gaben im Gespräch. Modellierungsstudien zeigen, dass Islatravir als einmal wöchentliche Pille funktionieren könnte. In der Kombination mit einem anderen neuen NNRTI von MSD, MK-8507, laufen klinische Studien zu einer „Wochen-ART“ (Kandala 2021). Sogar als subdermales, auswechselbares Depot-Implantat wird Islatravir getestet: An gesunden Probanden wurden über ein Jahr protektive Spiegel gemessen (Matthews 2021). Es erscheint möglich, auch Kombinationen über solche Depots zu applizieren.
Insgesamt zählt Islatravir eindeutig zu den interessantesten neuen Substanzen derzeit, die alles für eine Weiterentwicklung mitbringt (Potenz, Resistenzprofil, Kinetik) – und bitte hoffentlich nicht nur für die PrEP. Das ganze Potential, vor allem auch die pharmakokinetischen Möglichkeiten, ist noch nicht abzusehen. In jedem Fall wird Islatravir die kommenden Kongresse dominieren. Übrigens: Norwegens Wunderläufer Karsten Warholm, der junge Mann mit dem unglaublichen 400 m Hürden-Weltrekord in Tokio, hat übrigens auch als Zehnkämpfer angefangen.
Lenacapavir
Neben Islatravir ist Lenacapavir als Kapsidinhibitor die wohl wichtigste Innovation zurzeit. Das virale Genom und die viralen Enzyme von HIV werden von einem Kapsid umschlossen, einer kegelförmigen Hülle, die aus p24-Ringen besteht und das virale Genom und die viralen Enzyme enthält. Obwohl noch unklar ist, wann genau die „Enthüllung“ (uncoating) des Kapsids nach Aufnahme in die Zelle stattfindet, ist das Kapsid doch essentiell für die Replikation. Es spielt im viralen Lebenszyklus eine entscheidende Rolle – interessanterweise während verschiedener Phasen des Replikationszyklus. Sowohl die reverse Transkription, aber auch spätere Stadien der Replikation hängen entscheidend von der Stabilität des Kapsids ab.
Kapsidinhibitoren wie Lenacapavir wirken also an verschiedenen Stellen, und so ganz genau weiß es wohl selbst Hersteller Gilead noch nicht, wo die Replikation jeweils wie stark unterbunden wird. Es kann uns auch erst einmal egal sein: In Monotherapie liefert Lenacapavir an Tag 10 eine mittlere maximale HIV-1-RNA-Reduktion um bis zu 2,2 Logstufen, eine beeindruckende Leistung (Link 2020). Mindestens genauso beeindruckend ist allerdings die Halbwertszeit. Mit einer einmaligen subkutanen Gabe lassen sich über 6 Monate ausreichende Spiegel erreichen (Link 2020).
Wie auch bei Islatravir ist zurzeit noch nicht wirklich klar, wohin die Reise geht. In den Purpose-Phase-III-Studien wird Lenacapavir als PrEP alle sechs Monate s.c. im Vergleich zu F/TAF und F/TDF placebokontrolliert an Frauen und MSM getestet. Untersucht wird Lenacapavir aber auch in der HIV-Therapie, sowohl bei therapienaiven Patienten (Convenience) als auch bei multiresistenten Viren. Auf der IAS wurden die ersten größeren Studien vorgestellt. An CALIBRATE, einer offenen, nicht ganz unkomplizierten Phase II-Studie nahmen 182 therapienaive Personen teil. Diese wurden randomisiert auf 4 Arme:
- subkutanes Lenacapavir alle 6 Monate (927 mg an Tag 15 nach oraler Einleitung) plus tägliches orales F/TAF bis Woche 28, gefolgt von subkutanem Lenacapavir plus täglichem oralen TAF (ohne F)
- dieselbe Dosis für 28 Wochen, gefolgt von subkutanem Lenacapavir plus Bictegravir täglich
- tägliches orales Lenacapavir für 28 Wochen (600 mg an den Tagen 1 und 2, danach 50 mg täglich) plus orales F/TAF, danach gleiche Medikamente und Dosen
- orales Bictegravir plus F/TAF für 28 Wochen und danach.
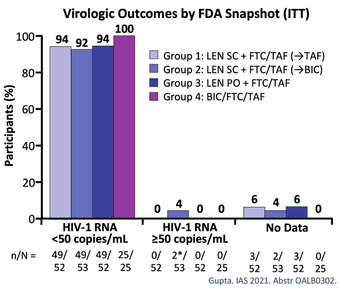
Abb 2 CALIBRATE: Virologisches Ergebnis zu Woche 28
In den kombinierten Lenacapavir-Armen (Gruppen 1 bis 3) lag die Viruslast in Woche 28 bei 147 von 157 Personen (94%) unter 50 Kopien. Alle 25 Personen, die mit Bictegravir plus F/TAF behandelt wurden, hatten in Woche 28 eine Viruslast unter 50 Kopien. Zwei von 103 Personen, die subkutan mit Lenacapavir behandelt wurden, brachen die Behandlung wegen Reaktionen an der Injektionsstelle ab (Abb. 2) (Gupta 2021).
In
CAPELLA wurden 72 Patienten mit einer versagenden ART ebenfalls mit
Lenacapavir s.c. alle 6 Monate bzw. Placebo behandelt. Zwei Wochen
nach der ersten Injektion war die Viruslast bei 88% um mindestens 0,5
Logstufen gefallen, im Vergleich zu 17% unter Placebo. Trotz sehr
beschränkter Optionen in der Begleittherapie erreichten bis zu 81%
eine Viruslast unter 50 Kopien/ml, darunter 4/6 PatientInnen, bei
denen Lenacapavir die einzige
aktive Substanz war (Molina
2021). Auch in CAPELLA waren Reaktionen an den Einstichstellen die
häufigsten Probleme, führten aber nicht zum Abbruch.
Ausblick
Viele Parallelen, die gleichen Ziele, ähnliche Pharmakokinetik: Beide Substanzen brauchen zudem Partner. MSD und Gilead haben ein gemeinsames Trainingscamp bezogen: die im März verkündete Kollaboration beider Firmen, ihre Langzeitpräparate gemeinsam zu entwickeln, scheint folgerichtig. Warten wir nun also auf das Studienprogramm. Es könnte, sofern erfolgreich, die HIV-Therapie wie wir sie kennen, von Grund auf verändern.
Literatur
Cunningham D, et al. Islatravir safety analysis through week 96 from a phase 2 trial in treatment naive adults with HIV-1 infection. IAS 2021, 11th Conference on HIV Science, July 18-21, 2021. Abstract OAB0304.
Gupta SK, et al. Long-acting subcutaneous lenacapavir dosed every 6 months as part of a combination regimen in treatment-naïve people with HIV: interim 16-week results of a randomized, open-label, phase 2 induction-maintenance study (CALIBRATE). IAS 2021, 11th IAS Conference on HIV Science, July 18-21, 2021. Abstract OALB0302.
Hillier S, et al. Trial design, enrolment status, demographics, and pharmacokinetics (PK) data from a blinded interim analysis from a phase 2a trial of Islatravir once monthly (QM) for HIV pre-exposure prophylaxis (PrEP). HIV Research for Prevention (HIVR4P) virtual conference, abstract OA04.05, 2021.
Kandala B, et al. Model-informed dose selection for islatravir/MK-8507 oral once-weekly phase 2b study. CROI 2021, 6–10 March 2021. Poster 376.
Link JO, et al. Clinical targeting of HIV capsid protein with a long-acting small molecule. Nature. 2020 Aug;584(7822):614-618.
Markowitz M, Grobler JA. Islatravir for the treatment and prevention of infection with the human immunodeficiency virus type 1. Curr Opin HIV AIDS. 2020 Jan;15(1):27-32.
Matthews R, et al. Next-generation islatravir implants projected to provide yearly HIV prophylaxis. Conference on Retroviruses and Opportunistic Infections, Abstract 88, 2021.
Molina JM, et al. Efficacy and safety of long-acting subcutaneous lenacapavir in phase 2/3 in heavily treatment-experienced people with HIV: week 26 results (Capella study). Abstract OALX01LB02. IAS 2021 July 18-22.
Molina JM, et al. Islatravir in combination with doravirine for treatment-naive adults with HIV-1 infection receiving initial treatment with islatravir, doravirine, and lamivudine: a phase 2b, randomised, double-blind, dose-ranging trial. The Lancet HIV, Volume 8, Issue 6, e324 - e333.
Schürmann D, et al. Safety, pharmacokinetics, and antiretroviral activity of islatravir (ISL, MK-8591), a novel nucleoside reverse transcriptase translocation inhibitor, following single-dose administration to treatment-naive adults infected with HIV-1: an open-label, phase 1b, consecutive-panel trial. Lancet HIV;7:e164-e172. 2020.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
