 XVI.
INTERNATIONAL HIV DRUG RESISTANCE WORKSHOP, BARBADOS, 12.-16. JUNI 2007
XVI.
INTERNATIONAL HIV DRUG RESISTANCE WORKSHOP, BARBADOS, 12.-16. JUNI 2007
Resistenz gegen neue Klassen
Der jährlich stattfindende internationale Resistenz-Workshop ist eine Plattform der Forscher, die ihre neuesten Studien- und Forschungsergebnisse präsentieren und diskutieren. In diesem Jahr standen insbesondere die neuen Substanzklassen der Integraseinhibitoren und CCR5-Antagonisten im Fokus. Interessante neue Daten gab es aber auch zu Nachweis und Interpretation von minoren Quasispezies sowie zu den kompensatorischen Mutationen im gag-Gen unter Proteasehemmern.
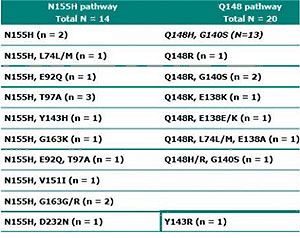
Abb. 1: Genotyp-Analyse der 24. Woche von 35 stark vortherapierten Patienten mit Therapieversagen während
ART mit Raltegravir in der Phase-2-Studie (Merck Protokoll 005) (DJ Hazuda et al. #8)
Auf der Konferenz wurden die 24-Wochen- Daten der Phase-2-Studie (Merck Protokoll 005) zum Integraseinhibitor (INI) Raltegravir vorgestellt (DJ Hazuda et al. #8). 38/133 (24,8%) Patienten, die alle vor Beginn der ART gegen drei Medikamentenklassen resistent waren, zeigten nach 24 Wochen ein virologisches Therapieversagen. Die Resistenz wurde bei 35/38 genotypisierten Patienten bis auf eine Ausnahme über zwei verschiedene Wege vermittelt, entweder durch die Mutation Q148H/R/K oder die Mutation N155H plus einer oder mehrerer Sekundärmutationen in der Integrase aufgetreten (Abb. 1). Dies wurde auch in einem kleineren Patientenkollektiv beobachtet. Von den vier ebenfalls stark vortherapierten und dann INI-versagenden Patienten entwickelten je ein Patient die N155H- und ein weiterer Patient die G148H-Mutation, die beiden anderen Patienten aber entweder die E92Q- bzw. die E157Q-Mutation (I Malet et al. #7).
Bei der Phase-2-Studie GS-US-183-0105 mit dem INI Elvitegravir wurden ebenfalls die 24-Wochen-Daten vorgestellt. Bei 28/73 der stark vorbehandelten Patienten (38,4%) kam es unter 125 mg Elvitegravir zum virologischen Versagen. Auch hier zeigten sich zwei dominante Wege der Resistenzentwicklung, die Mutationen N155H oder E92Q mit oder ohne weitere Sekundärmutationen (Abb. 2). Die Resistenz wurde in allen Studien auch mittels phänotypischer Analysen bestätigt. Zusammenfassend lässt sich sagen, dass die beiden INIs nur eine geringe genetische Barriere zur Resistenzentwicklung aufweisen und voraussichtlich Kreuzresistenz besteht.
PI-MONOTHERAPIE
| Integrase-Genotyp (Direktsequenzierung) | n (%) |
|---|---|
| Jede E92Q | 11 (39%) |
| + N155H (+/- andere Mutationen) | 4 (14%) |
| + T66A (+ andere Mutationen, nicht N155H) | 3 (11%) |
| + andere Mutationen (nicht T66I/A/K oder N155H) | 4 (14%) |
| Jede N155H | 11 (39%) |
| + andere Mutationen (nicht E92Q) | 7 (25%) |
| + T66I (+ andere Mutationen, nicht E92Q) | 1 (3,5%) |
| + E138K (+ andere Mutationen, nicht E92Q oder T66I) | 3 (11%) |
| + andere Mutationen (nicht E92Q, T66I oder E138K) | 3 (11%) |
| E138K + S147G + Q148R (+/- andere Mutationen) | 6 (21%) |
| G140C/S + Q148R/H/K (+/- andere Mutationen, inkl. T66K) | 3 (11%) |
Die MONARK Studie untersucht u.a. die Resistenzentwicklung bei Therapie-naiven Patienten unter LPV/r-Monotherapie im Vergleich zu LPV/r+AZT+3TC. In der Monotherapie-Gruppe zeigten 32/83 Patienten virämische Episoden. Bei 18 dieser Patienten fanden sich im Genotyp PI-Mutationen. Bei fünf Patienten waren PI-Primärmutationen nachweisbar. Bei zwei dieser fünf Patienten war die L76V alleine, bei einem weiteren Patienten zusammen mit anderen PI-Mutationen aufgetreten. In der LPV/r+AZT+3TC-Gruppe hingegen kam es nur bei 7/53 Patienten zu virämischen Episoden und nur vier dieser Patienten wiesen PI-Mutationen im Genotyp auf, allerdings keine Primärmutation (C Delaugerre et al. #75). Dies macht deutlich, dass die genetische Barriere der Resistenzentwicklung bei LPV/r-Monotherapie deutlich geringer ist als bei der herkömmlichen LPV/r-Kombinationstherapie. Die L76V- zusammen mit der M46I-Mutation trat auch bei drei Ersttherapieversagern in einer anderen Studie auf (einer dieser Patienten erhielt ebenfalls LPV/r Monotherapie) (M Nijhuis et al. #127). Patrick Braun et al. konnten zeigen, dass die L76V-Mutation für ATV und SQV resensitiviert, so dass diese beiden PI eine Option für eine Salvage-Therapie nach Versagen mit Auftreten der L76V-Mutation darstellen (P Braun et al. #129).
NEUER GENERATION PI UND NNRTI
Integrase-Sequenzierung vor Therapiebeginn?
Drei Arbeitsgruppen haben das Integrase-Gen ihrer INI-naiven Patientenkollektive sequenziert. Es ergaben sich Hinweise, dass 1) Resistenz-assoziierte Mutationen in der Protease (PR) und der reversen Transkriptase (RT) einen Einfluss auf den Polymorphismus der Integrase (IN) haben können und 2) dass Polymorphismen der IN einen negativen Einfluss auf das Ansprechen einer INI-enthaltenden ART haben können (H Suzuki et al. #2; RE Myers et al. #3; F Ceccherini-Silberstein et al. #4)). So kann es sinnvoll sein, vor ART-Beginn mit INI das Integrase-Gen zu sequenzieren, wobei wir hier aber noch mehr Daten brauchen, damit man anhand der Integrase-Sequenzen eine richtige Voraussage bezüglich des Therapieansprechens treffen kann.
Der neue NNRTI Etravirine (TMC125) zeigt deutlich inhibitorische Eigenschaften gegen EFV- bzw. NVP-resistente Viren. Die Daten aus den Phase-3-Studien DUET 1 und 2 zeigen jedoch, dass bestehende NNRTI-Mutationen mit einem schlechteren Therapieansprechen assoziiert sind (J Vingerhoets et al. #32). Bei den PI sind vielsprechende neue Substanzen in Sicht. Die in vitro Resistenzentwicklung vieler neuer PI, die zum Teil schon in Phase-1-Studien getestet und zum Teil sich noch in der Präklinik-Phase befinden, zeigen neue Resistenz-assoziierte Mutationen einhergehend mit fehlender Kreuzresistenz zu den z.Z. zugelassenen PIs. Außerdem ist die Entwicklung der Resistenz bei fast allen Substanzen ein langsamer Prozess (JP Vacca et al. #15; C Callebaut et al. #16; M Lo Cicero et al. #17; A Calazans et al. #18; E Afonina et al. #19).
RESISTENZ GEGEN CCR5-HEMMER
Resistente Varianten können auch unter den CCR5-Inhibitoren entstehen. In der Phase-2b-Studie ACTG 5211 mit Vicriviroc (VCV) zeigten 8/118 Patienten zu Woche 16 ein virologisches Therapieversagen. Interessanterweise fanden sich nur bei einem dieser Patienten geno- und phänotypische Veränderungen im V3-Loop im HIV-1 env-Gen, die mit einer VCV-Resistenz assoziiert waren. 20 Wochen nach Absetzen von VCV waren die Viren wieder sensitiv gegenüber VCV (AMN Tsibris et al. #13). Bei 4/12 Patienten, die in den Phase-3-Studien MOTIVATE 1 und 2 unter Maroviroc (MVC) virologisch versagten, fanden sich ebenfalls Viren mit Mutationen im V3-Loop und phänotypischer Resistenz gegenüber MVC (J Mori et al. #10). In einer anderen Arbeit wurden bei 16 Patienten mit virologischem Therapieversagen CXCR4-trope Viren nachgewiesen, die vermutlich schon vor der Therapie als Minoritäten vorhanden waren. Diese Viren wurden nach Absetzen von MVC stets durch CCR5-trope Viren ersetzt (M Lewis et al. #56).
KOREZEPTORTROPISMUS-TEST
Die Gefahr der Selektion CXCR4-troper Viren unter CCR5-Inhibitoren war ein vieldiskutiertes Thema auf der Konferenz. Es wurden zwei neue phänotypische Testmethoden vorgestellt, die auch Minoritäten dieser Viren von 1% bzw. 5% erfassen (I Vandenbroucke et al. #139; V Roulet et al. #147). Hier sind klinische Studien notwendig, um Cut-offs zu definieren. Noch schwieriger sieht es bei den Prädiktionssystemen auf der Grundlage von Genotypen aus. In einer Untersuchung an 920 Patienten wurden die Env-Gene (alle geno- und phänotypisiert) mit sechs verschiedenen Vorhersagesystemen untersucht. Alle Systeme wurden als untauglich für klinische Proben eingestuft, insbesondere wenn CXCR4-trope Viren nur als minore Quasispezies vorlagen (A Low et al. #149).
PROBLEM MINORITÄTEN
Zum Nachweis minorer Quasispezies resistenter Viren gibt es mittlerweile viele verschiedene Methoden, wobei sich die Allel-spezifische PCR (AS-PCR) (JA Johnson et al. #39; KJ Metzner et al. #40) und das ultra-deep Sequenzieren (BB Simen et al. #134; R Lanier et al. #135; Y Mitsuya et al. #136; C Hoffmann et al. #137) als die sensitivsten Methoden erwiesen haben. Zwei Studien untersuchten, ob der Nachweis dieser Minoritäten mit einem das Therapieansprechen bzw. Therapieversagen assoziiert ist. In einer retrospektiven Analyse der FIRST Studie, in der Patienten 1999-2001 initial mit NNRTI + 2 NRTIs behandelt wurden, kam es bei allen Patienten innerhalb von 48 Monaten zum Therapieversagen, wenn vor Therapiebeginn in der ultra-deep Sequenzierung und/oder konventioneller Genotypisierung NNRTI-Mutationen nachweisbar waren. Dagegen versagten im gleichen Zeitraum nur 62% der Patienten ohne diese Mutationen (p=0,0006) (BB Simen et al. #134). Unsere eigenen Daten zeigen keine derartige Korrelation zwischen Tenofovir und der K65R-Mutation (KJ Metzner et al. #45). Wir haben 193 naive Patienten, die 2005/06 in die deutsche "Truvada-Studie" eingeschlossen wurden, vor Therapiebeginn mittels AS-PCR auf die Prävalenz der K65R-Mutation untersucht. Bei vier Patienten lag K65R-Mutation als minore Quasispezies vor. In keinem Fall kam es jedoch innerhalb der ersten 6-18 Monate zum virologischen Therapieversagen.
KOMPENSATORISCHE MUTATIONEN
Resistenz-bedingte Veränderungen in der viralen Protease können zu kompensatorischen Mutationen in den Schnittstellen-kodierenden gag-Sequenzen führen. Die Analyse von 326 gag-Sequenzen vor Therapiebeginn aus den Studien POWER 1, 2 und 3 mit Darunavir/r bei stark vorbehandelten Patienten ergab, dass Mutationen in gag mit schlechterem Therapieansprechen assoziiert sind (I Dierynck et al. #21). Zwei weitere Studien belegen, dass gag-Mutationen nicht nur kompensatorisch entstehen, um die Replikationskapazität zu steigern, sondern selbst auch zur erhöhten Resistenz gegenüber PI beitragen können (A Kohli et al. #105; E Dam et al. #106). Jens Verheyen et al. haben gag-Sequenzen von 613 Patienten aus der deutschen Serokonverterstudie aus den Jahren 1996-2005 analysiert. Resistenz-assoziert gag-Mutationen waren nach dem Jahr 2000 wesentlich häufiger nachweisbar als in den Jahren davor. Dies steht in direktem Zusammenhang mit der Verbreitung der PI (J Verheyen et al. #132).
PD Dr. med. Karin J. Metzner
Nationales Referenzzentrum für Retroviren
Universitätsklinikum Erlangen
Virologisches Institut
Schlossgarten 4
91054 Erlangen
E-Mail: karin.metzner@viro.med.uni-erlangen.de










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
