JOACHIM HAUBER, FRANK BUCHHOLZ UND JAN VAN LUNZEN
Eradikation von HIV: Mehr als eine Vision?
![]()

Die Vision der HIV-Eradizierung erhielt neue Hoffnung durch die kürzliche Einführung neuartiger antiretroviraler Wirkstoffklassen und ganz besonders durch die Entwicklung der so genannten Tre-Rekombinase. Dieses Enzym kann HIV aus infizierten Zellen "herausschneiden". Bis zur klinischen Anwendung ist es allerdings noch ein langer Weg. Eine Allianz aus Grundlagenwissenschaftlern des Heinrich-Pette-Instituts und Klinikern der Infektionsambulanz des Universitätsklinikums Hamburg-Eppendorf versucht, diesen Weg vom Reagenzglas bis zur Klinik für diese und andere Visionen effizienter zu gestalten.
Hinsichtlich der Therapie von HIV-Infektionen (HAART) stellen die gegenwärtigen Medikamenten-Regime einen gewaltigen Fortschritt bei der Kontrolle der Virusvermehrung dar. Damit verbunden sind allerdings auch erhebliche Probleme, z.B. Arzneimittelnebenwirkungen und das Auftreten (mehrfach) resistenter HI-Viren. Es ist deshalb nach wie vor sehr wichtig, die Therapiemöglichkeiten zu erweitern, indem neuartige antivirale Zielstrukturen und Wirkstoffe identifiziert bzw. entwickelt werden. Eine Heilung infizierter Patienten ist leider aber auch mit völlig neuartigen Wirkstoffklassen oder Wirkprinzipien nicht möglich und antiretrovirale Medikamente müssen lebenslang verabreicht werden.
WARUM KEINE HEILUNG?
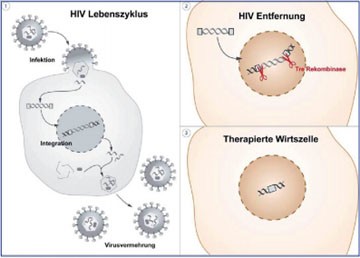
Abb. 1: Im Bild dargstellt ist die Funktionsweise der neuentwickelten Methode. Nachdem der HI-Virus die gesunde Zelle befallen hat (Bild 1), integriert er sein Erbgut in das Zellgenom und wird reproduziert. Die neugezüchtete Tre-Rekombinase erkennt die HIV-Sequenz im Zellgenom und schneidet es wie eine molekulare Schere heraus (Bild 2). Übrig bleibt eine Wirtszelle ohne HIV-Genom im Zellkern (Bild 3). Bild: Buchholz / Hauber
Das Problem der Heilung ist im Lebenszyklus von Retroviren begründet. Retroviren müssen ihr Erbgut (bzw. ihre provirale DNA) stabil in das Genom der Wirtszelle integrieren, um Nachkommenviren zu produzieren. Es entsteht dadurch eine bisher untrennbare Verbindung zwischen dem Virus und seinem Wirt. Dennoch wurden im vergangenen Jahrzehnt vielfältige Versuche zur Virus-Eradizierung durchgeführt, welche die Aktivierung ruhender latent-infizierter Lymphozyten und gleichzeitiger HAART auf verschiedene Weise kombinierten1. Diese Eradizierungsversuche schlugen zwar letztendlich fehl, aber sie zeigten, dass die funktionelle Rekonstitution des Immunsystem des Patienten von großer Bedeutung für derartige Therapieansätze ist.
NEUE IDEEN UND ANSÄTZE
Am Max-Planck-Institut für Molekulare Zellbiologie und Genetik in Dresden (MPI-CBG) wurde mit der Tre-Rekombinase ein Enzym entwickelt, das endständige Sequenzen der integrierten proviralen HIV-1 DNA (Long Terminal Repeats bzw. LTRs) spezifisch erkennt und rekombiniert. In Zusammenarbeit mit dem Heinrich-Pette-Institut in Hamburg (HPI) konnte dadurch erstmals das integrierte HI-Provirus aus einer infizierten Zellkultur quantitativ wieder entfernt werden oder, anders ausgedrückt, die gesamte Zellkultur von ihrer HIV-1 Infektion geheilt werden2.
Ein entsprechender neuartiger Therapieansatz könnte darin bestehen, das Immunsystem von HIV-Infizierten mit Blutzellen zu rekonstituieren, welche eine entsprechende Tre-Rekombinase enthalten. Diese Zellen entfernen nach ihrer Infektion HIV-1 wieder, bleiben deshalb weiterhin immunologisch funktionsfähig und könnten so zur Entfernung von einzelnen latent-infizierten (aktivierten) Lymphozyten beitragen.
OFFENE FRAGEN

Abb. 2: Die Grundlagen-Wissenschaftler: Dr. Frank Buchholz (li.) aus Dresden und das Hamburger
Forscherehepaar Ilona und Joachim Hauber vom Heinrich-Pette-Institut

Abb. 3: Die klinischen Wissenschaftler des UKE Teams von PD Dr. van Lunzen
Ob auf diese Weise tatsächlich ein neuartiges Therapieverfahren entwickelt werden kann, ist derzeit noch nicht abzusehen. Zudem stellen sich in diesem Zusammenhang verschiedene grundsätzliche und technische Fragen3, 4. Das Gen für die Tre-Rekombinase müsste beispielsweise mit Hilfe von somatischer Gentherapie in die Zielzellen eingebracht werden und dies ist ein relativ kompliziertes Verfahren, das selbst noch in den Kinderschuhen seiner klinischen Anwendung steckt. Ferner können derzeit weder potenziell toxische Nebenwirkungen, noch die Selektion Rekombinase-resistenter HI-Viren im Tre-behandelten Patienten mit Sicherheit ausgeschlossen werden. Diese und weitere Fragestellungen müssen deshalb in den nächsten Jahren sorgfältig in präklinischen Untersuchungen erforscht werden, bevor sich dann klinische Studien anschließen könnten.
ERFOLG DURCH ZUSAMMENARBEIT
Diese, wie prinzipiell alle Medikamentenentwicklungen, würden natürlich enorm von einer engen Zusammenarbeit bzw. maximalen Verzahnung der nicht-klinischen und klinischen Forschung profitieren. Deshalb wurde neben der bereits oben erwähnten engen Kooperation zwischen MPI-CBG und HPI auch ein äußerst intensiver wissenschaftlicher Austausch zwischen Labor und Klinik in Gang gesetzt, indem bereits vor einiger Zeit eine klinische Forschergruppe des Universitätsklinikums Hamburg-Eppendorf (UKE) unter der Leitung von Priv.-Doz. Dr. Jan van Lunzen, direkt in der Forschungsabteilung für Zellbiologie und Virologie des HPI, einem außeruniversitären Institut der Leibniz Gemeinschaft, angesiedelt wurde. Die dadurch entstandene stetige Interaktion von Klinikern und Grundlagenforschern trug in relativ kurzer Zeit Früchte. Es wurden neue Projekte von stark translatorischem Charakter entwickelt und signifikante gemeinsame Drittmittel eingeworben.
ÜBERSETZUNG IN DIE KLINIK
Grundlage der translatorischen Ansätze vom Reagenzglas in die Klinik ist eine gut definierte Patientenkohorte, die in der Infektionsambulanz des UKE seit mehreren Jahren engmaschig behandelt und verfolgt wird. Die hier dokumentierten Patienten erhalten nicht nur eine individualisierte Behandlung auf dem neuesten Stand der Wissenschaft, sondern tragen nach eingehender vorheriger Aufklärung und Einwilligung signifikant zur Weiterentwicklung von innovativen Forschungsvorhaben in der Grundlagenforschung bei. Im Zentrum des Bemühens steht stets der einzelne Patient, der durch den Kontakt über den behandelnden Arzt direkten Kontakt zu den Fortschritten hat und somit an der Entwicklung neuer Strategien hautnah beteiligt ist. Dies erhöht deutlich die Motivation an Forschungsprojekten teilzunehmen und fördert das Vertrauen in die biomedizinische Forschung.
Durch diese einzigartige Verzahnung von klinischer Therapieforschung mit grundlagenorientierter Molekularvirologie entstand in den letzten Jahren ein übergreifender und überaus erfolgreicher Schwerpunkt für HIV-Forschung in Hamburg. Besonderen Wert wird dabei auch auf die Optimierung der Infrastruktur zur Durchführung der zum Teil sehr aufwendigen klinischen Studien geschenkt. Hierfür wurde eigens eine Phase I/II Unit am UKE etabliert (Clinical Trial Center North). Diese Bemühungen wurden in den letzten Jahren durch wissenschaftliche Preise ausgezeichnet und durch die Zuteilung öffentlicher Fördermittel gewürdigt. Auch die pharmazeutische Industrie begreift die Entwicklung als gemeinsame große Chance. Der Grundgedanke des "from bench to bedside" wird hier keineswegs unidirektional verstanden. Vielmehr werden auch klinische Probleme zurück ins Labor getragen, um deren Lösung mit modernsten Methoden zu ermöglichen ("from bed to benchside"). Die beteiligten Forscher sind davon überzeugt, dass nur eine wirkliche gleichberechtigte Kooperation zwischen Klinikern und Grundlagenforschern zu signifikanten Verbesserungen, letztendlich auch in der Patientenversorgung, führen kann.
INTERESSANT FÜR NACHWUCHS
Die Schwerpunktbildung in Hamburg hat nicht zuletzt in der letzten Zeit auch zur Etablierung von erfolgreichen Nachwuchsgruppen und der Rekrutierung von renommierten Forschern geführt, die einem Ruf nach Hamburg gefolgt sind. Ein weiterer Vorteil ist die jahrelange enge und vertrauensvolle Zusammenarbeit mit der zuständigen Ethikkommission und den anderen aufsichtsführenden Bundesbehörden (z.B. Paul-Ehrlich-Institut). Nur durch diese enge Kooperation konnten in der Vergangenheit innovative Therapiekonzepte (Vakzine, Gentherapie) klinisch realisiert werden5. Dieses Know How ist eine unabdingbare Voraussetzung für die erfolgreiche Weiterentwicklung der oben genannten neuen Therapieansätze auf dem Weg zu einer potentiellen Heilung der HIV-Infektion.
Abschließend muss kritisch angemerkt werden, dass die Eradikation des Virus vorerst eine Vision bleibt, die vielleicht niemals erreicht werden kann. Aber dennoch muss man es weiter versuchen und mit neuen Ansätzen, wie der Tre-Rekombinase sind wir vielleicht einen wichtigen Schritt weiter gekommen.
Literatur
1 . Stellbrink HJ, van Lunzen J, Westby M et al.: Virological and Immunological Effects of Highly Active Anti-Retroviral Therapy (HAART) Combined with Interleukin-2 in the Treatment of Asymptomatic HIV-1 Infection - Results of a randomized trial (COSMIC). AIDS 2002 Jul 26; 16(11): 1479-1487
2. Sarkar, I., Hauber, I., Hauber, J., and Buchholz, F. (2007). HIV-1 proviral DNA excision using an evolved recombinase. Science 316:1912-1915
3. Buchholz, F. & Hauber, J. (2007). Maßgeschneiderte Rekombinase - ein neuer Hoffnungsschimmer zur HIV-Eradikation. Retrovirus Bulletin 3:9-12
4. Hauber, J. & Buchholz, F. (2008). Raus aus der Zelle - auf dem Weg zur molekularen Chirurgie. Labor&more 1:8-9
5. van Lunzen J, Glaunsinger T, Stahmer I et al.: Transfer of Autologous Gene-Modified T Cells in HIV-infected Patients with Advanced Immunodeficiency and Drug Resistant Viruses. Molecular Therapy 2007 May;15(5): 1024-33










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
