CROI 2011, Boston, 27. Februar - 02. März 2011
Biomedizinische Prävention entwächst den Kinderschuhen
 Die 18. CROI hatte einige Highlights zu
bieten: Die erste Studie mit einem HCV-Proteasehemmer bei
HIV/HCV-Koinfizierten, die erste Übertragung von eigenen, gentechnisch
manipulierten CD4-Zellen, die erste Studie zur Vitamin D-Substitution und eine
detaillierte Auswertung der Studie iPrEX.
Die 18. CROI hatte einige Highlights zu
bieten: Die erste Studie mit einem HCV-Proteasehemmer bei
HIV/HCV-Koinfizierten, die erste Übertragung von eigenen, gentechnisch
manipulierten CD4-Zellen, die erste Studie zur Vitamin D-Substitution und eine
detaillierte Auswertung der Studie iPrEX.
In diesem Jahr nahmen erneut über 4.000 Wissenschaftler aus 46 Ländern an der Konferenz teil, doch wie immer kam mehr als die Hälfte der präsentierten Arbeiten aus Nordamerika. Der wissenschaftliche Anteil der Europäer war im Vergleich zum Vorjahr deutlich rückläufig (13% bei den Orals, 16% bei den Late Breakern und 30% bei den Postern), während mehr Studien aus Afrika stammten. Möglicherweise wollen die Europäer ihre Arbeiten lieber im Juni auf der IAS-Konferenz in Rom präsentieren.
Das wissenschaftliche Programm starte langsam und ruhig. Die Eröffnung war politisch korrekt mit einem Grundlagenvortrag zu Viren und miRNA, einer Übersicht zur HIV-Prävention und -Therapie in Malawi sowie der Krankengeschichte und etwas Jazz vom „Musik-Aktivisten” Fred Hersch aus New York. Am nächsten Tag gab es noch wenig Interessantes – zumindest aus dem europäischen Blickwinkel. Doch die Tagung wurde mit jedem Tag spannender und endete mit einem von klinischen Late Breakern gespickten Finale.
iPrEX: orale Prävention funktioniert!
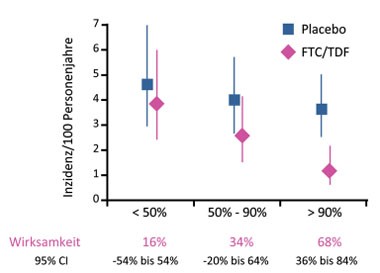
Abb. 1 iPrEx: PrEP-Adhärenz und -Wirksamkeit
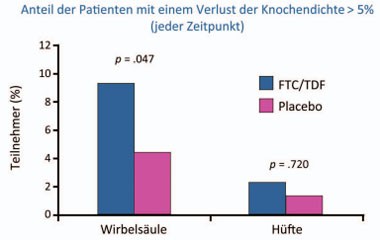
Abb. 2 iPrEx-Substudie: Auswirkungen der PrEP auf die Knochendichte 1
Die biomedizinische Prävention war einer der Schwerpunkte der CROI. Mittlerweile sind zwei wichtige Studien ausgewertet: CAPRISA und iPrEX. In CAP-RISA verminderte ein Tenofovir-haltiges Gel das Risiko einer HIV-Infektion bei Frauen um 39%, in iPrEX (n=2.499) verminderte eine Tablette Tenofovir/Emtricitabin täglich das HIV-Risiko vom MSM insgesamt um 42%. Der Schutz vor einer HIV-Infektion ist dabei ganz wesentlich von der Adhärenz abhängig. So reduzierte eine Adhärenz von ≥80% in CAPRISA das Risiko um 54%. In iPrEX senkte eine Adhärenz von >90% das Risiko um 68%, während eine Adhärenz <50% das HIV-Risiko lediglich um 16% senkte (Abb. 1) (Grant R et al., 92). Laut eigenen Angaben hatten die Teilnehmer >95% der Tabletten eingenommen, doch im Blut war Tenofovir lediglich bei knapp mehr als der Hälfte der Stichproben nachweisbar. Das heißt: Nur etwas mehr als die Hälfte der Männer nahm die Medikation tatsächlich täglich ein, wobei ältere Männer im Vergleich zu jüngeren und US-Amerikanern im Vergleich zum Rest der Welt eine bessere Adhärenz aufwiesen (73% vs 44% bzw. 97% vs 50%). Auch war Tenofovir häufiger bei Männern mit ungeschütztem Analverkehr nachweisbar, was auf einen „gezielten“ Einsatz des Medikamentes deutet (Anderson P et al. 96LB).
Besonders erfreulich ist die gute Verträglichkeit der systemischen Prophylaxe. Lediglich bei 5 Männern wurde eine reversible Verschlechterung der Nierenfunktion beobachtet. Die Knochendichte sank in den ersten 24 Wochen unter Tenofovir/Emtricitabin im Vergleich zu Placebo signifikant um <1% ab. Diese Differenz blieb im weiteren Verlauf konstant. Auch der Anteil der Patienten mit einer Abnahme der Knochendichte um >5% war in der PrEP-Gruppe größer (Abb. 2)(Mulligan K et al., 94LB). Resistenzen gegen Tenofovir und Emtricitabin wurden bei Neuinfektionen unter PrEP nicht beobachtet – allerdings bei monatlicher HIV-Testung (Liegler T et al, 97LB). Ob resistente Viren die PrEP unwirksam machen, ist nicht bekannt. Im Tierversuch konnte eine Emtricitabin-Resistenz jedenfalls die „PrEP-Barriere” nicht überwinden (Cong M-E et al., 31).
Mikrobizide
Die Forschung geht auch bei den Mikrobiziden weiter. Im ersten direkten Vergleich der Akzeptanz von Tabletten und Vaginal-Gel zur HIV-Prävention fanden Afrikanerinner beide Methoden gleichermaßen gut, während drei Viertel der US-Amerikanerinnen den Tabletten den Vorzug gaben (Hendrix C et al., 35 LB). Bei rektaler Anwendung von Mikrobiziden gab es einen Rückschlag. Das in CAPRISA bei Frauen erfolgreich eingesetzte Tenofovir-Gel war bei rektaler Anwendung weniger wirksam und zudem nebenwirkungsreicher. Erst nach siebenmaliger Anwendung waren explantierte Zellen gegen HIV-geschützt und viele Männer klagten über schwere Diarrhoen und Krämpfe (Anton P et al., 34LB). Sehr interessant, aber noch im Tierexperiment, ist die Möglichkeit einer PEP mit einem Raltegravir-haltigen Gel. Das Gel schützte drei Stunden nach vaginaler Exposition fünf von sechs Tieren vor einer Infektion (Dobard C et al., 30).
Und die Kosten?
Nachdem die biomedizinische Prävention langsam den Kinderschuhen entwächst und die FDA signalisierte, dass iPrEX für einen Zulassungsantrag ausreicht, denkt man darüber nach, wie man die verschiedenen Methoden am besten einsetzt. Nutzen, Kosten und Gefahren müssen gegeneinander abgewogen werden. Diese Kosten-Nutzen-Relation hängt neben dem Preis für die Medikamente wesentlich vom HIV-Risiko in einer Population ab. Aus diesem Grund ist zu erwarten, dass für verschiedene Gruppen unterschiedliche Maßnahmen empfohlen werden. Leider hat Anthony Fauci vom NIH den Kongress diesmal nicht besucht, so dass eine klare politische Aussage fehlt. Es wurden aber einige Rechenmodelle präsentiert, die unter bestimmten Voraussetzungen (z.B. hohe Adhärenz, billigere Medikamente, Hochrisikogruppe) die Kosteneffektivität der PrEP zeigen – in reichen wie in armen Ländern (Walensky et al., 37LB, Abbas U et al., 98LB).
HIV/Hepatitis-Koinfektion
Die neuen HCV-Proteaseinhibitoren Telaprevir und Boceprevir werden voraussichtlich im Frühsommer in den USA und im Herbst in Deutschland zugelassen werden. Im Vergleich zur herkömmlichen Therapie der chronischen Hepatitis C mit pegyliertem Interferon (peg IFN) und Ribavirin (RBV) steigern sie die SVR-Raten bei Genotyp 1 um rund 30% und erhöhen auch die Chancen von Relapsern und Non-Responder auf eine dauerhafte Elimination von HCV deutlich. Zum Einsatz bei HIV/HCV-Infizierten lagen bislang keine Studien vor. Nun wurden erstmals Daten, nämlich die 12-Wochen-Daten, einer Untersuchung präsentiert. Im Rahmen der Studie erhielten 59 behandelte und unbehandelte HIV/HCV-Koinfizierte 12 Wochen lang pegIFN/RBV plus Telaprevir (TVR) bzw. Placebo und anschließend 36 Wochen pegIFN/RBV. Der Immunstatus der HIV-Patienten war gut (CD4-Zahl 500-600/µl). Die HIV-Viruslast lag bei den unbehandelten Patienten <2.000 Kopien/ml, unter einer HAART unter der Nachweisgrenze. Die HCV-RNA betrug bei rund 75% der Patienten >800.000 IU/ml. Die behandelten Patienten nahmen entweder Efavirenz oder Atazanavir/r in Kombination mit Tenofovir plus Emtricitabin oder plus Lamivudin ein.
Rasches Ansprechen
Die Triple-Therapie führte in den ersten 12 Wochen zu einem deutlich besseren Ergebnis als die Standardbehandlung. Unter Telaprevir erreichten rund 70% der Patienten eine RVR (HCV-Viruslast unter Nachweisgrenze nach 4 Wochen) und 68% eine EVR (HCV-Viruslast unter Nachweisgrenze nach 12 Wochen) im Vergleich zu lediglich 5% und 14% unter pegIFN/RBV allein (Abb. 3).
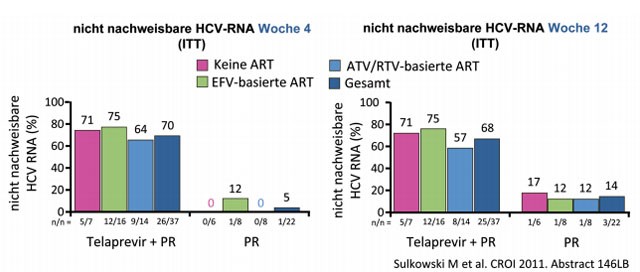
Abb. 3 Studie 110: Hohe RVR- und EVR-Raten unter Telaprevir bei HIV/HCV-Koinfizierten mit Genotyp 1
Unter TVR kam es bei zwei Patienten zum Rebound und ein Patient sprach nicht an. In der Placebogruppe gab es drei Non-Responder. Bei all diesen Patienten wurde die Therapie abgebrochen. Ein Vergleich der Patienten mit und ohne HAART ist aufgrund der kleinen Fallzahlen nicht sinnvoll. Der Preis für dieses bessere Abschneiden sind mehr Nebenwirkungen. Insbesondere Übelkeit und Erbrechen, Juckreiz, Benommenheit und Appetitlosigkeit waren deutlich häufiger (Sulkowski M et al., 146LB).
Cave Interaktionen
| Veränderung der PK Parameter, % | Cmin | Cmax | AUC* |
|---|---|---|---|
| Auswirkung von antiretroviralen Substanzen auf Telaprevir | |||
| • Atazanavir/ritonavir | -15 | -21 | -20 |
| • Darunavir/ritonavir | -32 | -36 | -35 |
| • Fosamprenavir/ritonavir | -30 | -33 | -32 |
| • Lopinavir/ritonavir | -52 | -53 | -54 |
| Auswirkung von Telaprevir auf antiretrovirale Substanzen | |||
| • Atazanavir | +85 | -15 | +17 |
| • Darunavir | -42 | -40 | -40 |
| • Fosamprenavir | -56 | -35 | -47 |
| • Lopinavir | +14 | -4 | +6 |
| AUC, area under the curve; AUC, area under the curve8hr
, area under the curve for first 8
hours; AUCtau, area under the curve for the first dosing interval; Cmax, peak concentration;
Cmin, minimum concentration. * AUC8hr for effect of antiretroviral drug on telaprevir; AUCtau for effect of telaprevir on antiretroviral drug. | |||
| • Moderate Wechselwirkung zwischen Telaprevir und Efavirenz/Tenofovir | |||
| Veränderung der PK Parameter, % | Cmin | Cmax | AUC* |
| Auswirkung von Efavirenz plus Tenofovir auf Telaprevir | |||
| • Telaprevir 1.125 mg q8h | -25 | -14 | -18 |
| • Telaprevir 1.500 mg q12h | -48 | -3 | -20 |
| Auswirkung von Telaprevir auf Efavirenz | |||
| • Telaprevir 1.125 mg q8h | -10 | -24 | -18 |
| • Telaprevir 1.500 mg q12h | -11 | -20 | -15 |
| Auswirkung von Telaprevir auf Tenofovir | |||
| • Telaprevir 1.125 mg q8h | +17 | +22 | +10 |
| • Telaprevir 1.500 mg q12h | +6 | +24 | +10 |
| * AUC8hr Auswirkung von Efavirenz plus Tenofovir auf Telaprevir; AUC24hr Auswirkung von Telaprevir auf Efavirenz und Tenofovir. | |||
Tab. 1
HCV-Proteasehemmer werden wie viele antiretrovirale Substanzen auch über Cytochrom P450 verstoffwechselt, was zu erheblichen Interaktionen führen kann. Bei gleichzeitiger Gabe wird die AUC von Telaprevir insbesondere durch Lopinavir/r (-54%), Darunavir/r (-35%) und Fosamprenavir/r (-32%) sowie die AUC der Proteasehemmer Fosamprenavir (-47%) und Darunavir (-40%) gesenkt. Keinen klinisch relevanten Einfluss hat – zumindest pharma-kokinetischen Daten zufolge – Atazanavir/r (AUC Telaprevir -20% und AUC Atazanavir +17%) (Tab. 1). Die ungünstigen Wechselwirkungen von Telaprevir und Efavirenz können durch die Erhöhung der Telaprevir-Dosis von 750 mg TID auf 1.125 mg TID ausgeglichen werden. Keine relevanten Interaktionen sind bei Tenofovir zu befürchten (Van Heeswijk R et al., 119). Der HCV-Proteasehemmer Boceprevir ist ein Substrat und Inhibitor von CYP3A4/5 sowie P-Glykoprotein, das heißt auch hier sind relevante Interaktionen zu erwarten. Der Boceprevir-Spiegel wird von Efavirenz ebenfalls gesenkt (Kasserra C et al., 118).
Heilung durch Gentechniken
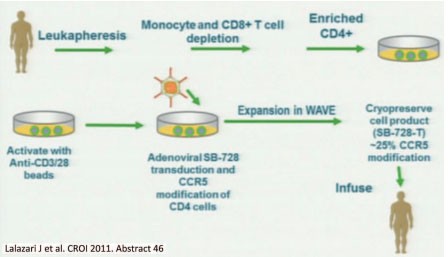
Abb. 4 Ablauf der gentechnischen Entfernung des CCR5-Rezeptorgens von der Entnahme der Zellen bis zur Reinfusion
Auch wenn man den Begriff Heilung nicht in den Mund nahm, war die Heilung wichtiges Thema. Richtig angefeuert wurde die Forschung vor zwei Jahren von der ersten dokumentierten Heilung eines HIV-Infizierten mit Leukämie durch eine Knochenmark-Transplantation von einem Spender mit CCR5Δ32-Mutation. Jetzt wurden erstmals HIV-Patienten eigene CD4-Zellen transfundiert, denen das CCR5-Gen nach gentechnischer Manipulation fehlte. In der bahnbrechenden Studie von Jay Lalezari aus San Fransisco wurden sechs HIV-Infizierten bei einer Leukopherese weiße Blutzellen entnommen und gentechnisch behandelt (Abb. 4). Dabei entfernen Zinkfinger-Nukleasen spezifisch das Gen für den CCR5-Rezeptor. 25% der wieder infundierten Zellen hatten keinen funktionsfähigen CCR5-Rezeptor mehr. Die manipulierten Zellen vermehrten sich. Sie waren in Blut und Darmschleimhaut zu finden, die CD4-Zahl stieg an, das Verhältnis von CD4/CD8-Zellen normalisierte sich und auch am Tag 90 waren noch 7% der manipulierten Zellen im Blut nachweisbar. Der Anstieg der manipulierten Zellen überraschte selbst die Forscher. „Es waren dreimal mehr Zellen als erwartet”, erklärte Lalezari. Der einzige Patient, der nicht gut ansprach, hatte schon vor der Studie hohe Antikörper gegen Adenovirus, das als Vektor eingesetzt wurde. Gravierende Nebenwirkungen wurden nicht beobachtet (Lalezari J et al., 46). In einer zweiten Untersuchung wurde auf die gleiche Weise der CXCR4-Rezeptor manipuliert – allerdings nicht am Menschen, sondern im Tierexperiment (Wilen C et al., 47). Entsprechende Untersuchungen mit hämatopoetischen Stammzellen sind bereits geplant.

Jay Lalezari, San Fransisco
Therapieintensivierung
Von einer Therapieintensivierung mit Maraviroc und/oder Raltegravir versprach man sich initial, das HIV-Reservoir langfristig zu vermindert. Doch wie schon zahlreiche Studien vorher, waren auch die jüngsten derartigen Versuche nicht von Erfolg gekrönt – insbesondere in placebokontrollierten Studien. In einer ACTG-Studie an 50 Patienten mit einer Viruslast <50 K/ml unter HAART zeigte die zusätzliche Gabe von Raltegravir keinen Effekt (Gandhi R et al., 51). Die Intensivierung mit Maraviroc bei komplett supprimierten Patienten hatte ebenfalls nicht den erwarteten Effekt. Vielmehr zeigte sich eine Mischung aus positiven und negativen immunologischen Auswirkungen, deren Bedeutung noch unklar ist (Hunt P et al., 153LB).
Selbst bei der akuten HIV-Infektion scheint die intensivierte Therapie keinen Nutzen zu bringen. In einer Untersuchung des renommierten Aaron Diamond AIDS Research Center in New York wurden 34 Patienten innerhalb von sechs Monaten nach Infektion entweder mit Tenofovir/Emtricitabin und Darunavir/r bzw. Atazanavir/r oder mit dieser Kombination plus zusätzlich Raltegravir und Maraviroc behandelt. Nach 48 Wochen zeigte sich in keinem der zahlreichen gemessenen Paramater (inklusive single copy assay und proviale DNA) ein Unterschied zwischen den beiden Therapiestrategien. „Ich war enttäuscht und habe den Patienten mit der intensivierten Therapie angeboten, ihre Medikamente zu reduzieren“, sagte der Forschungsleiter Martin Markowitz, denn letztendlich ging es in dieser Untersuchung um das Ziel einer funktionellen Heilung (Markowitz M et al., 148LB).
Zugelassene Substanzen
Raltegravir bleibt zweimal täglich
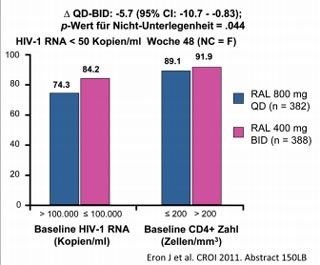
Abb. 5 QDMRK: QD versus BID Raltegravir in Kombination mit TDF/FTC bei therapienaiven Patienten. RAL QD ist RAL BID zu Woche 48 unterlegen
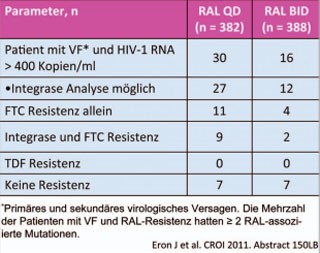
Abb. 6 Mehr Resistenzmutationen bei virologischem Versagen unter RAL QD
Das Hauptergebnis der Studie QDMRK, in der die einmal tägliche Gabe des Integrasehemmers Raltegravir mit der zweimal täglichen verglichen wurde, war schon vor der CROI bekannt. Die Studie war zu Woche 48 vorzeitig beendet worden, da Raltegravir einmal täglich der herkömmlichen zweimal täglichen Gabe unterlegen war. Nach 48 Wochen hatten unter Raltegravir 800 mg QD signifikant weniger Patienten eine Viruslast <50 K/ml (83% vs 89%). In der Gruppe der hochvirämischen Patienten mit einer Ausgangsviruslast >100.000 K/ml betrug der Unterschied 10% (74% vs 84%) und bei den Patienten mit weniger HI-Viren zu Beginn 3% (89% vs 92%) (Abb. 5).
Grund für das schlechte Abschneiden der einmal täglichen Gabe war das häufigere virologische Versagen (14% vs 9%), wobei Patienten mit hoher bzw. niedriger Ausgangsviruslast gleichermaßen häufiger versagten (37 vs 27 bzw. 16 vs 8 Patienten). Von den 27/30 bzw. 12/16 Patienten mit einer Viruslast >400 K/ml und auswertbarem Resis-tenztest fand sich bei jeweils 7 Wildtyp-Virus. In der QD-Gruppe vs BID-Gruppe hatten 11 vs 4 Patienten eine FTC-assoziierte Mutation und 9 vs 2 eine Integrasemutation. Eine Auswertung der Patienten je nach Ausgangsviruslast liegt noch nicht vor (Abb. 6).
Ein sekundäres Versagen, d.h. Rebound nach Absenkung der Viruslast unter die Nachweisgrenze bis Woche 24, war ebenfalls unter RAL einmal täglich häufiger (4,7% vs 2,7%). Der Rebound war bei den Patienten mit hoher Ausgangsviruslast insgesamt häufiger, aber in beiden Gruppen versagten Patienten unter RAL einmal täglich häufiger (VL >100.000 K/ml 6,5% vs 4,4% bzw. VL <100.000 K/ml 3,7% vs. 1,7%).
Warum die einmal tägliche Gabe unterlegen war, ist unklar. Diskutiert wird der geringere Talspiegel von Raltegravir einmal täglich, allerdings hatten die pharmakokinetischen Untersuchungen bislang keinen Zusammenhang von Raltegravir-Spiegel und Wirksamkeit nachweisen können (Eron J et al., 150LB).
Kein erhöhtes Herzinfarkt-risiko unter Abacavir
Abacavir hat erneut hitzige Diskussionen ausgelöst. Im Gegensatz zu einer früheren Auswertung der DAD-Kohorte fand die amerikanische Medikamenten-Behörde FDA in einer Metaanalyse aller verfügbaren randomisierten klinischen Studien keine Verbindung zwischen Abacavir und dem Risiko für einen Herzinfarkt. Die Zahl der Herzinfarkte in der Metaanalyse (n=46) war im Vergleich mit den Ereignissen in der DAD-Kohorte geringer, doch durch die Randomisierung ist die Wahrscheinlichkeit eines sogenannten chaneling bias (d.h. Patienten mit schlechter Nierenfunktion wurden bevorzugt mit Abacavir behandelt) geringer (Ding X et al., 808).
Dicker Bauch und Mortalität
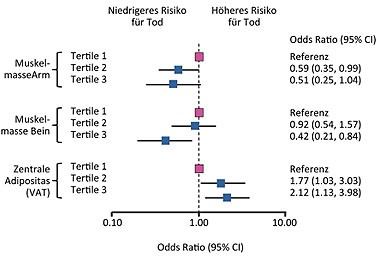
Abb. 7 FRAM-Kohorte: Extremitäten Muskelmasse, zentrale Adipositas und 5-Jahres-Mortalität
Die Lipoatrophie ist kein spannendes Thema mehr seit Thymidinanaloga kaum noch eingesetzt werden. Im Vordergrund steht heute die abdominelle Fettakkumulation. Welche Medikamente am ehesten zur Lipohypertrophie beitragen, ist umstritten. In ACTG 5224s, einer Substudie von ACTG 5202 hatten die beiden Backbones Abacavir/Lamivudin und Tenofovir/Emtricitabin keinen Einfluss auf die Fettverteilung, unter Atazanavir nahmen die Patienten allerdings innerhalb von zwei Jahren ein Kilogramm mehr Stammfett zu als unter Efavirenz (McComsey G et al., 76). Die viszerale Fettansammlung scheint zudem nicht nur ein ästhetisches Problem zu sein. In der FRAM-Kohorte war die abdominelle Fettansammlung in Kombination mit einer verminderten Muskelmasse mit einer erhöhten Mortalität assoziiert (Abb. 7) (Scherzer R et al., 76).
Knochen
Zum Einfluss der antiretroviralen Therapie auf den Knochen wurden zahlreiche Arbeiten präsentiert. Die HAART führt initial zu einem Abfall der Knochendichte um bis zu 4%. Nach den ersten 24 bis 48 Monaten bleibt die Knochenmasse dann stabil. Die Ursachen für den initialen Verlust sind unbekannt. Möglicherweise spielt die Immunrekonstitution eine Rolle. In einer experimentellen Arbeit korrelierte der Anstieg der Parameter des Knochenabbaus mit dem Anstieg der T-Zellen in den ersten 12 Wochen (Ofotukun I et al., 78). Unklar ist auch die Rolle von Tenofovir. Unter Tenofovir kam es in der Substudie ACTG 5224s zu einem stärkeren Verlust der an Knochenmasse als unter Abacavir. Möglicherweise trägt ein erhöhter Parathormonspiegel zu diesem Phänomen bei. In zwei Untersuchungen war der Parathormon bei Tenofovir-Therapie erhöht (Pocaterra D et al., 825; Labarga P et al., 824). Das erhöhte Parathormon unter Tenofovir kann durch Vitamin D normalisiert werden. In der ersten randomisierten Untersuchung zur Vitamin D-Supplementierung an rund 200 jungen Erwachsenen (84% hatten einen Vitamin D-Mangel) führte die dreimalige Gabe von 50.000 IU alle vier Wochen bei Tenofovir, nicht jedoch bei Regimen ohne Tenofovir zur Normalisierung von Parathormon (Havens P et al., 80).
Normwerte falsch?
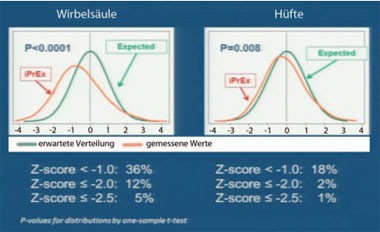
Abb. 8 iPrEX: Knochendichte der Teilnehmer (Altersdurchschnitt 27 Jahre) bei Studienbeginn
Aufgrund des möglicherweise negativen Einflusses von Tenofovir auf die Knochendichte wurde in der Studie iPrEX genau überwacht. Das Ergebnis überraschte alle: Ein nicht unerheblicher Teil der HIV-negativen Männer hatte bereits zu Beginn eine Osteopenie. Bei rund 500 Teilnehmern aus mehreren Kontinenten (Asien, Afrika, Amerika) sowie aus reichen und armen Ländern (Peru, Thailand, USA, Südafrika, Brasilien) wurde die Knochendichte zu Beginn und dann alle sechs Monate gemessen. Die Knochendichte war im Durchschnitt niedriger als erwartet. 12% der HIV-negativen Männer hatten sogar einen Z-Score der Wirbelsäule von -2 und mehr (Abb. 8) (Mulligan K et al., 94). Mehrere Faktoren wurden als Grund für diesen Befund diskutiert. Zum einen könnten die Normwerte für junge Männer falsch sein. Eine andere Möglichkeit ist der Gebrauch von Drogen. Im amerikanischen „Safety PrEP-Trail“, in dem die Knochendichte von 400 amerikanische MSM bei Studienbeginn ebenfalls niedriger als erwartet war, erhöhten Amphetamin-Gebrauch (6fach) und Poppers-Gebrauch (4,5fach) das Risiko einer Osteopenie.
Neue Substanzen
Derzeit stehen fünf Substanzklassen zur antiretroviralen Therapie zur Verfügung. Umso erfreulicher, dass noch neue Klassen und neue Substanzen entwickelt werden.
Attachment-Inhibitor: BMS-663068 interagiert mit gp120 und blockiert damit die Anbindung von HIV an die CD4-Zelle. In einer Phase-2-Studie war die Substanz gut wirksam und verträglich. Die Viruslast fiel im Lauf von acht Tagen um bis zu -1,8 log und die CD4-Zahl stieg um 28-106/µl). Der Attachment-Inhibitor kann einmal oder zweimal täglich gegeben werden und braucht keinen Booster. Die häufigsten Nebenwirkungen waren Kopfschmerzen (36%) und Hautauschlag (16%) (Nettles R et al., 49).
Tenofovir-Nachfolger: GS-7340 ist ein
Prodrug von Tenofovir, das sich im Lymphgewebe anreichert. In einer
präklinischen Studie, in der GS-370 mit Tenofovir verglichen wurde, senkte die
neue Substanz die Viruslast stärker und erreichte eine 400mal höhere
Konzentration in PBMCs sowie eine 3,5mal höhere im Knochen (Markowitz M et al.,
152LB).
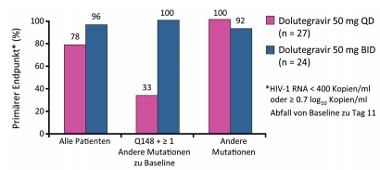
Abb. 9 VIKING: Dolutegravir „Funktionelle Monotherapie” bei Patienten mit Raltegravir-Resistenz
Integrasehemmer: Der Integrasehemmer Dolutegravir (früher GSK 572) ist hochwirksam, auch gegen Viren mit Integrasemutationen. In einer früheren Studie hatte die Substanz jedoch in der Dosierung 50 mg QD insbesondere bei Patienten mit einer Q148 plus mindestens einer zusätzlichen sekundären Mutation keinen durchschlagenden Erfolg. Dolutegravir 50 mg BID scheint hier effektiver zu sein. Nach 11 Tagen hatten alle Patienten mit dieser Konstellation das Therapieziel (HIV-RNA <400 K/ml oder >0,7 log Abfall) erreicht im vergleich zu 33% unter Dolutegravir 50 mg QD (Abb. 9) (Eron J et al., 151LB). Weitere Integrasehemmer der zweiten Generation mit Aktivität gegen resistente Viren sind Pyrimidion (Walker M et al., 528) und BI-C, der nicht an die katalytische Stelle bindet (Fenwick C et al., 523).
 Empfehlungen zum PrEP-Einsatz
Empfehlungen zum PrEP-Einsatz
Interim-Leitlinien des amerikanischen Center for Disease Control für Ärzte
Vor PrEP
Voraussetzung
- Negativer HIV-Test unmittelbar vor PrEP-Start
- Untersuchung auf akute HIV-Infektion bei Patienten mit Symptomen einer akuten HIV-Infektion
- Relevantes und kontinuierlich hohes Risiko für eine HIV-Infektion
- Kreatinin-Clearence = 60 mg/Min (z.B. Cockroft-Gault Gleichung)
Andere empfohlene Maßnahmen
- Screening auf Hepatitis B, Impfung gegen Hepatitis B wenn möglich oder bei aktiver Hepatitis B Behandlung unabhängig von der Verschreibung einer PrEP
- Screnning und Behandlung von sexuell übertragbaren Erkrankungen
Start PrEP
- 1 Tablette Tenofovir/Emtricitabin (Truvada®) täglich
- Im Regelfall nicht mehr als 90 Tabletten rezeptieren. Neues Rezept erst nach aktuellem negativem HIV-Test
- Bei aktiver Hepatitis B Tenofovir/Emtricitabin als Therapie der Hepatitis B und PrEP erwägen
- Beratung zur Risikoreduktion, PrEP-Adhärenz und Kondomgebrauch
Während PrEP
- Alle 2-3 Monate HIV-Test, negatives Ergebnis dokumentieren
- Bei jedem Besuch PrEP-Adhärenz überprüfen und unterstützen, häufigere Besuche bei unzureichender Adhärenz
- Alle 2-3 Monate Risikoverhalten überprüfen und zu Risikoverhalten und Kondomgebrauch beraten. Nach Symptomen von sexuell übertragbaren Erkrankungen fragen ggf. weitere Untersuchungen und Behandlung
- Alle 6 Monate Untersuchung auf sexuell übertragbare Erkrankung auch bei asymptomatischen Patienten und ggf. Behandlung
- 3 Monate nach Beginn sowie jährlich während PrEP Untersuchung von Harnstoff und Kreatinin
Ende PrEP
- HIV-Test
- Bei positivem HIV-Test, Resistenztest und Weiterleiten zum Schwerpunktarzt
- Bei negativem HIV-Test Weiterleiten an Institutionen zur Risikoberatung wenn indiziert
- Bei Diagnose einer aktiven Hepatitis B bei PrEP-Start Medikation zur kontinuierlichen Behandlung der Hepatitis B erwägen
Stand 25. 02. 2011
Cave: Truvada® ist nicht zur PrEP zugelassen. Eine Erstattung durch die Krankenkassen ist fraglich.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
