The International Liver Congress™ 2013
Gut, besser, am
besten
Die Hepatitis C-Therapie auf der Zielgeraden
 Der Leberkongress
stand ganz im Zeichen der neuen Optionen der Hepatitis C-Therapie. Diese werden
bei Genotyp 1 zunächst noch Interferon-basiert sein, doch die Interferon-freien
Kombinationen werden bald nachrücken. Gleichzeitig werden die SVR-Raten höher,
die Therapiedauer kürzer und die Verträglichkeit besser. Einzig die
fortgeschrittene Leberzirrhose bereitet noch Probleme bei der Heilung.
Der Leberkongress
stand ganz im Zeichen der neuen Optionen der Hepatitis C-Therapie. Diese werden
bei Genotyp 1 zunächst noch Interferon-basiert sein, doch die Interferon-freien
Kombinationen werden bald nachrücken. Gleichzeitig werden die SVR-Raten höher,
die Therapiedauer kürzer und die Verträglichkeit besser. Einzig die
fortgeschrittene Leberzirrhose bereitet noch Probleme bei der Heilung.
Der internationale Leberkongress, der alljährlich von der EASL (European Association for the Study of the Liver) veranstaltet wird, war mit über 9.000 Teilnehmer die bisher größte Tagung dieser Art. Hauptgrund für die steigenden Besucherzahlen dürfte die gerade besonders spannende Entwicklung im Bereich der Hepatitis C-Therapie sein. Hier zeigte sich erstmals ein klares Bild.
Der nächste Schritt
Ähnlich wie beim Start eines Stadtmarathons war in der Vergangenheit schwer zu erkennen, welche Substanzen/Läufer sich durchsetzen werden. Mittlerweile hat sich das Feld auseinandergezogen und ist damit übersichtlicher geworden. Die ersten Substanzen, die die Ziellinie der Zulassung erreichen werden, sind die HCV-Proteasehemmer Faldaprevir und Simeprevir sowie der Polymerasehemmer Sofosbuvir. Alle drei haben die Zulassung für HCV-Genotyp 1 in Kombination mit pegyliertem Interferon und Ribavirin (pegIFN/RBV) beantragt. Für Sofosbuvir wurde auch ein Antrag bei Genotyp 2 und 3 nur in Kombination mit Ribavirin eingereicht. Die entsprechenden Phase-3-Studien wurden auf dem Kongress vorgestellt. Mit der Zulassung rechnet man Anfang 2014.
Faldaprevir |
Simeprevir |
Sofosbuvir |
Vorteile der neuen Tripletherapie
Die neue Tripletherapie mit Faldaprevir oder Simeprevir oder Sofosbuvir bringt kaum höhere SVR-Raten als die Boceprevir- bzw. Telaprevir-basierte Tripletherapie, aber sie bietet andere Vorteile. Aufgrund der größeren antiviralen Potenz der Proteasehemmer der zweiten Generation bzw. von Sofosbuvir können deutlich mehr Patienten die Therapie auf 24 Wochen verkürzen. Weitere Vorteile sind die im Vergleich zu den ersten Tripletherapien einfachere Einnahme (jeweils 1x1 Tablette täglich ohne Fett) und die bessere Verträglichkeit. Zudem hat Sofosbuvir eine hohe Resistenzschwelle. In den bisherigen Studien wurde noch keine Resistenzentwicklung gegen Sofosbuvir beobachtet.
Auf die Frage, welche der drei neuen Triple-Optionen nun die beste sei, gibt es derzeit keine Antwort. Ergebnisse aus unterschiedlichen Studien sind bekanntermaßen nicht direkt miteinander vergleichbar und Studien, in denen die neuen Substanzen miteinander verglichen wurden, existieren nicht.
Zulassungsstudien
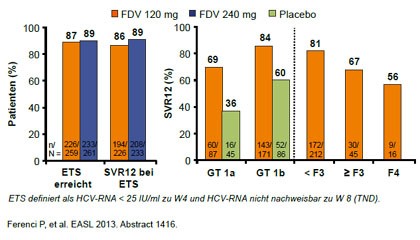 Abbildung 1: STARTVerso1: Faldaprevir vs. Placebo. SVR12 in Abhängigkeit von Ansprechen, Genotyp und Fibrosegrad.
Abbildung 1: STARTVerso1: Faldaprevir vs. Placebo. SVR12 in Abhängigkeit von Ansprechen, Genotyp und Fibrosegrad.
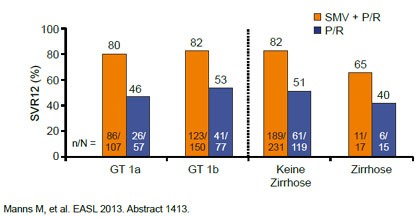 Abbildung 2: NEUTRINO: Simeprevir vs. Placebo. SVR12 in Abhängigkeit vom Genotyp und Fibrosegrad.
Abbildung 2: NEUTRINO: Simeprevir vs. Placebo. SVR12 in Abhängigkeit vom Genotyp und Fibrosegrad.
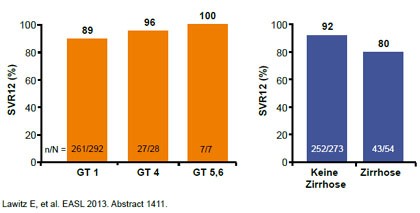 Abbildung 3: QUEST-2: Sofosbuvir/pegIFN/RBV. SVR12 in Abhängigkeit von Genotyp und Fibrosegrad
Abbildung 3: QUEST-2: Sofosbuvir/pegIFN/RBV. SVR12 in Abhängigkeit von Genotyp und Fibrosegrad
Faldaprevir wurde in der Studie STARTVerso1 (Ferenci P et al,# 1416), Simeprevir in den Studien QUEST 1- und 2 (Jacobson I et al, #3232, Manns M et al, #1413)
und Sofosbuvir in der Studie NEUTRINO ( Lawitz E et al, #1411) geprüft. An den Studien nahmen therapienaive Patienten mit GT1 teil, an NEUTRINO auch einige wenige Patienten mit GT 4, 5 und 6. In STARTVerso und Quest 1/2 war nach einer 12wöchigen Tripletherapie eine Therapieverkürzung auf 24 statt 48 Wochen vorgesehen, wenn die Patienten früh ansprachen (Faldaprevir <25 IU/ml Woche 4, negativ Woche 8; Simeprevir <25 IU/ml, negativ Woche 12). In NEUTRINO wurden alle Patienten nach 12 Wochen Tripletherapie 12 weitere Wochen mit pegIFN/RBV behandelt.
Eine SVR erreichten mit Faldaprevir 80%, mit Semiprevir erreichten 81% und mit Sofosbuvir 90%. eine SVR. Im Vergleich zur früheren dualen Therapie hatten in allen drei Studien damit jeweils rund 30% mehr Patienten eine SVR. Mit den Proteashemmern Faldaprevir bzw. SImeprevir konnten jeweils 90% der Patienten die Therapie auf ingesesamt 24 Wochen verkürzen. Gründe für Therapieversagen waren hier sowohl virale Durchbrüche (teils mit Resistenzmutationen) als auch ein Relaps. auf 24 Wochen verkürzen. Mit Sofosbuvir erreichten fast alle Patienten Virus-frei das Therapieende, aber 10% erlitten einen Relaps ohne Resistenzmutation.
Prädiktoren auf das Ansprechen wie der IL28B-Genotyp und
der HCV-1-Subtyp scheinen nach wie vor eine Rolle zu spielen. Patienten mit
GT1b hatten auf Faldaprevir und Patienten mit IL28B-CC auf beide Proteasehemmer
besser angesprochen. Auf Sofosbuvir hatten ebenfalls Patienten mit IL28B-CC
besser reagiert. Eine fortgeschrittene Fibrose war in allen Studien ein
negativer Prädiktor. Keine Rolle scheinen vorbestehende Resistenzmutationen zu
spielen. In STARTVerso1 hatten 23%
der Patienten eine Q80K bei Studienbeginn, was aber nicht mit der SVR12-Rate
korrelierte (Abb. 1-3).
Im Hinblick auf die Verträglichkeit sind die neuen
Substanzen ein Quantensprung. Sie verstärken die Ribavirin-
bedingte Anämie nicht und haben kaum unerwünschte Wirkungen. Unter Simeprevir
wurde bei 4% der
Patienten eine erhöhte Lichtempfindlichkeit, unter Faldaprevir bei 20% ein leichter
Hautausschlag und bei 5%
ein Ikterus beobachtet.
Sofosbuvir bei Genotyp 2 und 3
Die Wirksamkeit der Interferon-freien Therapie mit
Sofosbuvir/Ribavirin wurde in den drei Studien FISSON (Gane E et al, #5),
FUSION (Nelson D et al, #6) und POSITRON (Jacobson I et al, #61) geprüft. Die
Patienten waren therapie-naiv oder vorbehandelt und wurden 12 bzw. 16 Wochen
lang mit Sofosbuvir/Ribavirin behandelt.
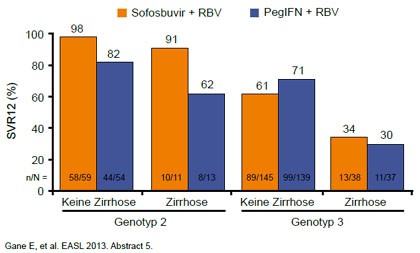 Abbildung 4: FISSION: Sofosbuvir/RBV vs. pegIFN/RBV. SVR12 in Abhängigkeit von Genotyp und Fibrosegrad.
Abbildung 4: FISSION: Sofosbuvir/RBV vs. pegIFN/RBV. SVR12 in Abhängigkeit von Genotyp und Fibrosegrad.
In allen drei Studien schnitten Patienten mit Genotyp 2 deutlich besser ab. Hier lagen die SVR-Raten bei Genotyp 2 über 90%. Eine Therapieverlängerung von 12 auf 16 Wochen hatte keinen additiven Effekt. Beim Genotyp 3 war das Bild ganz anders. Hier lag die SVR-Rate im Schnitt nur bei rund 60%, wobei fast alle Patienten am Therapieende HCV-frei waren, jedoch einen Relaps erlitten. Die Verlängerung auf 16 Wochen konnte hier die SVR-Rate erhöhen, was für eine zu kurze Therapiedauer spricht. Am schlechtesten hatten Patienten mit Genotyp 3 und Zirrhose abgeschnitten (Abb. 4).
Ende der Quad-Therapie?
Cave: Interferon-frei außerhalb der Zulassung
Mit Simeprevir plus Sofosbuvir, die voraussichtlich in Kombination mit pegIFN/RBV zugelassen werden, kann man sich eine Interferon-freie Therapie „basteln“. Erste Daten dazu gibt es sogar. In der COS-MOS-Studie erreichten über 90% der früheren Nonresponder mit GT1 eine SVR (Lawitz, E et al, CROI 2013). Das sind ermutigende Daten und Prof. Michael Manns, Hannover, der auf dem Kongress gefragt wurde, wie er zum Einsatz dieser Kombination außerhalb der Zulassung steht, antwortete ausweichend. Er gab zu Bedenken, dass die Erfahrung noch gering sei. Das Haupthindernis sei jedoch ver-mutlich der Preis der Kombination mit einer hohen Regress-Gefahr bei unbewilligtem„off-label“-Einsatz.
Ein wohl auslaufendes Konzept ist die Quadrupletherapie bestehend aus zwei direkt antiviralen Substanzen (DAA) plus pegIFN/RBV. Die Quad-Therapie mit GS-9451 (200 mg OD) plus HCV-NNRTI Tegobuvir (GS-9190; 30 mg BID) plus pegIFN/RBV beispielsweise erzielte zwar mit über 90% hohe SVR-Raten, doch entwickelten drei Patienten ernste Nebenwirkungen (Aplastische Anämie, Panzytopenie), worauf die Studie vorzeitig abgebrochen wurde. Das Unternehmen Gilead Sciences hat daraufhin nach Gesprächen mit der amerikanischen FDA die weitere Entwicklung von Quad-Regimen mit sofortiger Wirkung eingestellt und wird auch Tegobuvir nicht weiter entwickeln. Hintergrund dürfte abgesehen von der medizinischen Sicherheit auch der mangelnde klinische Vorteil der Quad-Strategie im Vergleich zu nahezu gleich wirksamen Interferon-freien Regimen sein.
Interferon-frei bei GT1
Das größte Interesse auf dem Kongress, galt der
Interferon-freien Therapie. Die Frage, welche Kombination hier die beste ist,
stellt sich nicht, da die meisten Unternehmen nur Kombinationen ihrer eigenen
Substanzen prüfen. Eher stellt sich die Frage, wie viele direkt antivirale
Substanzen (DAA) braucht man, welche Substanzklassen passen am besten zusammen
und wie lange muss man behandeln. Hier zeichnet sich ab, dass Ribavirin (vorerst)
mit an Bord bleibt, dass auch Nullresponder sehr gute Ergebnisse erzielen und
dass die Therapiedauer möglicherweise noch weiter verkürzt werden kann.
 Abbildung 5: AVIATOR: ABT-450/r+ABT267+ABT-333 +/- Ribavirin bei naiven Patienten und Nullrespondern mit GT1 ohne Zirrhose.
Abbildung 5: AVIATOR: ABT-450/r+ABT267+ABT-333 +/- Ribavirin bei naiven Patienten und Nullrespondern mit GT1 ohne Zirrhose.
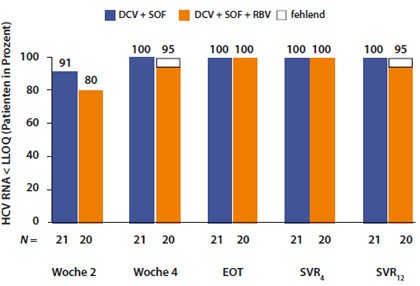
Abbildung 6: Daclastavir plus Sobosfuvir bei Versagern auf eine Boceprevir- oder Telaprevir-basierte Tripletherapie. Virologisches Ansprechen und SVR-Raten.
In der Studie AVIATOR beispielsweise erreichten therapienaive Patienten und Nullresponder mit GT1 nach 12 Wochen unter drei DAA plus Ribavirin SVR-Raten um 90%. Weniger als 2% der Patienten brachen die Therapie wegen Nebenwirkungen ab (Kowdley K et al, #3) (Abb. 5). Viele weitere Kombinationen sind in Phase-2-Studien, u.a. Faldaprevir plus Polymerasehemmer, Daclastavir und Asunaprevir, Sofosbuvir und Ledipasvir plus andere DAA. Mit der Zulassung der ersten Interferon-freien Kombination rechnet man 2015. Bis dahin ist vielleicht auch klarer, wen man wie lange mit wie vielen DAA behandeln sollte.
Hoffnung für Triple-Therapie-Versager
Eine der wirksamsten Interferon-freien Therapien mit nur zwei DAA scheint die Kombination Daclastavir und Sofosbuvir zu sein. Der NS5A-Inhibitor in Kombination mit dem Nukleotid hat schon bei therapienaiven Patienten nahezu 100%-ige Heilungsraten gezeigt. Nun wurde eine Studie an Therapieversager auf eine Boceprevir/Telaprevir-basierte Tripletherapie vorgestellt. In dieser kleinen Untersuchung an 41 Patienten waren 80% der Patienten bereits zu Woche 2 HCV-RNA negativ und alle Patienten (bei einem Patient fehlen die Daten) hatten eine SVR12 (Abb. 6). Alle Untergruppen hatten gleichermaßen angesprochen, auch frühere Non-Resonder. Die Therapiedauer betrug 24 Wochen (Sulkowski M et al, #1417). Die Kombination wird bei therapienaiven Patienten nicht beforscht, da das Unternehmen Gilead Sciences Sofosbuvir mit einem NS5A-Inhibitor aus dem eigenen Haus weiterentwickelt. Zum Thema vorbehandelte Patienten gibt es noch keine Äußerung (Vergl. Kommentar Achim Kautz, Deutsche Leberhilfe).
Boceprevir und Telaprevir
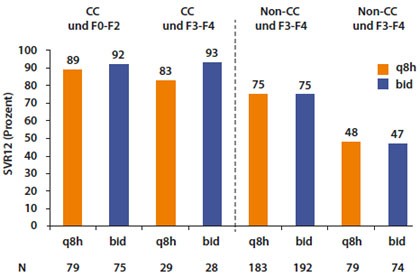
Abbildung 7: grad OPTIMIZE: Telaprevir TID vs. BID in Abhängigkeit von IL28B-Typ und Fibrosegreaf
Zu den zugelassenen Substanzen Boceprevir und Telaprevir wurden zahlreiche detaillierte Analysen der großen Zulassungsstudien vorgestellt. Bei Telaprevir wurde u.a. die Möglichkeit der zweimal täglichen Gabe bei allen Subgruppen bestätigt (Abb. 7) (Buti M et al, #798). Zudem kann die Behandlung von Patienten mit dem günstigen IL28B-Typ CC sowie Relapsern ohne Zirrhose und RVR auf 12 Wochen Therapie insgesamt verkürzt (Nelson DR et al, #881).
Tripletherapie bei Dialyse
Telaprevir und Boceprevir werden nicht über die Niere ausgeschieden und die Spiegel auch kaum durch die Hämodialyse beeinflusst. In einer kleinen Beobachtung (n=41) wurden nun auch endlich Daten zu dieser Patientengruppe vorgestellt. Die Boceprevir-Patienten erhielten ein vierwöchiges Lead in mit pegIFN 180 µg/Woche und 200 mg RBV 3x pro Woche und dann Boceprevir in der üblichen Dosierung. Telaprevir-Patienten starteten mit pegIFN 135µg/Woche und RBV 200mg/d (12.5%) oder 2x pro Woche (50%) oder 3x pro Woche (37.5%). Das Hämoglobin bei Therapiebeginn betrug im Schnitt 12.3 g/dl. Die Hälfte der Patienten entwickelte eine Anämie, wobei die Anämie unter Telaprevir stärker ausgeprägt war. Acht Patienten mussten stationär behandelt werden (4 Anämie, 2 Infektion/Pneumonie, 1 Aszites und 1 Dehydratation). Die SVR-Raten stehen noch aus (Sclair S et al, #900). In einer weiteren Studie TARGET C wurde der Effekt einer Teleprevir-Tripletherapie untersucht (Basu PP et al, #67).
Immer noch schwierig:
Zirrhose-Patienten
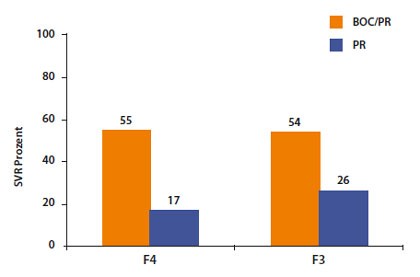 Abbildung 8: Boceprevir-Metaanalyse. SVR-Raten in Abhängigkeit vom Fibrose-grad.
Abbildung 8: Boceprevir-Metaanalyse. SVR-Raten in Abhängigkeit vom Fibrose-grad.
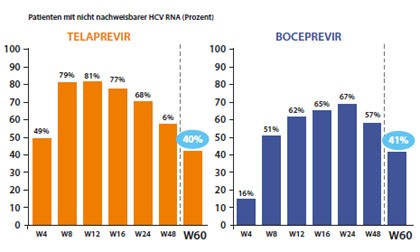 Abbildung 9: CUPIC-Studie. SVR-Raten bei Zirrhose-Patienten.
Abbildung 9: CUPIC-Studie. SVR-Raten bei Zirrhose-Patienten.
Patienten mit Zirrhose sollten in jedem Fall 48 Wochen behandelt werden. In einer Metaanalyse der Boceprevir-Studien lagen die SVR-Raten dann ebenfalls um rund 30% höher als bei der dualen Therapie (Vierling JM et al, #1430)(Abb. 8). Im klinischen Alltag sind die SVR-Raten jedoch geringer als die Zulassungsstudien mit Boceprevir und Telaprevir suggerieren. Dies mag u.a. daran liegen, dass Patienten mit fortgeschrittener Zirrhose (dekompensierter Zirrhose, Thrombozyten <90.000/µl) von den kontrollierten Studien ausgeschlossen sind. Zugelassen sind meist bestenfalls Patienten mit F4-Fibrose. Dass diese Patienten schwieriger zu behandeln sind, belegt der Vergleich mit Daten der französischen CUPIC-Studie und einer österreichischen Beobachtung an 94 Zirrhotikern aus dem „Praxisalltag“ (Abb. 9). In CUPIC erreichten nur 40% und in der österreichischen Studie sogar nur 28% eine SVR (Fontaine H et al, #60, Rutter K et al, #65). Diese Zahlen sind allerdings nur Durchschnittswerte. Frühere Relapser schneiden besser ab, frühere Nullresponder noch schlechter.
Gleichzeitig haben Zirrhose-Patienten auch ein deutlich höheres Risiko von gravierenden Nebenwirkungen. Negative Prädiktoren sind ein erhöhter Pfortaderdruck, ein Albumin <35 g/dl sowie Thrombozyten <100.000/µl (Hezode C et al, Hepatol 2013). Besonderes Augenmerk sollte man auf Infektionen richten. Sowohl im französischen CUPIC-Programm als auch in einer österreichischen Untersuchung starben die meisten Patienten an einer Sepsis (Rutter K et al, #65). Möglicherweise lässt sich das Risiko dieser Komplikation durch die prophylaktische Gabe von Antibiotika senken.
Zirrhose und neue Therapien
Auch bei den neuen Tripletherapien haben Patienten mit F4-Fibrose bzw. Zirrhose deutlich schlechter abgeschnitten. In QUEST-2 beispielweise erreichten mit der Simeprevir-Tripletherapie 86% der Patienten mit F0-2 eine SVR, aber nur 65% der F4-Patienten. Hier besteht noch großer Verbesserungs- und Forschungsbedarf. Generell herrscht das Paradigma, dass praktisch alle Patienten heilbar sind, wenn potente Substanzen mit hoher Resistenzbarriere ausreichend lange gegeben werden. Entsprechende Studien werden also in absehbarer Zeit sicherlich anlaufen.
Hepatitis B
Ein erklärtes Ziel der Behandlung der chronischen Hepatitis B ist es, die Progression der zu verhindern. Dies scheint auch im Hinblick auf den bindegewebigen Umbau zu gelingen. Studien mit Entecavir und Tenofovir belegen sogar einen Rückgang der Leberfibrose und auch die Zahl der Lebertransplantationen wegen Hepatitis B ist rückläufig. Nur die Rate an hepatozellulären Karzinomen (HCC) steigt immer noch.
HCC-Risiko reduziert
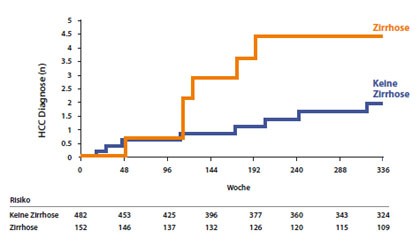 Abbildung 10: HBV-Virussuppression vermindert HCC-Risiko bei Patienten mit und ohne Zirrhose
Abbildung 10: HBV-Virussuppression vermindert HCC-Risiko bei Patienten mit und ohne Zirrhose
Hier könnte sich die langfristige Virussuppression doch günstig auswirken. Eine Berechnung anhand der Daten der Tenofovir-Zulassungsstudien zeigt einen präventiven Effekt der Langzeitbehandlung. In diesen beiden Untersuchungen an HBeAg-postiven und –negativen Patienten entwickelten 14 Patienten ein HCC und zwar 6/14 Patienten mit Zirrhose und 8/14 Patienten ohne Zirrhose (Abb. 9). Das HCC-Risiko der Zirrhose-Patienten war doppelt so hoch, da nur 25% aller Patienten eine solch ausgeprägte Leberschädigung aufwiesen. Ihr Risiko wurde – so der Vergleich mit historischen Daten – durch die Tenofovir-Langzeittherapie gesenkt. Das HCC-Risiko der Patienten ohne Zirrhose wurde sogar noch ausgeprägter, nämlich um 55% vermindert (Kim WR et al, #43).
Therapie bei Immuntoleranz?
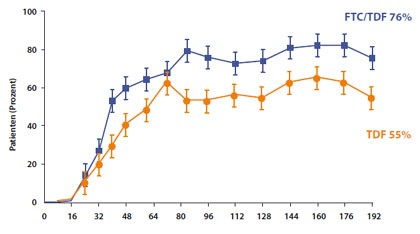 Abbildung 11: Anteil der Patienten mit einer HBV-DNA <69 IU/ml.
Abbildung 11: Anteil der Patienten mit einer HBV-DNA <69 IU/ml.
Die erste Studie zur Therapie von sogenannten immuntoleranten Patienten wurde vorgestellt. Diese Patienten haben eine hohe HBV-Viruslast ohne erhöhte Transaminasen. In der Untersuchung wurden 126 Patienten mit hoher Viruslast (1,7x107 IU/ml) mit Tenofovir oder der Fixkombination Tenofovir/Emtricitabin behandelt. Anders als in früheren Untersuchungen an nicht-immuntoleranten Patienten war in dieser Studie die Kombination überlegen. Nach vier Jahren lag die Viruslast bei signifikant mehr Patienten unter der Nachweisgrenze von 69 IU/ml bzw. 350 Kopien/ml (Abb. 11). Nur wenige Patienten (n=5) hatten eine HBeAg-Serokonversion und keiner einen HBsAg-Verlust. Bei vielen Patienten war noch eine geringe Virusreplikation nachweisbar. Resistenzen wurden jedoch überraschenderweise nicht beobachtet. Ungefähr die Häfte der Patienten stoppte die Medikation nach der Studie und alle hatten einen viralen Rebound bis zur Ausgangs-Viruslast (Chan HL et al, # 101). Zur abschließenden Beurteilung des Nutzens bzw. Risikos der Langzeittherapie dieser Patienten sind noch weitere Studien notwendig.
Heilung
 Kommentar Achim Kautz, Deutsche Leberhilfe
Kommentar Achim Kautz, Deutsche Leberhilfe
„Aus Sicht der Selbsthilfe ist es hocherfreulich, dass wir einer neuen Phase von Medikamenten, den sogenann-ten DAAs, entgegenstreben. Die neuen Medikamente und deren Kombinationen bringen für viele Betroffene die langersehnte Hoffnung auf Heilung. Es ist aus Sicht der Patienten nicht nachvollziehbar, wenn Thera-piekombinationen nicht zustande kommen, nur weil pharmazeutische Unternehmen Kooperationen scheu-en. Auf der einen Seite wird im Fall der Kombination von Daclastavir und Sofosbuvir von beiden Herstellern gesagt, dass alles Handeln auf das Wohl des Patienten ausgerichtet ist, auf der anderen Seite wird eine vielver-sprechende Kombination nicht ermöglicht, die genau dafür entwickelt worden ist: zum Wohle des Patienten. Patienten aus ganz Europa fordern beide Firmen auf Ihre Handlungsweise noch einmal zu überdenken und über Ihren marktorientierten Schatten zu springen.“
Auch bei der Hepatitis B versucht man, das Virus komplett zu eliminieren. Bisher gibt es noch keine großen Erfolge, aber doch kleinere Schritte. Ein Weg ist die Kombination von pegyliertem Interferon mit Polymerasehemmer als duale Therapie von Anfang an, als Add on-Strategie nach einer Vorbehandlung mit Polymerasehemmern oder als Switch-Strategie nacheinander. Maßstab für den Erfolg ist die HBs-Ag-Serokonverion. Prädiktor ist der Abfall des quantitativen HBs-Ag. Relevante Ergebnisse zu diesem Konzept wurden nicht präsentiert.
Ein wichtige Rolle bei der Heilung spielt auch die langfristige und starke Suppression der Virusreplikation. So wurde der cccDNA-Pool in einer Studie, in der Entecavir mit Lamivudin über 48 Wochen verglichen wurde, durch Entecavir signifikant stärker vermindert. Das Ausmaß der Reduktion korrelierte mit der Viruslast und GPT bei Therapiebeginn, der Senkung von HBV-DNA und GPT durch die Therapie im Blut, dem HBeAg-Verlust und dem Rückgang der Leberentzündung (Bowden S et al, # 759). Es gibt aber auch ganz neue Ansätze, die körpereigene Immunabwehr zu aktivieren, und zwar durch Toll-like Rezeptoragonisten ( Jo J et al, #55; Pflanz S et al, #394)
HBV-Impfung
Ein neuer Impfstoff ist in der Entwicklung. Die mit einem TLR9 als Adjuvans verstärkte Vakzine führt bereits mit zwei Impfungen im Abstand von 4 Wochen zu einer deutlich besseren Immunantwort als der herkömmliche Impfstoff dreimalig appliziert (Janssen R et al, #1426).
Hohe HCV-Prävalenz bei Migranten
Deutschland zählt zu den Ländern mit einer niedrigen Hepatitis C-Prävalenz. Die Prävalenz von HCV-Antikörpern in der Allgemeinbevölkerung wird auf 0,5 % geschätzt. Bei Migranten liegt sie jedoch deutlich höher. Im Rahmen einer Untersuchung wurden Daten von 8009 Patienten mit Migra-tionshintergrund in Arztpraxen erfasst. Die Prävalenz der chronischen Hepatitis C lag in den allgemeinmedizinischen/internistischen Praxen und Ambulanzen bei rund 6 %, in den gastroenterologischen/hepatologischen und Substitu-tions-Praxen sogar bei etwa 26 %.
Die Hälfte der HCV-positiven Patienten stammte aus den GUS-Staaten. Aus Asien kamen 10% und aus Afrika 5% der Patienten. Die meisten hatten sich beim intravenösen Drogengebrauch mit HCV infiziert (42 %). Am häufigsten war HCV-Genotyp 1 (59 %) gefolgt von Genotyp 3 (28%), Genotyp 2 (8 %) und Ge-notyp 4 (4%). Interessanterweise waren die Transaminasen nur bei der Hälfte der Patienten erhöht (Buggisch P et al, # 797).










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
