Ias 2015, Vancouver 19.-22. Juli 2015
 Therapie für alle und zwar gleich!
Therapie für alle und zwar gleich!

Jens Lundgren, Kopenhagen, bei der Präsentation der START-Studie
Foto: Ramona Pauli, München
Die 8. Konferenz der Internationalen Aids Gesellschaft (IAS) fand in Vancouver statt, an dem Ort, an dem vor 19 Jahren erstmals die Tripletherapie vorgestellt wurde. Auf der Konferenz damals gab es allerdings nicht nur lichte Momente. Es gab auch zahlreiche Protestaktionen. Das war bei der IAS-Konferenz 2015 nicht der Fall. Ganz im Gegenteil, die Stimmung war heiter und entspannt, die Teilnehmer genossen das schöne Kongressgebäude mit großen Fenstern und Blick aufs Meer.
Politischer Druck
Inhaltlich versuchte die IAS immer wieder an die historische Konferenz von 1996 anzuknüpfen. Damals wurden die Grundlagen für die antiretrovirale Kombinationstherapie gelegt, auf der aktuellen Tagung sei bei der PrEP und dem Therapiestart ein historischer Durchbruch gelungen. Entsprechend auch die Forderungen der „Vancouver Declaration“: Zugang zur Therapie und zur PrEP für alle und sofort. Eine solche „Declaration“ gibt es mittlerweile auf jeder internationalen Aids-Konferenz. Sie enthält eine Liste politischer Forderungen, die je nach aktuellem Thema leicht unterschiedliche Schwerpunkte haben. Die Forderung nach Therapie für alle stützt sich auf die Ergebnisse der START-Studie. Die Forderung nach PrEP geht im wesentlichen auf die Studien iPREX, PROUD und IPERGAY zurück, deren Ergebnisse schon bei früheren Konferenzen präsentiert wurden.
Insgesamt blieb somit der Eindruck zurück, dass auf dieser Konferenz von den führenden Forschern mehr Politik gemacht wurde als wissenschaftlich diskutiert.
START-Studie
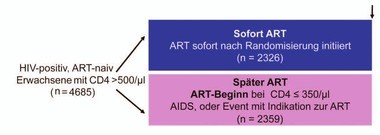
Abb. 1 START:
Studiendesign
Das Highlight der Konferenz war die Präsentation der START-Studie. START geht der Frage nach, wann man am bes-ten
mit der ART beginnt. Dazu wurden 4.685 therapienaive Patienten (54% aus Ländern mit mittlerem/niedrigen Einkommen) mit
CD4 >500/µl entweder sofort behandelt oder erst bei CD4 <350/µl oder AIDS (Abb. 1). Das Alter lag im Schnitt bei
36 Jahren, 26% waren Frauen und 44% waren Weiße. Die HIV-Diagnose lag rund ein Jahr zurück, die CD4-Zahl zu Baseline
betrug 650/µl, die Viruslast lag bei 12.000 Kopien/ml. 30% waren Raucher und der Framingham-Score mit 1,9 niedrig.
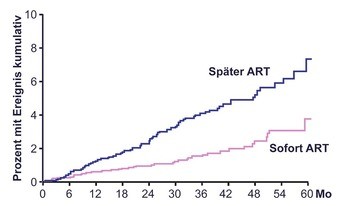
Abb. 2 START: Primärer Endpunkt (Kombination)
Primärer Endpunkt war AIDS, Tod wegen AIDS, gravierendes Nicht-AIDS Ereignis (kardiovaskulär, schwere Niereinsuffizienz, dekompensierte Lebererkrankung und nicht-AIDS-definierende Karzinome) sowie Tod. Im Mai 2015 nach einer durchschnittlichen Beobachtungszeit von drei Jahren wurde die Studie entblindet, weil der primäre Endpunkt in der sofort behandelten Gruppe signifikant seltener erreicht wurde (Ereignisrate pro 100 Patientenjahre 1,8 vs. 4,1; n=42 vs. 96; Risikoreduktion 57%) (Abb. 2). Die Untersuchung wird derzeit als offene Beobachtung weitergeführt.
Erste Ergebnisse
Jens Lundgren, Kopenhagen, präsentierte die mit Spannung erwartete erste detaillierte Auswertung der Daten. Die Therapie wurde im verzögerten Arm im Schnitt bei CD4 400/µl begonnen. Im Mai 2015 waren 98% der Patienten im „Sofort-Arm“ und 58% der Patienten im „Später-Arm“ behandelt. Ein Drittel der Patienten in letzterer Gruppe begannen die ART bei CD4/µl 250-350 und 8% <250/µl. Alle übrigen in diesem Arm starteten bei CD4 >350/µl, wobei 8% >750 CD4/µl hatten. Die ART war in beiden Gruppen gleichermaßen erfolgreich. Die Viruslast lag in beiden Gruppen bei über 95% unter der Nachweisgrenze. Der mediane Unterschied der CD4-Zellen zwischen beiden Armen betrug 200/µl.
Von der Behandlung profitierten alle analysierten Subgruppen, wobei das Konfidenzintervall bei einer Viruslast
<5.000 Kopien/ml und einer CD4-Zahl >800/µl sehr groß war. Direkt im Anschluss an die Präsentation wurden die
Ergebnisse zunächst einmal kommentiert von zahlreichen Vertretern der wichtigsten Organisationen (WHO, Ärzte ohne
Grenzen, PEP-FAR usw.). Diese wiederholten in mehr oder weniger ausladenden Bemerkungen das Fazit von Jens Lundgren:
„START zeigt klar, dass jeder HIV-Infizierte unabhängig von der CD4-Zahl behandelt werden sollte“. Eine entsprechende
Änderung der WHO-Leitlinien sei bereits in Vorbereitung. Für kritische Fragen blieb dagegen kaum Zeit und Raum (Lundgren
J et al., MOSY0302; N Engl J Med 2015).
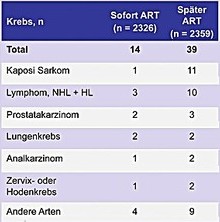
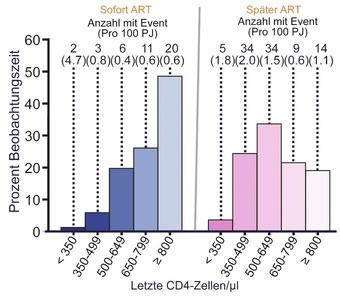
Die wichtigsten Ergebnisse im Überblick (sofort vs. später) Abbildungen 3-5
|
|
|
|
|
Switch auf TAF
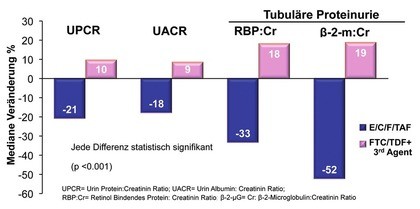
Abb. 6 Study 109: Veränderung (%) der quantitativen Proteinurie zu Woche 48
Tenofovir Alafenamid (TAF) ist ein Prodrug von Tenofovir, das zu deutlich geringeren Tenofovir-Spiegeln im Blut führt und daher toxische Effekte auf Niere und Knochen minimiseren soll. Die Substanz wird derzeit in mehreren Studien geprüft. Einige davon wurden in Vancouver vorgestellt. In der Studie 109 wurden über 1.500 komplett supprimierte Patienten von einem Tenofovir/Emtricitabin-haltigen Regime (plus Efavirenz oder plus Atazanavir/r oder plus Elvitegravir/c) entweder auf die Fixkombination TAF/FTC/EVG/c umgestellt oder sie nahmen ihr altes Regime weiter. Nach 48 Wochen war die virologische Wirksamkeit im Switch-Arm signifikant besser (97% vs. 93%), was im wesentlichen auf das bessere Abschneiden nach Umstellung von dem Proteasehemmer- und NNRTI-basierten Regime zurückging. Die Umstellung hatte günstige Auswirkungen auf die Knochendichte und Nierenparameter (Abb. 6). Bei den Lipid kam es unter dem neuen Regime zu einem geringen, aber signifikanten Anstieg der Cholesterin-Werte (Mills S et al., TUAB0102).
Besonders interessant ist die neue Tenofovir-Form TAF bei Patienten mit eingeschränkter Nierenfunktion. Diese Patienten (n=242, eGFR von 30-69 ml/Min) wurden von einem TDF- oder nicht-TDF-haltigen Regime auf TAF/FTC/EVG/c umgestellt. Die TDF-Dosis vor dem Switch war der Nierenfunktion angepasst und die Umstellung auf das neue TAF-haltige Regime ergab somit keine relevante Veränderung seitens der Niere. Bei den TDF-vorbehandelten Patienten führte der Switch zum Anstieg von Knochendichte und Lipiden (Gupta S et al., TUAB0103).
WAVES bei Frauen
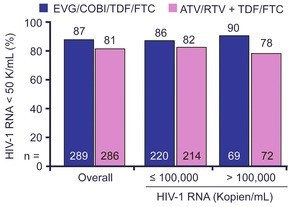
Abb. 7 WAVES: Ergebnisse zu Woche 48
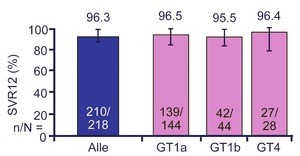
Abb. 8 C-EDGE: Gravoprevir/Elbasvir bei HIV/HCV-Koinfizierten. SVR12 nach 12 Wochen Therapie
Das ist eine Seltenheit: Eine reine Therapie-Studie nur an Frauen. In WAVES wurden 575 therapienaive Frauen (50% Schwarze) entweder mit der Fixkombination TDF/FTC/EVG/c oder TDF/FTC plus Atazanavir/r behandelt. Die CD4-Zahl lag bei 357/µl, die Viruslast bei 25% >100.000 Kopien/ml. Die Integrasehemmer-basierte Therapie schnitt signifikant besser ab. Mehr Frauen waren unter dem Integrasehemmer komplett supprimiert (87% vs. 80%) und bei Frauen mit hoher Ausgangsviruslast war die Differenz noch größer (90% vs. 78%) (Abb. 7). Ein virologisches Versagen wurde seltener beobachtet (9% vs. 12%). Eine Resistenzentwicklung wurde nur bei drei Frauen im Atazanavir-Arm beobachtet (alle M184 V/I). Die Abbruchrate lag im Integrasehemmer-Arm bei 10% (5/29 wegen Nebenwirkungen) und bei 16% (19/45 wegen Nebenwirkungen) unter dem Proteasehemmer (Squires K et al., MOLBPE08).
Ist STR besser?
Ist es egal ob man eine, zwei oder mehrere Tabletten pro Tag einnimmt? Dieser klinisch relevanten Frage ging eine prospektive offene Studie nach, an der über 3.000 therapienaive Patienten teilnahmen. Sie erhielten (2008-2011) entweder die Fixkombination TDF/FTC/EFV oder TDF/FTC+EFV bzw. TDF+FTC+EFV oder ein anderes Regime mit mehreren Tabletten. Die Auswahl traf der behandelnde Arzt. Gemäß der ITT-Analyse waren 48 Wochen nach Therapiestart mehr Patienten unter dem STR komplett supprimiert (79% vs. 64% vs. 64%). Das STR war auch preislich das günstigste Regime, wenn man die Kosten für eine erfolgreiche Therapie berechnet (Gatell J et al., TUEPB 264).
Raltegravir in der Schwangerschaft
Raltegravir scheint auch in der Schwangerschaft sicher und effektiv zu sein. In einer kanadischen Kohorte waren 18
Neugeborene Raltegravir exponiert. Bei einigen Müttern wurde der Integrasehemmer eingesetzt aufgrund eines erhöhten
Transmissions-Risikos wegen Resistenz, Viruslast >1.000 Kopien/ml im dritten Trimester oder späte ART. Raltegravir
war gut verträglich und die Viruslast konnte bei 14 Frauen bis zur Geburt tatsächlich unter die Nachweisgrenze
gesenkt werden. Zwei Neugeborene erhielten prophylaktisch Raltegravir wegen eines multiresistenten Virus der Mutter.
Auch bei den Kindern war die Verträglichkeit gut. Alle Kinder blieben HIV-negativ (Trahan MJ et al., TUAB0 105; Bitnun A
et al., MOPEC445).
Neue Medikamente
Doravirin ist ein neuer NNRTI, der auch gegen NNRTI-resistente Viren wirkt und CYP3A4 nicht beeinflusst. In einer Phase-2-Studie an Therapienaiven war 100 mg Doravirin genauso gut wirksam wie Efavirenz. Im Vergleich zu Efavirenz ist jedoch die ZNS-Verträglichkeit deutlich besser und eine Erhöhung der Lipide seltener (Gatell J et al. TUAB0104).
BMS-955176 ist ein Maturaseinhibitor der zweiten Generation, der reversibel das Gag-Protein von HIV blockiert. Im Rahmen der klinischen Entwicklung wurde die Kombination von BMS-955176 in Kombination mit 2NRTI, Atazanavir/r und ungeboostertem Atazanavir untersucht. Es wurde eine gute virologische Wirksamkeit und Verträglichkeit beobachtet. In weiteren Studien soll nun der Einsatz als „Booster“ bzw. im Rahmen eines Nuke-sparenden Regimes geprüft werden (Hwang C et al. TUAB0106LB).
12 Jahre funktionelle Heilung
Beim „Mississippi-Baby“ kam es 27 Monate nach Absetzen der ART zum HIV-Rebound. Bei den „Visconti-Patienten“ beträgt die längste Zeit ohne Medikamente und ohne HIV im Blut 9,5 Jahre. Den derzeit Rekord an HIV-freier Zeit ohne ART hält eine junge Frau, deren Fall Dr. Asier Sáez-Cirión vom französischen Pasteur-Institut auf dem CURE-Meeting vorstellte.
Die junge Frau hatte eine HIV-positive Mutter. Nach ihrer Geburt erhielt sie daher wie üblich prophylaktisch AZT über 6 Wochen. Kurz nach dem Absetzen von AZT wurde HIV nachgewiesen, d.h. das Kind war HIV-infiziert. Aufgrund der hohen Viruslast von über 2 Mio Kopien/ml wurde das Mädchen dann im Alter von 3 Monaten antiretroviral behandelt. Die Viruslast unter Therapie lag im Lauf der nächsten Jahre unter der Nachweisgrenze. Im Alter von 6 Jahren setzten die Eltern die ART ab und bei einer Untersuchung ein Jahr später wurden keine Viren um Blut gefunden. Das Mädchen hat bis heute keine Therapie.
Bei Mississippi-Baby hoffte man, die HIV-Infektion durch die frühe Therapie geheilt zu haben. Im Fall der jungen Frau ist HIV im Körper nachweisbar und es gab sogar zwei Messungen mit sehr niedriger Viruslast (510 und 48 K/ml). Die Vermehrung von HIV wird dennoch durch unbekannte körpereigene Mechanismen unterdrückt. Welche Rolle die Virusblips dabei gespielt haben könnten, ist unklar.
CAVE: Einzelfall
Dass der Fall der 18jährigen ein Einzelfall ist, belegt die Analyse der Daten von über 10.000 HIV-positiven Müttern in der französischen ANRS (Agence Nationalede Recherche sur le SIDA)-Kohorte. In dieser Kohorte werden seit 1989 auch die Daten von 579 infizierten Kindern gesammelt.
200 der Kinder wurden vor dem sechsten Lebensmonat behandelt, 15 haben die ART bei einer Viruslast <500 Kopien/ml abgesetzt. Bei 12/15 Kindern kam es innerhalb von einem Jahr, bei 1/15 innerhalb von 3 Jahren zum Rebound. Lediglich bei der mittlerweile 18jährigen Frau, bei der die ART im Alter von 6 Jahren abgesetzt wurde, war HIV im Blut selbst mit einem hochempfindlichen Test (Nachweisgrenze 4 Kopien/ml) nicht nachweisbar. Die französischen Forscher raten daher von einem Absetzen der Medikation oder Unterbrechungen dringend ab (Sáez-Cirión A et al. MOAA0105LB).
Hepatitis-Koinfektion
Selbstverständlich gab es auch auf dieser Konferenz Hepatitis-Sessions. Hier wurde unter anderem C-EDGE vorgestellt.
In der Studie erhielten HCV-therapienaive HIV/HCV-Koinfizierte (n=218) mit GT 1, 4 oder 6 12 Wochen lang die neue
Fixkombination Grazoprevir/Elbasvir (Proteasehemmer/NS5A-Hemmer). Nahezu alle Patienten waren antiretroviral behandelt,
wobei Proteasehemmer im Regime nicht erlaubt waren. Die SVR12-Rate mit 96% ist beein-
druckend. Fünf Patienten hatten
einen Relaps (4/5 mit RAVs) und zwei Patienten hatten sich erneut infiziert (Abb. 8). Die Verträglichkeit war sehr gut
(Rockstroh J et al., TUAB0602LB).
Auch mit Sofosbuvir/Ledipasvir kann man hohe Heilungsraten erzielen. In ION-4, an der 335 HIV/HCV-Koinfizierte mit GT 1 oder 4 teilgenommen hatten, erreichten nach 12 Wochen Therapie ebenfalls 96% die SVR12. 18% der Patienten hatten bei Therapiebeginn NS5A-Varianten, 93% wurden dennoch geheilt. Nach der Behandlung hatten 10/12 Patienten mit virologischem Versagen NS5A-RAVs. NS5B-Varianten wurden weder vor noch nach der Therapie beobachtet (Cooper C et al., TUAB0202).
Welchen klinischen Effekt hat die Heilung der Hepatitis C? Dies ist eine wichtige Frage, nicht nur im Hinblick auf die Kosten der Therapie. Eine spanische Beobachtung über sieben Jahre zeigt, dass vor allem Patienten ohne fortgeschrittene Fibrose im Hinblick auf Komplikationen und Mortalität profitieren. Bei persistierender fortgeschrittener Fibrose ist die Mortalität trotz SVR weiter erhöht (Moreno S et al., TUAB0204).
Heilung
Heilung war wie immer ein Thema (insbesondere bei dem im Vorfeld stattfindenden „CURE-Meeting“), stand auf der IAS-Konferenz jedoch stark im Hintergrund. Es gab auch nichts Sensationelles zu vermelden. Selbst die 12 Jahre funktionelle Heilung bei einer Jugendlichen führte nicht zu den sonst üblichen Schlagzeilen. Die Forscher sind zu den Grundlagen zurückgekehrt, machen Basisarbeit und generieren Hypothesen. Eine davon stammt von Robert Siliciano, Baltimore, einem führenden Experten für das latente Reservoir. Die neue Idee: Die latenten Zellen in der „tiefen Latenz“ halten, so dass sie nicht replizieren, z.B. mit TAT-Inhibitoren (Siliciano R et al. MPSY0202; Valente S MOSY0203). Ein weiterer Ansatz ist die „Boosterung“ des Immunsystems, z.B. durch breit neutralisierende Antikörper oder auch Interferon (Fauci A MOSS0102; Sandler N MOBS0104 und TUSA0506).
Begleiterkrankungen
Immer wieder werden große Kohorten analysiert, wenn die Frage auftaucht, ob HIV häufiger zu Erkrankungen von Herz-Kreislauf, Nieren usw. führt. Viele Autoren haben ein erhöhtes Risiko gefunden, andere wiederum nicht. In Kanada – so eine retrospektive Auswertung der Daten von knapp 9.000 behandelten Patienten – stiegen im Lauf von neun Jahren kardiovaskuläre Erkrankungen und COPD nicht an, während Hypertonie, Diabetes und Nierenerkrankungen doch etwas häufiger wurden. Deutlich häufiger bei HIV-Infizierten waren Lebererkrankungen, allerdings mit deutlich abnehmender Tendenz in den letzten Jahren (Gali B et al., WEPEB355).
Aus Deutschland wurden zwei Arbeiten präsentiert. Stefan Esser, Essen, zeigte, dass die QT-Zeit bei HIV-Patienten im Vergleich zu Kontrollen, unabhängig von der ART, Begleitmedikation und HIV-Stadium verlängert ist (Esser S et al., TUPD010). Christoph Spinner, München, fand heraus, dass Darunavir/r sowie TDF/FTC/EVG/c keine Insulinresistenz verursacht (Spinner C et al., TUPD0105).
Prävention
HIV-Medikamente werden in Zukunft der wichtigste Baustein der Prävention sein und zwar aufgrund der Forderungen aus der START-Studie (Sofortiger Therapiebeginn) und dem WHO-Ziel 90/90/90 (90% Diagnosen, 90% Behandelt, 90% unter der Nachweisgrenze). Die Strategie heißt Treatment as Prevention (TaP) oder Test and Treat (T&T). Dass diese Strategie funktioniert, belegt die Studie HPTN 052, deren finale Ergebnisse vorgelegt wurden. In HTPN 052 hat kein erfolgreich behandelter Patient seinen Partner angesteckt. Nach Beginn der ART wurden insgesamt acht Infektionen innerhalb der Partnerschaft dokumentiert. Vier Personen hatten sich kurz vor oder kurz nach Therapiebeginn des Partners infiziert, weitere vier Personen während eines virologischen Versagens der ART infiziert (Cohen M et al., MOAC 0101LB; Eshleman S et al., MOAC0106 LB; Fogel J et al., MOPEC417). Eine weitere Strategie ist die PrEP (Präexpositionsprophylaxe). Als Beleg für deren Wirksamkeit gibt es die Studien iPREX, PROUD und IPERGAY. Die Ergebnisse sind bekannt. Die präventive Einnahme von mindestens 4 Tabletten TDF/FTC pro Woche bzw. zwei Tabletten vor dem Sex und eine danach schützt vor HIV.
Wichtig: Tablette nach Sex
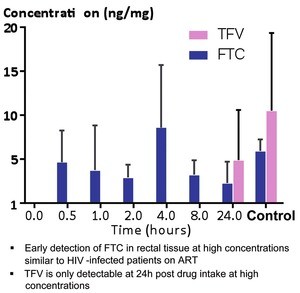
Abb. 9 TDF- und FTC-Spiegel im Rektalgewebe
Bei der Sex-getriggerten PrEP sind die Bücher noch nicht geschlossen. Reicht eine Tablette vorher? Oder doch lieber zwei Tabletten? Wie lange vorher? Und nachher unbedingt auch? Diesen Fragen ging die pharmakokinetische Subanalyse von IPERGAY nach. Dabei zeigt sich, dass der Spiegel von FTC und TDF im Blut rasch ansteigt, in der Rektalschleimhaut ist TDF jedoch erst nach 24 Stunden nachweisbar. Zwei Tabletten erhöhen den Spiegel, jedoch nur einmalig vor dem Sex genommen ist der Schutz nur 40%. Die Tablette nach dem Sex sollte man daher bei „sporadischer“ PrEP auf keinen Fall vergessen (Abb. 9) (Molina J-M et al., MOSY0102).
Bei Frauen könnte die intermittierende PrEP schwierig sein. Die maximalen Tenofovir-Spiegel in der Zervix erreichen nur ein Zehntel der Spiegel in der Rektalschleimhaut und steigen zudem weitaus langsamer an (maximaler Spiegel rektal/zervikal 5 vs. 10 Tage) (Glidden D et al., MOSY0109).
PrEP -Implementierung
TDF/FTC zur täglichen PrEP ist in den USA seit mehreren Jahren zugelassen. Erste Erfahrungen wurden im „Demo Project“ gesammelt. An der offenen Untersuchung (2012 bis 2014) nahmen 557 MSM und transgender Frauen in San Fransisco, Miami und Washington DC teil. Die Adhärenz sei, so der Studienleiter Albert Liu, generell gut. 63% der Teilnehmer hatten ausreichende TDF-Spiegel bei jeder Untersuchung. Junge Männer und Schwarze hätten allerdings deutlich seltener mindestens vier Tabletten pro Woche eingenommen (Liu A et al., TUAC0202).
Die erste große globale „Machbarkeits-Studie“ ist HTPN067. In dieser Studie wurden drei PrEP-Optionen an drei verschiedenen Patientengruppen untersucht. Die Gruppen waren MSM in Bangkok (n=178), MSM in Harlem, New York (n=179) und Frauen in Kapstadt, Südafrika (n=179). Den Patienten wurde eine der folgenden Optionen zugeteilt, die sie selbstständig 24 Wochen anwenden sollten:
- täglich 1x 1 Tablette (täglich) oder
- 2 Tabletten pro Woche und 1x 1 Tablette nach Sex (wöchentlich) oder
- 1x 1 Tablette vor Sex (bis zu 48 Std vorher) und 1x 1 Tablette nach Sex (bis zu 2 Stunden) (Sex-getriggert)
Generell nicht mehr als 2 Tabletten am Tag und nicht mehr als 7 Tabletten pro Woche. Nach einer DOT-Phase zur Spiegelmessung mussten die Probanden die PrEP 24 Wochen lang selbständig durchführen. Die Adhärenz wurde durch elektronische Boxen gemessen, die jedes Öffnen protokollierten. Die sexuelle Aktivität wurde wöchentlich per Telefon erfragt.
Am besten täglich?
In allen drei Gruppen war die Adhärenz bei der täglichen Einnahme am besten – allerdings mit großen Unterschieden zwischen den Gruppen. Am besten schnitten die thailändischen MSM ab. Sie nahmen 85% der täglichen Medikation, 79% der zweimal wöchentlichen Dosis und 65% der „Sex-getriggerten“ Dosen.
In Harlem wurden 65%, 46% und 41% der drei Optionen eingenommen. Am häufigsten wurde die Dosis nach dem Sex vergessen und zwar sowohl beim wöchentlichen als auch beim Kontakt-getriggerten Regime. Diese Einnahme war besonders schwierig, wenn der Sexpartner noch da war oder die Probanden nicht zu Hause waren.
Zweimal während der Untersuchung wurden Tenofovir-Spiegel gemessen. In Bangkok hatten 90% der Teilnehmer
nachweisbare Blutspiegel in allen drei PrEP-Gruppen, in Harlem und Kapstadt war Tenofovir bei täglicher Einnahme
deutlich häufiger nachweisbar. Die MSM in Bangkok waren auch am häufigsten bei sexuellen Kontakten geschützt (Abb. 10).
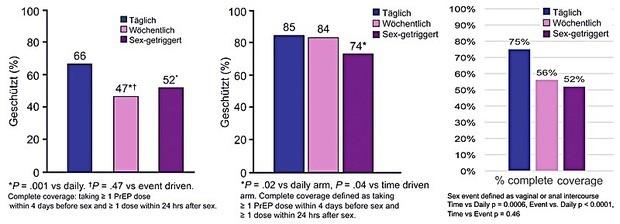
Abb. 10 HPTN 067/ADAPT: Geschützte sexuelle Kontakte in Harlem, Bangkok und Kapstadt (%)
Als Gründe für die sehr unterschiedliche Adhärenz wurden in erster Linie soziale Faktoren (80% der Teilnehmer in Harlem und Kapstadt waren arbeitslos), Stigmatisierung („dann glaubt man, ich habe Aids“) und Informationsstand bzw. Glaube an die Wirksamkeit identifiziert. Hinsichtlich der Verträglichkeit fand sich kein Unterschied. Am häufigsten wurde über Benommenheit, Kopfschmerz, Übelkeit und Diarrhoe in den ersten zwei Monaten geklagt. Das sexuelle Verhalten der Teilnehmer blieb unverändert (Mannheimer S et al., MOAC0305LB; Holtz TH et al., MOAC0306LB; Wallace M et al., TUPEC515).
Dr. Ramona Pauli, München










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
