Virtual | Croi (conference On Retroviruses And Opportunistic Infections) 6.-10. März 2021
HIV und COVID-19 Zwei Pandemien, ein Kongress
Die CROI fand in diesem Jahr zum zweiten Mal als virtueller Kongress statt. Im Gegensatz zum letzten Jahr als die Konferenz vor Ort sehr kurzfristig abgesagt werden musste, hatte man in diesem Jahr viel Zeit für die technische Vorbereitung. Das hat sich gelohnt. Die virtuelle Plattform war übersichtlich und einfach zu bedienen, die Technik klappte reibungslos. Offenbar hat auch das virtuelle Format die Attraktivität der Konferenz nicht beeinträchtigt – was vielleicht aber auch am relativ hohen Anteil von COVID-19-Beiträgen lag. Rund ein Viertel der Arbeiten beschäftigten sich mit dem Corona-Virus.
Es wurden wie üblich über 1.000 Abstracts eingereicht. 600 Poster wurden im Rahmen des neuen Formats „Science Spotlights“ von den Autoren als fünfminütige Präsentation vorgestellt. 3.500 Teilnehmer hatten sich registriert. Wie viele sich dann letztendlich zu welchen Sessions eingeloggt hatten, bleibt das Geheimnis des Veranstalters und wie viele der Eingeloggten, dann tatsächlich auch konzentriert den Vorträgen gelauscht haben, bleibt das Geheimnis der Teilnehmer selbst.
Neue Substanzen
Die derzeitigen Regime sind so wirksam, verträglich und einfach, dass man sich kaum vorstellen kann, dass es noch besser geht. Im Hinblick auf die Wirksamkeit ist hier auch kaum Luft nach oben. Dennoch gibt es (erfreulicherweise) neue Substanzklassen in der Pipeline, die sich durch das Fehlen von Kreuzresistenzen auszeichnen sowie Entwicklungen, die längere Dosierungsintervalle möglich machen.
Lenacapavir
Der Kapsidinhibitor Lenacapavir wurde in der kleinen Salvage-Studie CAPELLA an 72 stark vorbehandelten Patienten mit Therapieversagen und Multiresistenz eingesetzt. Die Viruslast der Teilnehmer lag im Schnitt bei 4,2 log, die CD4-Zahl bei 150/µl. Zunächst wurde Lenacapavir als funktionelle Monotherapie oral an Tag 1, 2 und 8 gegeben, was die HIV-RNA bis zum Tag 15 im Schnitt um -2log-Stufen verminderte. Bei 88% war die HIV-RNA um mindestens -0,5 log abgefallen. Anschließend erhielten die Patienten nach Optimierung der Hintergrundtherapie ihre erste Subkutan-Injektion von Lenacapavir Q6M. Im weiteren Verlauf der noch laufenden Studie erreichten nach 26 Wochen 73% (19/26) der Teilnehmer eine Viruslast <50 Kopien/ml (Abb. 1). Zwei Patienten hatten eine Resistenz entwickelt, wobei die Mutation M66I sowohl eine hochgradige Resistenz vermittelt als auch die Replikationskapazität etwas vermindert. Die Verträglichkeit war im Allgemeinen gut. Am häufigsten waren lokale milde Impfreaktionen (Segal-Maurer S et al., 127).
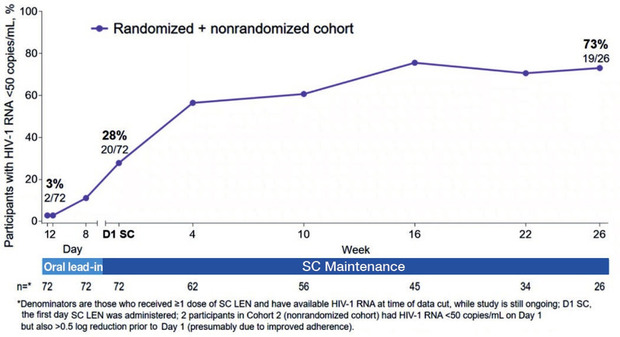
Abb 1 Anteil der Patienten (n=72) mit einer Viruslast <50 Kopien/ml unter Lenacapavir subkutan
Maturationshemmer
Die erste Dosisfindungsstudie zum „next generation“ Maturationshemmer GSK3640254 wurde von Christoph Spinner aus München vorgestellt. 200 mg/d oral über 10 Tage verminderte die HIV-RNA um -2log. Unter dieser Monotherapie entwickelten jedoch 4/6 Teilnehmer die Resistentmutation A364A/V, bei siebentägiger Gabe dagegen nicht. Probleme mit der Sicherheit/Verträglichkeit ergaben sich nicht (Spinner C et al., 126).
Islatravir
Das NNRTI Islatravir hat eine lange Halbwertszeit. In einer 2b-Studie wurde es erfolgreich als einmal tägliche Gabe mit Doravirin kombiniert. Blips waren selten und nicht mit Therapieversagen assoziiert (Orkin C et al., 416). Ein weiterer potentieller Kombinationspartner ist Lenacapavir. Die Hersteller MSD und Gilead Sciences haben kürzlich einen Vertrag zur gemeinsamen Entwicklung und Vermarktung der beiden Substanzen als 2-Drug-Regime geschlossen.
NNRTI MK8507
Ein günstiger Kombinationspartner für Islatravir könnte der neue NNRTI MK-8507 sein. Die Substanz hat ein ähnlich günstiges Resistenzprofil wie Doravirin und sie hat das Potential zur einmal wöchentlichen Gabe (Diamond TL et al., 129).
Temsavir
Zwar zugelassen, aber doch recht neu ist Fostemsavir, der erste Attachment-Inhibitor. Er hat sich in der Zulassungsstudie BRIGHT an stark vorbehandelten Patienten bewährt. Nun wurde analysiert, ob eine Temsavir-Resistenz die Empfindlichkeit auf Ibalizumab und/oder Maraviroc einschränkt. Es wurde keine Kreuzresistenz beobachtet (Rose B et al., 1306).
ART Long Acting
Die neue Ära der ART mit Depotspritzen wird demnächst beginnen. In der Studie ATLAS-2 zeigte die zweimonatliche Gabe nach 96 Wochen eine konstante Wirksamkeit vergleichbar mit der monatlichen Injektion (VL >50 K/ml 90,2% vs 91,0%). Ein virologisches Versagen (zweimal aufeinanderfolgend VL >200 K/ml) im Lauf der zwei Jahre wurde bei zwei Patienten (0,4%) in der Q4M- und bei neun Patienten (1,7%) in der Q8M-Gruppe beobachtet. Die meisten Resistenzentwicklungen traten im ersten Behandlungsjahr auf. Im zweiten Jahr kam es lediglich zu einem virologischen Versagen (Jäger H et al., 401).
Wichtig: Nicht zu spät
Entscheidend für die Wirksamkeit ist, wie auch bei der oralen Therapie, die richtige Anwendung. Insbesondere bei der Q8W-Dosierung ist die zeitgerechte Applikation wichtig. Doch was passiert bei längeren Injektionspausen? Eine Verzögerung der zweiten, dritten oder vierten Gabe von Cabotegravir/Rilpivirin Q2M um eine Woche hat den Autoren einer pharmakokinetischen Simulationzufolge wenig Auswirkungen. Sie empfehlen allerdings bei Verzögerungen ohne orales Bridging von <1 Monat (<2 Monate zwischen der ersten und zweiten Injektion oder <3 Monate zwischen den folgenden Injektionen) so früh wie möglich jeweils 3 ml zu geben. Bei Verzögerungen >1 Monat (>2 Monate zwischen erster und zweiter Injektion oder >3 Monate zwischen den folgenden Monaten) das Regime mit 3 ml erneut zu starten und nach einem Monat wieder 3 ml Q2M zu geben (Han K et al., 373).
PreP Long Acting
Neue Entwicklungen bei der PrEP gehen vor allem in Richtung längere Wirkdauer. Die Nase vorn hat hier Islatravir, das in einem Röntgen-dichten Implantat ein Jahr lang wirksam ist (Matthews R et al., 88LB) (Abb. 2). Auch der Capsid-Inbibitor Lenacapavir, der im therapeutischen Einsatz bei subkutaner Gabe sechs Monate wirkt, könnte ersten Tierversuchen zufolge, für die PrEP geeignet sein (Bekerman, E et al., 717). TAF einmal wöchentlich verhinderte im Tierversuch ebenfalls SHIV-Infektionen in einer Dosierung von auf den Menschen umgerechnet 225-450 mg (Maasud L et al., 714).
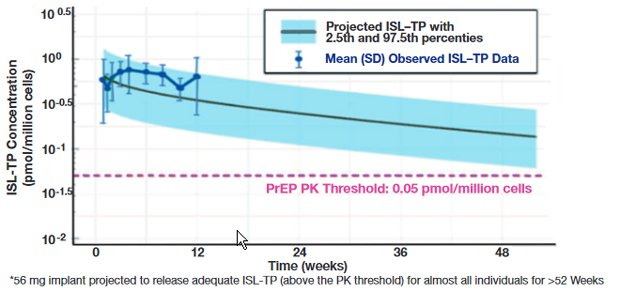
Abb 2 Islatravir-Implantat liefert ausreichenden Wirkstoff-Spiegel zur PrEP für 52 Wochen
PrEP-Studie HTPN 083
Am
weitesten in der Entwicklung ist hier Cabotegravir. In der Studie
HTPN 083, in der Cabotegravir Q2M intramuskulär gegen TDF/FTC
geprüft wurde, war der Integrasehemmer der oralen PrEP so deutlich
überlegen, dass die Studie vorzeitig beendet wurde. Unter
Cabotegravir wurden 16 HIV-Infektionen, unter TDF/FTC
42
HIV-Infektionen beobachtet. Die Erklärung für die Infektionen unter
der oralen PrEP ist einfach: 3/42 Patienten waren bereits bei
Studienbeginn infiziert, 38/42 Patienten hatten keinen ausreichend
hohen Medikamentenspiegel und 1/42 Patient hatte sich wohl mit einer
„PrEP-resistenten“ Variante (K65R) angesteckt.
HIV-Test bei PrEP
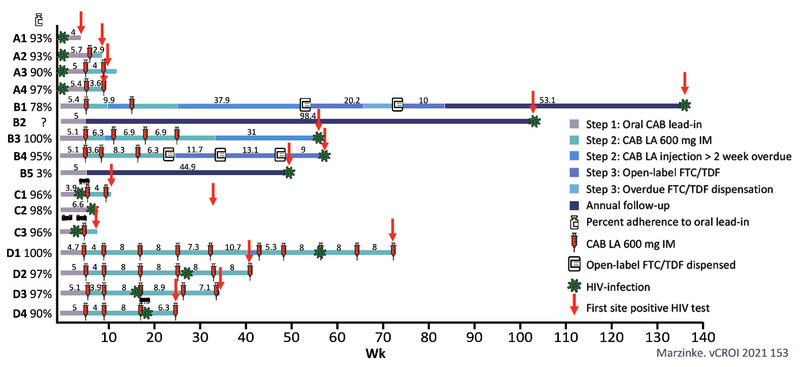
Die
Infektionen unter Cabotegravir waren komplexer und teilweise sehr
schwer zu diagnostizieren, da der lange Medikamentenspiegel die
Virusreplikation und die Antikörperbildung vermindern bzw. verzögern
kann. 4/16 waren bei Baseline schon infiziert. 5/16 Patienten hatten
sich nach Absetzen von Cabotegravir
angesteckt. 3/16 Infektionen
fanden im oralen Lead-in statt. Bleiben 4/16 Infektionen bei
ausreichenden Medikamentenspiegeln. Als Ursache werden schwankende
Medikamenten-Konzentrationen sowie unterschiedliche Spiegel in
verschiedenen Kompartimenten diskutiert. Der HIV-Test wurde bei
diesen Patienten teils erst Wochen nach der Infektion positiv und
auch der direkte Virusnachweis war schwierig. Die Verzögerung der
ART bei Weiterführung der PrEP führte in einem Fall zur
INSTI-Resistenz (Marzinke M et al., 153 LB) (Abb. 3).
Unerwünschte Wirkungen
Es wurden mehrere Kohortenanalysen und Auswertungen kontrollierter Studien zum Thema ART und Gewichtszunahme präsentiert. In der großen Kohorte RESPOND mit über 14.000 Teilnehmern (Einschluss median 2013, Beobachtung 2,6 Jahre, Europa und Australien) war ein niedrigeres Gewicht vor Therapiebeginn der stärkste Risikofaktor für eine BMI-Zunahme >7%. Weitere Faktoren waren Dolutegravir, Raltegravir und TAF, wobei die Zunahme unter der Kombination DOL/TAF größer war als unter den Einzelsubstanzen (Bansi-Matharu L et al., 507). In der Trio-Kohorte mit über 2.000 Teilnehmern, die nach 2015 auf ein neues INSTI-basiertes Regime umgestellt wurden, fand sich ebenfalls eine stärkere Zunahme beim Switch von TDF auf TAF (McComsey GA et al., 503). Ein ähnliches Bild zeigt die HOPS-Kohorte (n=736), in der der Gewichtsverlauf nach Switch auf INSTI- und Non-INSTI-Regime mit/ohne TAF verglichen wurde (Palella F et al., 504) (Abb. 4).
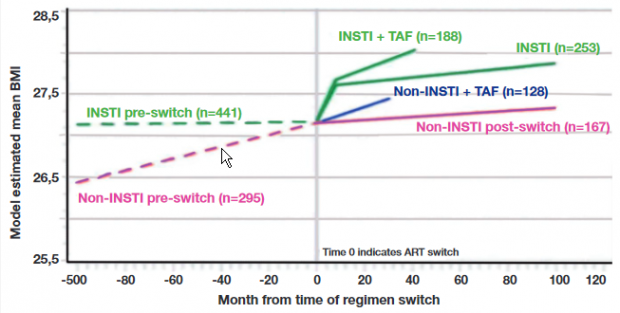
Abb 4 HOPS-Kohorte (n=736) BMI-Verlauf nach Switch 2007-2018
Langzeitdaten
Nicht zuletzt wurden auch Langzeitdaten zu etablierten Regimen vorgestellt. Bictegravir/F/TAF hat sich in den Studien 1489 und 1490 über vier Jahre bewährt. Das STR war wirksam und gut verträglich. 99-100% der Teilnehmer waren zu Woche 192 komplett supprimiert. Selbst eine vorbestehende Mutation M184V beeinträchtigt die Wirksamkeit nicht. Kein Patient brach die Behandlung wegen Nierenproblemen ab (Workowski K et al., 415, Acosta RK et al., 430)
Das
2DR Dolutegravir/3TC war in den Studien GEMINI 1 & 2 nach 144
Wochen gleichermaßen gut wirksam.
Die initiale Differenz bei
Patienten mit fortgeschrittenem Immundefekt wurde geringer und ein
virologisches Versagen wurde unter der dualen Therapie bei 12
Teilnehmer und der Tripletherapie bei neun Patienten beobachtet
(Orkin C et al., 414) In der Studie TANGO war Dolutegravir/3TC in
allen Subgruppen gleichermaßen wirksam und verträglich (Benson P et
al., 417).
2DR und M184V
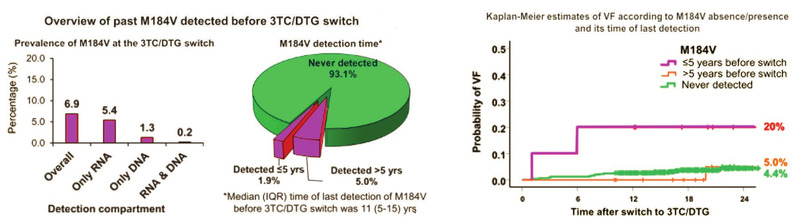
Eine archivierte M184V-Mutation scheint Dolutegravir/3TC insbesondere dann zu beeinträchtigen, wenn diese in den letzten fünf Jahren vor dem Start des 2DR dokumentiert wurde. Von 535 Patienten (39% mindestens ein virologisches Versagen, 58% früher 3TC/FTC) in einer retrospektiven Analyse hatten 6,9% eine M184V. Im Verlauf von 24 Monaten kam es bei 20% der Patienten mit einer „jüngeren“ M184V zum Therapieversagen im Vergleich zu jeweils 5% bzw. 4,4% der Patienten mit einer über fünf Jahre „alten“ M184V bzw. ohne diese Mutation (Santoro MM et al., 429) (Abb. 5a und b).
COVID-19
HIV und COVID-19, beide Infektionen wurden in gemeinsamen Sessions von Experten in mittlerweile beiden Bereichen abgehandelt.
Besonders spannend waren die Studien zur Therapie und Prävention von COVID-19. Die Behandlung von schwer Kranken mit Rekonvaleszenten-Serum hat keinerlei Wirkung gezeigt (Jordans C et al., 124), während die frühzeitige Gabe von neutralisierenden Antikörpern beeindruckend effektiv ist. Einige Produkte stehen hier sogar schon kurz vor der Zulassung. So verhinderte die einmalige Infusion von Bamlanivimab + Etesevimab in der Studie BLAZE-1 (n=1.035) den schweren Verlauf einer COVID-19 Erkrankung bei Menschen mit hohem Risiko (Dougan M et al., 122). Als Postexpositionsprophylaxe innerhalb von sieben Stunden infundiert verhinderte Bamlanivimab allein in BLAZE-2 (n=1.000) das Risiko einer Infektion um 76%, das Risiko einer schweren Erkrankung um 80%. Die Verträglichkeit der Antikörper war gut, die Nebenwirkungsrate auf Placeboniveau.
Casirimab plus Imdevimab
Die Antikörper-Kombination („REGEN-COV“) wurde in einer Placebo-kontrollierten Phase-3-Studie innerhalb von 96 Stunden asymptomatischen Kontaktpersonen im Haushalt subkutan gespritzt. In der Interim-Analyse nach 24 Wochen hatten signifikant weniger Personen eine symptomatische (3,6% vs 0%) sowie asymptomatische Infektion (10,3% vs 5,4%) (Abb.). Die Verträglichkeit war gut, am häufigsten waren lokale Injektionsreaktionen (O´Brien M et al., 123LB). Die Antikörper sind in Deutschland im Rahmen einer „Emergency Use Authorisation“ verfügbar.
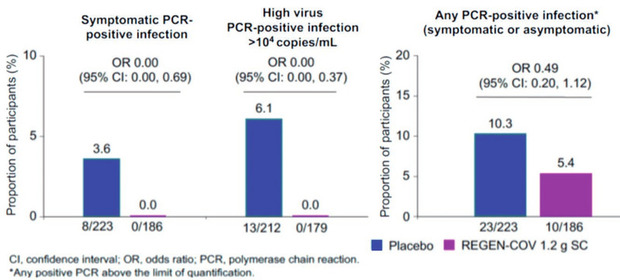
Abb REGEN-COV (Casirimab + Imdevimab) als Postexpositionsprophylaxe verhindert symptomatische Infektionen zu 100%











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
