Christian Hoffmann, Hamburg
Wir brauchen die ambulanten COVID-19-Therapien jetzt!
In der aktuell dramatischen Lage werden auch deutlich höhere Impfquoten nicht ausreichen. Die Impfung schützt nicht gut vor Infektionen, und der Schutz vor schweren Verläufen nimmt gerade bei Älteren von Monat zu Monat ab. Auffrischungen erfolgen viel zu langsam. Vergessen wird auch meist, dass ein Teil der Bevölkerung weithin ungeschützt bleibt. Dies sind beileibe nicht nur Impfverweigerer, sondern auch Menschen nach Stammzell- und Organtransplantationen, mit Tumorerkrankungen, MS oder Autoimmunerkrankungen. Vor allem nach B-Zell-depletierenden Therapien wie zum Beispiel Rituximab scheint die Impfantwort oft insuffizient zu bleiben, und zwar auch nach Boosterung.

Booster-Impfung ist gut, aber nicht ausreichend
Immer noch zu wenig beachtet werden in dieser Situation die Möglichkeiten einer ambulanten Prophylaxe und Therapie von COVID-19. Auch aus praktischen Gründen ist dabei wichtig, die drei Konstellationen Präexpositionsprophylaxe (PrEP), Postexpositionsprophylaxe (PEP) und die Frühtherapie sehr genau voneinander zu unterscheiden und differenziert zu betrachten. Die PrEP kommt vor allem für PatientInnen ohne adäquate Impfantwort in Frage, also bei jenen Menschen, die jetzt durch diese Welle hindurch geschützt werden müssen. Sie lässt sich gut planen. Vor allem eine langanhaltende Wirksamkeit wäre wünschenswert. Diese ließe sich durch eine intramuskuläre Depotgabe erreichen, welche mehrere Monate lang im Sinne einer passiven Immunisierung schützt. Anders als bei der PrEP ist die langanhaltende Wirkung dagegen bei der PEP nicht das Wichtigste. Hier genügt es, dass die ersten Tage nach einer Exposition überbrückt werden und so eine Infektion überhaupt verhindert wird. Die PEP muss vor allem schnell beginnen. Auch bei der Frühtherapie, also innerhalb weniger Tage nach Beginn der Symptome, kommt es vor allem darauf an, dass sie einfach, schnell und breit einsetzbar ist – die orale oder subkutane Gabe ist hier von entscheidendem Vorteil.
Mittlerweile haben mehrere Medikamente, übrigens anders als das im letzten Jahr voreilig gehypte Remdesivir, in großen Phase III-Studien gezeigt, dass sie in den drei Settings durchaus imstande sind, schwere COVID-19-Fälle zu verhindern bzw. zu reduzieren. Jeweils in der richtigen Situation eingesetzt, werden diese Medikamente somit vermutlich Leben retten und dabei helfen können, die drohende Überlastung des Gesundheitssystems zu verhindern. Sie müssten allerdings genutzt werden, und zwar so breit und so schnell wie möglich.
Präexpositionsprophylaxe (PrEP)
Mit einer PrEP, am besten durch lang wirksame Antikörper, ließen sich Menschen schützen, bei denen eine Immunantwort auf Vakzine ausbleibt. Im August veröffentlichte Astra Zeneca erste Daten zu der PROVENT-Studie.1 In dieser erhielten 5.197 Teilnehmer mit „einem erhöhten Risiko einer in-adäquaten Impfantwort“ in einer 2:1 Randomisierung entweder Plazebo oder die Kombination aus den beiden lang wirksamen AZ-Antikörpern Tixagevimab und Cilgavimab. Obwohl die Einschlusskriterien möglicherweise etwas zu weit gefasst waren und insgesamt nur wenige symptomatische Erkrankungen beobachtet wurden, war eine Schutzwirkung evident. So traten unter Plazebo symptomatische Infektionen (auch leichte!) deutlich häufiger auf, nämlich 17/1.737 (1,0%) versus 8/3.460 (0,2%) im Verum-Arm. Dieser Effekt entsprach einer relativen Risikoreduktion von 77% (95% Konfidenzintervall 46-90%). Die Schutzwirkung der beiden Antikörper von Astra Zeneca hält wahrscheinlich über mehrere Monate an. Auch für die beiden Regeneron-Antikörper Casirivimab and Imdevimab (Ronapreve®) gibt es erste positive Resultate aus einer Phase I-Studie an fast 1.000 Patienten. Nachteil ist allerdings, dass hier anders als bei den Präparaten von Astra Zeneca wohl eine wiederholte Gabe alle 4 Wochen notwendig ist, die Halbwertzeit ist kürzer.2
Beispiel: Der ambulante Risikopatient
Ein 84jähriger von einem ambulanten Pflegedienst betreuter Patient mit CLL ist seit drei Tagen symptomatisch, nun bestätigt PCR-positiv. Noch ist er zuhause. Es geht nun um Stunden: wenn eine präventive Therapie nützen soll, dann jetzt. Dabei ist zu vermeiden, dass der betagte Patient, gebrechlich und wahrscheinlich hochinfektiös, die häusliche Quarantäne verlässt. Die Anmeldung in einem Krankenhaus, die Kontaktaufnahme und Vermittlung, die Organisation eines Transports und etwaiger Begleitpersonen, die Verabreichung eines Medikaments in dem Zentrum, der Transport zurück nachhause – das alles ist langwierig, aufwändig und riskant. Die Infusion durch den niedergelassenen Arzt, idealerweise zuhause mit wenigen Kontakten, wäre einfacher und zeitnaher zu organisieren. Mit Molnupiravir oder Paxlovid wäre in Kürze sogar eine Tabletten-Therapie über 5 Tage möglich.
Postexpositionsprophylaxe (PEP)
Auch als PEP kommen die Antikörper in Frage. Die Kombination aus Casirivimab und Imdevimab (Ronapreve®) wurde als einmalige subkutane Injektion bei über 1.500 TeilnehmerInnen über 12 Jahre untersucht. Die Gabe erfolgte innerhalb von 96 Stunden, nachdem bei einem Haushaltskontakt eine SARS-CoV-2-Infektion diagnostiziert worden war.3 Eine symptomatische SARS-CoV-2-Infektion entwickelte sich bei 11 von 753 Teilnehmern im Verum-Arm (1,5%), dagegen bei 59 von 752 unter Plazebo (7,8%), einer relativen Risikoreduktion von 81% entsprechend. Schwere Infektionen wurden insgesamt selten beobachtet, hospitalisiert werden mussten lediglich 4 Patienten. Alle vier befanden sich im Plazeboarm. In einer weiteren Studie zeigte die Antikörper-Kombination von Astra Zeneca (Tixagevimab und Cilgavimab) nur eine geringe Wirksamkeit; allerdings war hier die mögliche Zeit zwischen Exposition und Therapie auf bis zu 8 Tage definiert und damit vermutlich deutlich zu lang. Nicht wenige Patienten waren wohl bei Studieneinschluss bereits mit SARS-CoV-2 infiziert. Eine Posthoc-Analyse, die sich auf solche TeilnehmerInnen beschränkte, die zum Zeitpunkt des PEP-Beginns noch PCR-negativ waren, ergab eine ebenfalls recht hohe Risikoreduktion.4 Entscheidend bei der PEP ist wie bei der HIV-PEP in jedem Fall also der rasche Beginn.
Frühe ambulante Therapie
Auch für die frühe ambulante Therapie, nach bereits bestätigter SARS-CoV-2-Infektion, gibt es mittlerweile viele Daten. Ronapreve® wurde am 12. November von der EMA eine vorläufige Zulassung erteilt, und zwar interessanterweise sowohl als Frühtherapie, aber auch als PrEP oder PEP. In der Praxis dürfte es freilich schwierig sein, diese Antikörper-Therapie im ambulanten Bereich breit einzusetzen. Dies umso mehr, als dies laut EMA nur vorgesehen ist für „Gesundheitseinrichtungen, in denen die Patienten angemessen überwacht werden können“. Die umständliche Applikation hat vermutlich auch dazu beigetragen, dass die von der Bundesregierung Anfang des Jahres bestellten, großen Mengen der Antikörper von Regeneron und Lilly bislang kaum verwendet wurden (es ist von 200.000 Dosen für 400 Millionen Euro die Rede, bis Ende Juli des Jahres waren davon lediglich 3.600 Dosen verbraucht). Die wertvollen Medikamente waren nur an wenigen universitären Zentren verfügbar und somit einfach zum falschen Zeitpunkt am falschen Ort. Ein fatales Missverständnis – die in den Unis behandelten Patienten sind meist schon viel zu lange krank, die Antikörper kommen dann meist zu spät. Das Fenster, innerhalb dessen schwere Verläufe verhindert werden können, ist klein und bleibt nur Stunden bis wenige Tage nach der Infektion offen (siehe dazu auch das Beispiel im Kasten). Noch am 12. Oktober ließ die Bundesregierung verlauten, die Antikörpergabe finde „ausschließlich an Kliniken statt“. Auch wenn man sich fragt, wieso dies eigentlich so sein muss und wer für eine solche Fehleinschätzung verantwortlich ist – viele andere, sehr komplexe und potentiell deutlich gefährlichere Therapien, darunter auch monoklonale Antikörper, werden schließlich auch überwiegend ambulant gegeben – es steht zu befürchten, dass Antikörper als Frühtherapie bei COVID-19 weiterhin kaum eine relevante Rolle spielen werden. Attraktiver dürften im ambulanten Setting vor allem die Präparate sein, die oral als Tabletten gegeben werden können. Mit mindestens zwei dieser Präparate ist schon in Kürze zu rechnen: dem Polymeraseinhibitor Molnupiravir und dem Proteasehemmer Paxlovid. Beide, so sieht es jedenfalls derzeit (Stand 28. November) aus, wirken auch bei den diversen SARS-CoV-2-Varianten.
Molnupiravir (Lagevrio)
Anfang Oktober veröffentlichte MSD erste Interims-Daten der großen Phase III-Studie MOVe OUT5, die Ende November auch auf dem virtuellen Amerikanischen Tropenmedizin-Kongress vorgestellt wurden.6 Die ersten Ergebnisse für dieses Ribonukleosid-Analogon sahen sehr vielversprechend aus. Innerhalb von 5 Tagen nach Beginn der Symptome und für nur jeweils 5 Tage gegeben, war Molnupiravir imstande, schwere Verläufe bei ungeimpften Risikopatienten (über 60 Jahre und/oder diverse Begleiterkrankungen) deutlich zu reduzieren, und zwar nach der Interimsanalyse um rund 50%. Die Verträglichkeit von Molnupiravir war sehr gut, lediglich Übelkeit trat etwas häufiger auf als unter Plazebo. Nur drei Tage nach dem Late Breaker-Beitrag auf dem Tropen-Kongress musste MSD wieder ein wenig zurückrudern: die Wirkung ist wahrscheinlich nicht so gut wie nach der Interimsanalyse angenommen. In einer erneuten Pressemitteilung am 26. November hieß es etwas kleinlaut, dass nun die vollständigen Daten vorlägen.7 Die Wirkung ist wohl leider doch etwas schwächer: unter den 1.433 TeilnehmerInnen verringerte Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls von 9,7% im Plazeboarm (68/699) nunmehr auf 6,8% (48/709). Dieser Effekt entsprach nur noch einer relativen Risikoreduktion von 30% und einer absoluten Risikoreduktion von 3,0% (95% Konfidenzintervall 0,1-5,9%). Insgesamt neun Todesfälle wurden im Plazeboarm beobachtet, verglichen mit einem in dem Verum-Arm. Trotz der am Ende wohl doch nur moderaten Wirkung bleibt Molnupiravir vor allem auch angesichts seiner guten Verträglichkeit eine interessante Option im ambulanten Bereich. Mit einer Entscheidung der EMA wird für Ende November gerechnet. Großbritannien hat Molnupiravir (unter dem Handelsnamen Lagevrio) bereits am 4. November zugelassen.
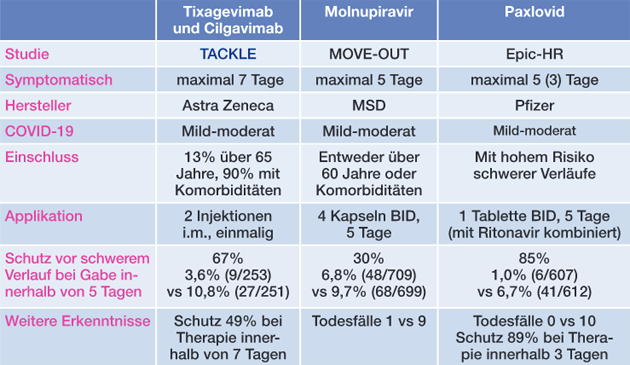
Tab 1 Multizentrische Phase-III-Studien zu Behandlung von ambulantem COVID-19 (Auswahl)
Paxlovid (PF-07321332)
Für
den Proteasehemmer Paxlovid von Pfizer sind die Daten noch um einiges
vielversprechender, aber auch spärlicher. Laut Hersteller hemmt
Paxlovid die „virale Replikation in einem Stadium, das als
Proteolyse bekannt ist und das vor der viralen RNA-Replikation
stattfindet“. Die Substanz wird mit
Ritonavir geboostert
(Achtung Interaktionen!) und wie Molnupiravir für 5 Tage oral
gegeben.
Es
existiert lediglich eine Pressemitteilung der Firma vom 5. November,
basierend auf einer Zwischenauswertung der randomisierten,
doppelblinden Phase-2/3-Studie (EPIC-HR: Evaluation of Protease
Inhibition for COVID-19 in High-Risk Patients). Diese hatte 1.219
nicht hospitalisierte (ungeimpfte) Erwachsene mit COVID-19
aufgenommen, bei denen ein hohes Risiko für eine schwere Erkrankung
bestand. Die geplante Zwischenanalyse zeigte eine 89%ige Verringerung
des Risikos,
sofern innerhalb von 3 Tagen nach Auftreten der
Symptome mit der Behandlung begonnen wurde (primärer Endpunkt). Nur
0,8% der PatientInnen wurden bis zum Tag 28 ins Krankenhaus
eingewiesen, verglichen mit immerhin 7,0% unter Plazebo (siehe
Tabelle). Am 19. November hat die EMA mit dem Review-Verfahren
begonnen. Es bleibt die Hoffnung, dass die klinischen Effekte von
Paxlovid – anders als bei Molnupiravir – auch der Endauswertung
standhalten werden und sich die schon recht vollmundige Ankündigung
eines „Game-Changers“ (Pfizers CEO Albert Bourla) tatsächlich
bewahrheitet. Diverse weitere große Studien laufen, darunter auch
als PEP und, wichtiger noch, zum Einsatz bei Geimpften.
Jetzt handeln!
Angesichts der aktuellen Zahlen steht zu befürchten, dass sich trotz hoher Impfraten eine große Zahl der Hochrisikopatienten in diesem Winter infizieren und viele sterben werden. Um dieses dramatische Szenario zumindest abzumildern, wird ein schnelles Handeln aller Beteiligten erforderlich sein.
- Die Herstellerfirmen müssen die Daten auf den Tisch legen. Interimsanalysen per Presseerklärung zu verbreiten, ist der falsche Weg. Es erscheint inakzeptabel, viele Wochen verstreichen zu lassen, ohne die vorhandenen Daten nur häppchenweise zu veröffentlichen. Auch sind weitere Studien zu Geimpften erforderlich – alle Studien wurden bislang bei Ungeimpften durchgeführt.
- Fachgesellschaften (nicht nur DIG und DTG) sind gefordert, umgehend gemeinsame Stellungnahmen zu verfassen, und zwar nicht nur zu den Antikörpern, sondern auch zu den oralen Therapien – bei welchen Menschen sind zu welchem Zeitpunkt welche Therapien zu empfehlen? Bei wem sind vorher – und zwar jetzt – Antikörper zu bestimmen?
- Auch die STAKOB sollte so schnell wie möglich klare Empfehlungen geben (letzte Überarbeitung zu COVID-19 Mitte Juli 2021) – aus den bislang publizierten, teils sehr großen Kohorten-Studien zu Komorbiditäten ließen sich die potentiellen, begrenzten Populationen für PrEP, PEP und Frühtherapie schon jetzt recht präzise definieren.
- Kassenärztliche Vereinigungen müssen sich frühzeitig um die Verteilung kümmern, und zwar in der Fläche. Es nützt nichts, Therapien nur in ausgewählten Exzellenzzentren vorzuhalten. Ein angemessenes Vergütungssystem ist erforderlich.
- Netzwerke sollten genutzt und mit einbezogen werden, gerade auch im Niedergelassenen-Bereich. Auch die dagnae e.V. könnte sich noch in diesem Jahr positionieren – wer Nukleosidanaloga und Proteasehemmer gegen HIV verordnen kann (und schon weiß, dass Paxlovid nicht mit zum Beispiel Simvastatin gehen wird), kann dies auch gegen SARS-CoV-2 tun.
- Die Politik muss sich rechtzeitig um Beschaffung (vor allem auch der oralen Therapien!) und um die Rahmenbedingungen kümmern, ggf. auch um eine Gesetzesänderung bezüglich einer PrEP. Die HIV-PrEP war nur wenige Wochen nach der Amtsübernahme Jens Spahns etabliert. Gerade beim PrEP-Einsatz muss die Regressfrage geklärt werden.
Vorbehalte und Bedenken bezüglich einer unkoordinierten Übertherapie („Wildwuchs“) sind berechtigt, sollten angesichts der derzeitigen Bedrohung aber in den Hintergrund treten. Die Indikationen werden begrenzt bleiben. Die weitaus meisten ambulant tätigen ÄrztInnen werden mit diesen Therapien verantwortungsbewusst und im Rahmen möglicher Leitlinien bzw. Empfehlungen umgehen. Antikörper und Tabletten ausgewählten PatientInnen zu geben, ist kein Hexenwerk. Und wenn es denn vereinzelt zu unnötigen Behandlungen kommt – dies scheint leichter zu verschmerzen, als dass sie ungenutzt bleiben oder sogar im Sondermüll landen.
1 Presseerklärung Astra Zeneca, 20. August 2021. AZD7442 PROVENT Phase III prophylaxis trial met primary endpoint in preventing COVID-19. https://www.astrazeneca.com/media-centre/press-releases/2021/azd7442-prophylaxis-trial-met-primary-endpoint.html
2 Isa F, Forleo-Neto E, Meyer J, Zheng W, Rasmus-sen S, Armas D, et al. Repeat Subcutaneous Administration of REGEN-COV in Adults is Well-Tolerated and Prevents the Occurrence of COVID-19. medRxiv. https://www.medrxiv.org/content/10.1101/2021.11.10.21265889v1
3 O‘Brien MP, Forleo-Neto E, Musser BJ, et al; Covid-19 Phase 3 Prevention Trial Team. Subcutaneous REGEN-COV Antibody Combination to Prevent Covid-19. N Engl J Med. 2021 Sep 23;385(13):1184-1195. doi: 10.1056/NEJMoa2109682. Epub 2021 Aug 4.
4 Presseerklärung Astra Zeneca, 15. Juni 2021. Update on AZD7442 STORM CHASER trial in post-exposure prevention of symptomatic COVID-19. https://www.astrazeneca.com/media-centre/press-releases/2021/update-on-azd7442-storm-chaser-trial.html
5 Presseerklärung Merck, 1. Oktober 2021. Merck and Ridgeback’s Investigational Oral Antiviral Molnupiravir Reduced the Risk of Hospitalization or Death by Approximately 50 Percent Compared to Placebo for Patients with Mild or Moderate COVID-19 in Positive Interim Analysis of Phase 3 Study. https://www.merck.com/news/merck-and-ridgebacks-investigational-oral-antiviral-molnupiravir-reduced-the-risk-of-hospitalization-or-death-by-approximately-50-percent-compared-to-placebo-for-patients-with-mild-or-moderat/
6 Johnson MG, Bernal AJ, Moncada Vallejo PA. Molnupiravir for the treatment of COVID-19 in non-hospitalized patients: interim analysis of a randomized, controlled trial. Poster LB 2968. Presented at American Society of Tropical Medicine and Hygiene, November 17-20, 2021.
7 Presseerklärung
Merck, 26. November 2021.
Merck and Ridgeback Biotherapeutics
Provide Update on Results from MOVe-OUT Study of Molnupiravir, an
Investigational Oral Antiviral Medicine, in At Risk Adults With
Mild-to-Moderate COVID-19.
https://www.merck.com/news/merck-and-ridgeback-biotherapeutics-provide-update-on-results-from-move-out-study-of-molnupiravir-an-investigational-oral-antiviral-medicine-in-at-risk-adults-with-mild-to-moderate-covid-19/
8 Presseerklärung Pfizer, 5. November 2021. Pfizer’s Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk of Hospitalization or Death by 89% in Interim Analysis of Phase 2/3 EPIC-HR Study. https://www.pfizer.com/news/press-release/press-release-detail/pfizers-novel-covid-19-oral-antiviral-treatment-candidate










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
