Thomas Duell, Gauting
Lungenkrebs – Diagnostik und Therapie einer vermeidbaren Tumorerkrankung
Lungenkrebs ist bei uns in der Inzidenz nach dem Kolorektal- und Mammakarzinom die an dritter Stelle stehende bedeutsame Tumorerkrankung, in der Mortalitätsstatistik steht diese jedoch ganz oben. Bei ca. 47.000 Neuerkrankungen sterben pro Jahr in Deutschland um die 42.000 Menschen an ihrem Lungenkrebs. Angesichts des kurzen Krankheitsverlaufes ist die Erkrankung rechnerisch über alle Formen und Stadien hinweg zu etwa 90% letal. Das mittlere Alter der Patienten zum Zeitpunkt der Diagnose liegt bei etwa 65 Jahren, der Anteil an Männern um 70%.
Je nach Erkrankungstyp sind oder waren zwischen 80 bis 95% der Betroffenen Raucher. Das Lungenkarzinom ist somit die am nachhaltigsten/einfachsten zu vermeidende Tumorerkrankung. Leider werden viele Patienten erst im fortgeschrittenen Stadium des Lungenkarzinoms diagnostiziert, da es meist keine Frühsymptome gibt. Eine kürzlich publizierte Studie zum Lungenkrebs-Screening mittels Niedrig-Dosis-CT an Hochrisikopopulationen hat zwar eine Reduktion in der Lungenkrebssterblichkeit gezeigt, dies jedoch mit der Konsequenz einer unangemessenen Flut an belastenden und kostenaufwändigen Folgeuntersuchungen aufgrund der Vielzahl an falsch-positiven Befunden. Somit bleibt die Zigarettenkarenz die Maßnahme schlechthin zur Vermeidung dieser für den Einzelnen katastrophalen Erkrankung. Weitergehende Informationen zu Diagnostik und Therapie des Lungenkarzinoms sind auch über die online-Version des Manuals „Tumoren der Lunge und des Mediastinums“ des Tumorzentrum München abrufbar und den Deutschen S3-Leitlinien zum Lungenkrebs zu entnehmen.
Symptome
Frühe, primär operativ angehbare Stadien werden meistens zufällig durch Routineuntersuchungen, z.B. bei einem präoperativen Check-up entdeckt. An spezifischen Symptomen bestanden bei einem eigenen Kollektiv von 250 Patienten mit neu diagnostiziertem fortgeschrittenem nicht-kleinzelligem Lungenkrebs (NSCLC) bei 50% Luftnot und/oder Atemnot, bei 32% Schmerzen. An unspezifischen Beschwerden klagten 35% über ungewollten Gewichtsverlust, 23% über einen Leistungsknick; neurologische Symptome, z.B. infolge von Hirnmetastasen, bestanden bei 10%, Temperaturen, Nachtschweiß oder Heiserkeit bei je 5%. Ein über mehr als zwei Wochen bestehender Reizhusten, insbesondere bei Rauchern und ohne begleitende Infektzeichen, sollte unbedingt zu weiterer Diagnostik Anlass geben!
Diagnostische Maßnahmen
Als einfachste radiologische Untersuchung wird die Thoraxübersicht eingesetzt, als weiterführende Maßnahme eine kontrastverstärkte CT-Thorax-Untersuchung. Zur Histologiegewinnung dient in erster Linie die Bronchoskopie, ggf. erweitert durch endobronchiale Sonographie (EBUS) und EBUS-gestützte transbronchiale Nadelaspiration (TBNA), die auch die erste Wahl für das mediastinale Staging darstellt. Sollten periphere Tumore nicht über eine Bronchoskopie zu erreichen sein, so kann eine CT-gesteuerte Punktion oder auch eine thorakoskopische Materialgewinnung erforderlich sein. Bei malignitätsverdächtigen kleineren isolierten Rundherden wird ggf. auch gleich operiert.
Nur etwa 20-30% der Patienten mit NSCLC kommen aufgrund eines frühen Erkrankungsstadiums für eine primäre OP in Frage. Das Risiko einer bereits stattgehabten (Mikro-) Metastasierung steigt mit der Tumorgröße und dem Ausmaß der hilären bzw. mediastinalen Lymphknotenbeteiligung. So ist bei den meisten Patienten primär neben dem thorakalen auch ein extrathorakales Staging zur Metastasensuche angezeigt. Neben dem Schädel-MRT (oder -CT) sollte ein Oberbauch-CT unter Einbeziehung von Leber und Nebennieren durchgeführt werden, überdies eine Szintigraphie zum Ausschluss von Knochenmetastasen. Gerade in lokal fortgeschrittenen Fällen ist auch eine PET (Positronenemissionstomographie) indiziert, mit der Fernmetastasen mit hoher Sicherheit erfasst werden können.
Da die Prognose der Patienten mit lokal fortgeschrittenem NSCLC maßgeblich vom mediastinalen Lymphknotenstatus abhängt, ist hier bei Verdacht auf Lymphknotenbeteiligung ein gezieltes mediastinales Staging notwendig. Neben der üblichen bildgebenden CT-Diagnostik kommen hierbei die o.g. EBUS-TBNA, in Zweifelsfällen auch die Mediastinoskopie zum Einsatz. Vor einer Operation (oder auch kurativ intendierter Bestrahlung) muss der kardiale bzw. kardiopulmonale Status erhoben werden, um die funktionelle Operabilität festzustellen.
Differentialdiagnostik
Histologisch wird das häufigere nicht-kleinzellige (NSCLC; 80-85%) vom kleinzelligen Lungenkarzinom (SCLC; 15-20%) unterschieden. Letzteres wird zu den sog. neuroendokrinen Karzinomen der Lunge gerechnet, andere Tumoren dieser Art wie z.B. das (atypische) Karzinoid sind sehr selten. Nicht immer unproblematisch ist die Abgrenzung des NSCLC von extrathorakalen Tumoren mit pulmonaler bzw. pleuraler Beteiligung, insbesondere wenn kein eindeutiger Primärtumor unter mehreren Lungenrundherden erkennbar ist und immunhistochemische Marker fehlen.
Bei der differentialdiagnostischen histopathologischen Einordnung helfen u.a. immunhistochemische (IHC) Verfahren. So können bei weniger differenzierten primären Lungentumoren und unklaren Befunden IHC-Marker wie TTF-1 und Napsin A (Adenokarzinom), p63 (Plattenepithelkarzinom) sowie neuroendokrine Marker (z.B. CD65, Synaptophysin) bei der Zuordnung des Lungenkarzinoms wegweisend sein und bei der Abgrenzung zu metastasierenden extrathorakalen Malignomen helfen.
Stadieneinteilung
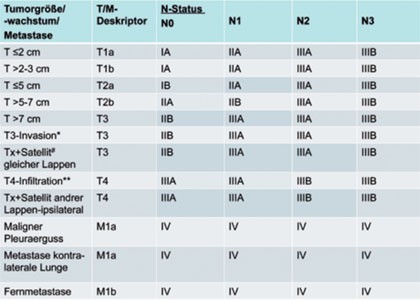
Tab. 1 TNM-Klassifikation des Lungenkarzinoms nach UICC, 7. Edition
Nach histologischer Sicherung wird unter Berücksichtigung der Befunde der Staginguntersuchungen das Erkrankungsstadium gemäß Tabelle 1 definiert. Die wichtigsten Kriterien zur Auswahl der Therapie sind neben dem Stadium (N-Status) und der Histologie natürlich auch der Allgemeinzustand, der funktionelle Status (Lungenfunktion!) sowie Begleiterkrankungen. Aufgrund der Tatsache, dass die überwiegende Mehrzahl der Patienten Raucher sind oder waren, leiden viele zusätzlich an kardiovaskulären Problemen und/oder chronisch-obstruktiver Lungenerkrankung, was die oftmals ohnehin begrenzten therapeutischen Möglichkeiten weiter einschränkt.
Nicht-kleinzelliges Lungenkarzinom (NSCLC)
Unter das NSCLC fallen in Abgrenzung zum SCLC das Adenokarzinom, das Plattenepithelkarzinom, das großzellige Karzinom und nicht klassifizierbare NSCLC-Formen. In den vergangenen 10 Jahren hat ein Typenwechsel stattgefunden, wobei das Adenokarzinom stetig in seiner Inzidenz zugenommen hat. Als Ursache hierfür nimmt man eine Veränderung im Rauchverhalten an. Durch zunehmenden Missbrauch von Filter- oder sogenannter „Light“-Zigaretten werden mehr Zigaretten konsumiert und auch tiefer inhaliert, was eine vermehrte Deposition von karzinogenen Substanzen in der Lungenperipherie zur Folge hat. Waren bei den filterlosen Zigaretten früher zentrale Plattenepithelkarzinome (und kleinzellige Karzinome) häufiger, so findet man heutzutage zunehmend periphere Adenokarzinome, gerade auch bei Frauen, die von Jugend an geraucht haben. Bei Nichtrauchern findet man fast ausschließlich Adenokarzinome, die sich in ihrer Biologie vom Rauch-assoziierten Adenokarzinom unterscheiden und üblicherweise mit einer besseren Prognose verbunden sind, insbesondere wenn sie mit einer aktivierenden Mutation im EGFR-Gen einhergehen.
Prognose des nicht-kleinzelligen Lungenkarzinoms
Die Prognose beim NSCLC ist in erster Linie abhängig vom Erkrankungsstadium und den letztlich einsetzbaren therapeutischen Möglichkeiten. Während nach Resektion im Stadium I und II 5-Jahres-Überlebenszeiten von 60-80 bzw. 33-60% angegeben werden, ist dies im Stadium IIIA stark vom individuellen Status (Tumorgröße, -ausdehnung, Ausmaß des mediastinalen Lymphknotenbefalls) abhängig. Liegt das 5-Jahres-Überleben bei resektablen Tumoren nach multimodaler Therapie bei 25-40%, beträgt es in weiter fortgeschrittenen Stadien nur noch etwa 15%. Auch im Stadium IIIB gibt es unter multimodaler Behandlung eine Spanne im 5-Jahres-Überleben zwischen 3-25%, je nach T- und N-Status sowie Studie bzw. Datenquelle.
Im Stadium IV ist der klinische Zustand zum Zeitpunkt der Diagnose bzw. Therapieeinleitung ein maßgeblicher prognostischer Faktor. Das mediane Überleben beträgt je nach Ausgangspopulation zwischen 8-12 Monaten, in neueren Studien (in hoch selektionierten Patienten) sogar bis 14 Monate. Das 1-Jahres-Überleben liegt bei 30-40%, das 5-Jahres-Überleben bei <2%. Die Verfügbarkeit neuer Substanzen und deren großzügigerer Einsatz in 2. und 3. Therapielinie dürfte zu einem längeren Überleben der Patienten über die Zeit beigetragen haben.
Stadienadaptierte Therapie
|
|
|
|
|
|
Tab. 2 Stadienadaptierte Therapie des nicht-kleinzelligen Lungenkarzinoms
Bei Patienten in gutem Allgemeinzustand sollte in den potentiell kurablen Stadien I-III so aggressiv wie möglich behandelt werden, um alle Chancen auf Heilung zu wahren. Leider leiden viele Patienten unter einschränkenden Begleiterkrankungen, so dass Therapiestrategien individuell angepasst werden müssen und zum Teil selbst bei frühen Stadien nur palliativ orientierte Konzepte zum Einsatz kommen können. Bei Patienten mit fortgeschrittener Erkrankung liegt der Schwerpunkt auf der Erhaltung bzw. Wiederherstellung der Lebensqualität, die Nebenwirkungen der Therapie dürfen dabei deren Nutzen nicht überwiegen. Tabelle 2 zeigt eine Übersicht der stadienadaptierten Therapien beim NSCLC.
Therapie des frühen und lokal fortgeschrittenen NSCLC
Ist das Vorgehen bei sonst organgesunden Patienten im Stadium I und II meist klar (OP+/- adjuvante Chemotherapie!), wird im Stadium III eine multimodale Therapie empfohlen, die Chirurgie, Chemotherapie und Strahlentherapie in unterschiedlicher Kombination und Sequenz umfassen kann. Die frühen Stadien I und II werden wenn funktionell möglich anatomisch mittels Lobektomie mit begleitender mediastinaler Lymphadenektomie reseziert, moderne broncho- und angioplastische Operationsverfahren erlauben auch kompliziertere Eingriffe von lokal fortgeschrittenen Tumoren, oft unter Umgehung einer sonst erforderlichen Pneumonektomie. Bei eingeschränkter Lungenfunktion sind auch Resektionen geringeren Ausmaßes wie atypische oder Segmentresektionen möglich.
Da die meisten Patienten der primär operierten NSCLC-Patienten im Falle eines Erkrankungsrückfalles in Form von Metastasen rezidivieren (70-80%) und dann letztlich auch daran sterben, sollte eine wirksame systemische Therapie Bestandteil einer jeden multimodalen Therapie sein. Der genaue Therapieplan, vor allem ob und wann eine Operation hier sinnvoll ist, sollte stets im Rahmen eines interdisziplinären Konsils unter Beteiligung eines Thoraxchirurgen, Pneumologen, Radiologen, Pathologen, Strahlentherapeuten und Onkologen festgestellt werden. Im Stadium II und auch III (insbesondere mit histopathologisch nachgewiesenem hilärem oder mediastinalem Lymphknotenbefall) profitieren Patienten in gutem Allgemeinzustand nach primärer Operation von einer adjuvanten Chemotherapie. Lokal fortgeschrittene Tumore, die einer primären Operation aufgrund der lokalen Tumorausbreitung oder eines fortgeschritteneren mediastinalen Lymphknotenbefalls nicht zugänglich sind, können im Einzelfall durch eine neoadjuvante Chemo(radio-)therapie in einen operablen Zustand gebracht werden (Abb. 1).
Therapie des fortgeschrittenen NSCLC
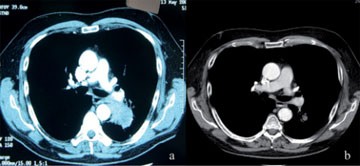
Abb. 1 a+b (a) großes Adenokarzinom des linken Lungenunterlappen (cT2aN2) bei Pat. mit funktioneller Inoperabilität für eine primär erforderliche Pneumonektomie; (b) Tumorrückbildung nach 4 Zyklen neoadjuvanter Chemotherapie; nachfolgende erfolgreiche Lobektomie; postoperatives Stadium ypT1a N1.
Im Stadium IV gilt der Nutzen der systemischen Therapie als gesichert, wobei fitte Patienten gemäß unserer deutschen S3-Leitlinien mit 4-6 Zyklen einer primären (Cis-)Platinbasierten Kombinationstherapie behandelt werden sollten. Als Kombinationspartner zum Platin werden Drittgenerationszytostatika wie Taxane, Gemcitabine, Vinorelbin oder beim Adenokarzinom auch Pemetrexed (Alimta®) verwendet.
Alternativ kann bei Patienten mit Adenokarzinom, deren Tumor eine sog. aktivierende Mutation im EGFR (epidermal growth factor-receptor)-Gen aufweist, ein oraler Tyrosinkinasehemmer (TKI; Gefitinib=Iressa®, Erlotinib=Tarceva®) first-line verabreicht werden. Leider sind derartige Mutationen nur bei 10-15% der betroffenen Patienten zu erwarten. Ansprechraten von bis zu 70% (unter Chemotherapie nur 30-40%) können hier erreicht werden, ein lebensverlängernder Effekt einer primären TKI-Therapie konnte bislang aber nicht nachgewiesen werden. Die Entwicklung hin zur sog. „personalisierten“, individuell auf den Tumor ausgerichteten Therapie schreitet voran. Neben Mutationen im EGFR-Gen bietet eine Mutation im ALK-Gen einen weiteren zielgerichteten Therapieansatz, derzeit aber nur i.R. von Studien. Bei etwa 50% der Adenokarzinome finden sich nach aktuellen Untersuchungen Genveränderungen, die vielleicht in Zukunft gezielt angegangen werden können. Für die überwiegende Mehrzahl der Patienten kommen solche Therapien derzeit leider noch nicht in Frage.
Auch ältere Patienten oder Patienten in schlechterem Zustand (Karnofsky-Index ≥70%) können von einer weniger aggressiven (Mono-)Therapie profitieren, das Alter allein spielt hier eine untergeordnete Rolle. Bei der Wahl der Medikamente muss auf individuelle Funktionseinschränkungen und Wechselwirkungen mit einer notwendigen Begleitmedikation geachtet werden, insbesondere natürlich auch im Hinblick auf eine begleitende HAART.
Viele Patienten, die sich weiterhin in einem guten klinischen Zustand befinden, werden auch von weiteren Therapien in zweiter, dritter und weitergehender Linie profitieren. Derartige Therapieentscheidungen sind individuell unter Berücksichtigung des klinischen Status, der Vortherapien und den Wünschen des Patienten zu treffen. So kommt neben klassischen Rezidivtherapeutika wie Docetaxel und Pemetrexed (Adenokarzinom) auch eine TKI-Therapie mit Erlotinib unabhängig vom EGFR-Mutationsstatus in Betracht. In Einzelfällen kann so Patienten mit primär metastasiertem Lungenkrebs über Jahre bei guter Lebensqualität über verschiedene Therapielinien hinweg ein gutes Leben ermöglicht werden.
Kleinzelliges Lungenkarzinom (SCLC)
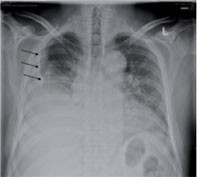
Abb. 2a ausgedehnte tumoröse Verschattung links mit Verbreiterung des Mediastinum und Pleuraerguss↑
Das kleinzellige Lungenkarzinom gehört als sein häufigster Vertreter zur Gruppe der neuroendokrinen Karzinome. Dies ist wohl auch die Ursache dafür, dass häufiger als bei anderen Krebserkrankungen (5-10%) paraneoplastische Phänomene zu beobachten sind, die in Form von ektopen Hormonbildungen (Cushing-, ACTH-, SIADH-Syndrom) oder auch vielfältigen neurologischen Störungen (PNP, motor. Störungen, Encephalitiden) auftreten können. Auch mag eine Affinität dieser Tumorzellen zum ZNS Grund für häufig primär oder im Verlauf auftretende Hirnmetastasen sein. Aufgrund des raschen Wachstums kommen um 70% der Patienten erst im Metastasenstadium zur Diagnostik, die Tumore können im Einzelfall ein monströses Ausmaß annehmen (Abb. 2). Wie beim NSCLC auch sind bevorzugte Manifestationsorte für Metastasen neben dem ZNS auch die Lunge selbst, die Leber, die Nebennieren und das Skelett. Mehr noch als beim NSCLC spielt das Rauchen bei der Entstehung des SCLC eine maßgebliche Rolle, mehr als 95% der Patienten haben über viele Jahre hinweg stark geraucht.
Prognose
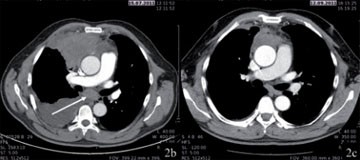
Abb. 2b+c (b) zugehöriges CT: ausgedehntes kleinzelliges Karzinom im vorderen oberen Mediastinum mit riesigen subcarinalen mediastinalen Lymphknotenmetastasen¬und malignem Pleuraerguss rechts (cT4N3M1a); (c) Tumorrückbildung nach 4 Zyklen Chemotherapie.
Prognostisch bedeutsam bei SCLC sind neben dem Stadium und dem klinischen Zustand zum Zeitpunkt der Therapieeinleitung auch Alter und Geschlecht, wobei ältere und männliche Patienten eine ungünstigere Prognose haben. Patienten nach primärer Resektion eines Rundherdes, der postoperativ als SCLC identifiziert wird, haben mit adjuvanter Chemotherapie eine gute Prognose mit 5-Jahres-Überlebensraten von 50-80%. Im limitierten, einer Strahlentherapie zugänglichen Stadium werden unter Chemotherapie und Bestrahlung mediane Überlebenszeiten zwischen 19-27 Monaten und 5-Jahres-Überlebensraten von 19-24% erreicht, wobei ein leichter Vorteil bei einem frühzeitigen simultanen Vorgehen besteht. Im primären Metastasenstadium (extendiertes Stadium) liegt das mediane Überleben bei 7-10 Monaten, das 1-Jahres-Überleben bei 30-40%.
Stadienadaptierte Therapie
Wird die Diagnose am OP-Präparat nach primärer Resektion gestellt, so besteht wegen des hohen sekundären Metastasierungsrisikos die Indikation für eine adjuvante Chemotherapie, bei histopathologisch nachgewiesener mediastinaler Lymphknotenbeteiligung auch für eine konsolidierende Mediastinalbestrahlung. Bei allen Patienten nach erfolgreicher Primärtherapie sollte unabhängig vom Primärstadium wegen des hohen Risikos für die Entwicklung von Hirnmetastasen eine prophylaktische Ganzhirnbestrahlung angeschlossen werden.
Bei lokal fortgeschrittenem SCLC ist bei fitten Patienten eine möglichst primär kombinierte Radiochemotherapie mit Cisplatin und Etoposid unter Einsatz eines hyperfraktionierten Bestrahlungsschemas angezeigt. Kommt so eine aggressive Behandlung aufgrund des Alters, des funktionellen Zustandes oder wegen der lokalen Tumorausdehnung nicht in Frage, sollte eine primäre systemische Behandlung gefolgt von einer Bestrahlung von Tumor und Mediastinum i.S. eines sequentiellen Vorgehens Einsatz finden.
Im fortgeschrittenen Stadium IV mit Pleurakarzinose oder Fernmetastasen ist die Chemotherapie, z.B. unter Einsatz von Carboplatin und Etoposid Mittel der ersten Wahl. SCLC`s sind hochsensibel gegenüber Chemotherapie (Ansprechraten 60-80%), entsprechend sollten auch Patienten in höherem Alter oder reduziertem klinischem Zustand (ggf. mit einer weniger aggressiven Carboplatin-Monotherapie) behandelt werden, sofern auch eine Besserung des Zustandes durch eine Tumorremission zu erwarten ist. Bei den allermeisten Patienten ist auch nach kurativ intendierter Erstbehandlung mit der Entwicklung eines Rezidivs zu rechnen. Je nach Situation muss individuell über eine weitere Therapie entschieden werden. Die meisten Patienten in gutem klinischem Zustand profitieren von einer weitergehenden Behandlung mit geändertem Regime, z.B. unter Einsatz von Topotecan, Anthrazyklinen oder Paclitaxel.
Sondersituationen
Bei 15-20% der Patienten besteht ein begleitender maligner Pleuraerguss, der durch Pleurodese über Drainage oder thorakoskopisch meist beherrscht werden kann. Bei oberer Einflussstauung sollte wenn nötig auch in palliativer Situation bestrahlt werden, beim SCLC kann hier durchaus der Effekt der Chemotherapie abgewartet werden. Auch bei schmerzhaften Knochenmetastasen oder symptomatischen Hirnmetastasen bietet die Strahlentherapie Aussicht auf rasche Beschwerdelinderung, wobei die Abfolge von systemischer und Strahlentherapie individuell nach Wertigkeit der Symptome festzulegen ist.
Fazit
Lungenkrebs ist eine häufige, meist zum Tode führende Krebserkrankung, deren Verlauf durch entsprechende angemessene Therapie durchaus positiv beeinflusst werden kann. Die Wahl der Behandlung richtet sich dabei nicht nur nach Histologie und Stadium, sondern besonders auch nach dem klinischen Zustand sowie den Begleiterkrankungen. Screeningmaßnahmen haben sich bisher nicht bewährt, beste Vorsorge ist es, das Rauchen zu lassen.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
