Ulrich Seybold, München
SARS-CoV-2-Impfung: Hot Topics Anfang 2022
Die aktuellen Impfstoffe
Die beispiellos schnelle Entwicklung und Zulassung verschiedener Impfstoffe gegen SARS-CoV-2 seit dem Jahr 2020 hat ab 2021 wesentlich zur Kontrolle der Pandemie beigetragen. Von inzwischen 342 Vakzinkandidaten1 waren bereits in der ersten Jahreshälfte 2020 >130 in verschiedenen Entwicklungsstadien.2
Stand USA
Zum Einsatz außerhalb von Studien kommen bisher in den USA lediglich 3 von der FDA (Food and Drug Administration) zugelassene Impfstoffe 3:
Das mRNA-Präparat BNT162b2 (Comirnaty®) hat seit Sommer 2021 eine uneingeschränkte Zulassung für Personen ab 16 Jahren und eine Notfall-Zulassung (emergency use authorisation, EUA) für Kinder ab 5 Jahren.
Der zweite mRNA-Impfstoff mRNA-1273 (Spikevax®) hat inzwischen für Menschen ab 18 Jahren ebenfalls die volle Zulassung, der adenovirale Vektorimpfstoff Ad26CoV2.S (Janssen COVID-19 Vaccine) ist ab 18 Jahren im Rahmen einer EUA einsetzbar.
Stand Europa
In Europa sind von der European Medicines Agency EMA inzwischen 5 SARS-CoV-2-Vakzine zugelassen4, von denen bisher vier im Alltag verwendet wurden. Im Unterschied zu den USA hat die EMA keine Notfallzulassungen erteilt, sondern „volle“ aber bedingte Zulassungen (conditional marketing authorisation, CMA). Damit sind die Hersteller einerseits uneingeschränkt haftbar und andererseits zur Bereitstellung weiterer Daten verpflichtet, um die Aufrechterhaltung der Zulassung zu sichern. BNT162b2 ist in Europa ebenso wie in den USA ab 5 Jahren zugelassen, Ad26CoV2.S ab 18 Jahren. mRNA-1273 ist in Europa bereits ab 12 Jahren zugelassen. Zusätzlich zu diesen drei hat die EMA auch den Chimpansen-Adenovirus-Vektorimpfstoff ChAdOx1-S (auch AZD1222) (initial als Covid-19 Vaccine AstraZeneca, seit Frühjahr 2021 als Vaxzefria® auf dem Markt) zugelassen, ebenfalls ab 18 Jahren. Im Dezember 2021 wurde als 5. Vakzin schließlich der adjuvantierte Proteinimpfstoff NVX-CoV2373 (Nuvaxovid®) zugelassen, der aber auch Mitte Februar 2022 noch nicht verfügbar ist.
STIKO empfiehlt
Die adenoviralen Vektorimpfstoffe sollen gemäß STIKO5 allenfalls noch für die erste Impfdosis eines dann heterologen Schemas bei Menschen >60 Jahren verwendet werden, für alle anderen Anwendungen nur noch die mRNA-Vakzine und NVX-CoV2373. Aufgrund des absolut zwar sehr niedrigen, durch mRNA-1273 aber im Vergleich zu BNT162b2 höheren Risikos einer Vakzin-assoziierten Perimyocarditis6,7 soll mRNA-1273 nur bei Menschen ab 30 Jahren eingesetzt werden. Kinder ab 12 Jahren und auch Schwangere sollen primär mit BNT162b2 geimpft werden.
In Zeiten von Omikron
Die sich spätestens seit November 20218 weltweit ausbreitende SARS-CoV-2-Omikron-Variante (B.1.1.529) weist alleine im Bereich des Spike-Proteins bis zu 37 Aminosäure-Veränderungen im Vergleich zum ursprünglichen Virus auf.9 Daher ist die Wirksamkeit der meisten derzeit verfügbaren monoklonalen Antikörper sowie auch die der gegen das Wildtyp-Spike-Protein entwickelten Impfstoffe eingeschränkt. Eine südafrikanische Analyse schätzt die Vakzineffektivität (VE) von BNT162b2 bezüglich Hospitalisierung während der vorausgegangenen von Delta geprägten Periode auf 93%, während der Omikron-Welle dagegen nur noch auf 70%.10
Daten aus den USA bestätigen diese Beobachtung: Lag die geschätzte VE bzgl. Notfall-Vorstellungen aufgrund laborbestätigter Covid-19-Erkrankung bis 180 Tage nach 2 Dosen BNT162b2 bei vorherrschender Delta-Variante bei 86% und nach >180 Tagen immer noch bei 76%, nahm die VE nach Ausbreitung von Omikron auf 52% bzw. sogar nur noch 38% ab.11 Entsprechend lagen Neutralisationstiter von 1,3 Monate vorher mit BNT162b2 oder mRNA-1273 geimpften Personen in den USA durchschnittlich um den Faktor 127, nach 5 Monaten um den Faktor 27 niedriger gegen Omikron als gegen den ursprünglichen Wuhan-hu-1-Stamm.12 Auch im Vergleich mit einem südafrikanischen Vorläufer-Virusstamm lagen die Neutralisationstiter gegen Omikron um den Faktor 22 niedriger, die maximale VE von 2 Dosen BNT162b2 gegen eine symptomatische Covid-19-Erkrankung durch Omikron schätzen die Autoren auf 73% bei zuvor bereits Genesenen und auf nur 35% bei SARS-CoV-2-Naiven.13
Boostern hilft
Gleichzeitig wurde die Hypothese aufgestellt, dass durch eine Booster-Impfung erreichbare signifikant höhere Antikörper-Titer einen besseren Schutz bieten. Eine englische Gruppe bestätigte in Modellierungen sowohl die geringere Wirksamkeit der Impfstoffe gegen Omikron als auch die Notwendigkeit einer Booster-Dosis und zwar auch in Ländern mit bereits relevantem Anteil Genesener, aber insbesondere in solchen mit bisher geringer SARS-CoV-2 Aktivität.14
Israelische Forscher zeigten, dass die Plasma-Neutralisationsaktivität nach einer 3. Dosis BNT162b2 gegen Omikron im Vergleich zu Wildtyp-Virus und Delta, selbst zu Beta noch einmal reduziert ist, aber im Gegensatz zur nicht nachweisbaren Neutralisationsaktivität von Plasma fünf Monate nach zwei Impfdosen immer noch relevant war.15 Diese Untersuchungen korrespondieren gut mit der in den USA nach einer Booster-Dosis BNT162b2 beobachteten VE bzgl. Hospitalisation, die bei vorherrschender Omikron-Variante mit 90% nur leicht im Vergleich zu Delta mit 94% eingeschränkt war.11
Der Wert einer weiteren Booster-Dosis/4. Dosis wird u.a. in Israel untersucht.16 In Anbetracht des suboptimalen und bereits nach wenigen Monaten weiter abnehmenden Schutzes nach 3 Impfdosen sowie der durch eine 4. Dosis zumindest kurzfristig zusätzlich erreichbaren Vakzineffektivität von ca. 50% bzgl. einer Infektion durch Omikron bzw. ca. 75% bzgl. eines schweren Verlaufs empfiehlt die STIKO nach weiteren 3 Monaten inzwischen die 4. Impfung für Menschen mit erhöhtem Risiko für einen schweren Verlauf und nach 6 Monaten für MitarbeiterInnen im Gesundheitswesen.
Varianten-spezifische Vakzine
Aktuell sehen einige Experten Varianten-spezifische Impfstoffe als zukünftige Mittel der Wahl. Das Studienprogramm von BNT162 beinhaltete bisher spezifische Produkte gegen Alpha, Delta, Alpha/Delta und Beta (BNT162b2s01, BNT162b2SA, BNT162b2.B.1.351). Der Hersteller hat inzwischen die Entwicklung einer Omikron-spezifischen Version angekündigt.17 Auch mRNA-1273 wird als Wildtyp-/Beta-Impfstoff untersucht (mRNA-1273.211) sowie spezifisch für Beta (mRNA-1273.351). Auch hier hat der Hersteller die schnelle Entwicklung eines Omikron-spezifischen Präparats angekündigt. Ähnlich wie gegen Influenza werden inzwischen universelle, also auch gegen mögliche zukünftige Varianten wirksame Impfstoffkandidaten entwickelt.
Kein Problem: Haftung
Die Anwendung der Impfstoffe ist in den jeweiligen Zulassungstexten zwar spezifisch festgelegt, tatsächlich weichen die Empfehlungen der zuständigen Gesundheitsbehörden (für die USA die CDC/Centers for Disease Control and Prevention18, für Deutschland die STIKO/Ständige Impfkommission (zuletzt in der 18. Aktualisierung der Covid-19-Impfempfehlung)5 zum Teil deutlich vom Zulassungstext ab. Zusätzlich kompliziert wird die Situation in Deutschland durch die Frage des Versorgungsanspruchs bei Impfschaden, der gemäß Infektionsschutzgesetz (IfSG)19 allgemein bei Impfungen besteht, die von der jeweils zuständigen Landesbehörde empfohlen wurden.
Im Fall von SARS-CoV-2-Impfungen greift allerdings auf Bundesebene eine im SGB V20 spezifisch genannte Rechtsverordnung des IfSG, die den Anspruch auf eine Impfung gegen Covid-19 und damit ggfs. auch den Versorgungsanspruch bei Impfschaden regelt. Damit kommen auch Verlautbarungen aus dem Bundesministerium für Gesundheit, der Gesundheitsministerkonferenz sowie den einzelnen Landesgesundheitsministerien in diesem Kontext besondere Bedeutung zu. Die Coronavirus-Impfverordnung21, zuletzt geändert am 16.12.202122, erlaubt jetzt auch konkret die Abweichung von der Zulassung in besonderen Umständen, die aber aufgrund der sich schnell ändernden Evidenzbasis inzwischen eher zur neuen Norm geworden sind: „Die Verabreichung des Impfstoffes soll grundsätzlich im Rahmen der arzneimittelrechtlichen Zulassung erfolgen. Eine davon abweichende Verabreichung kann erfolgen, wenn sie nach dem Stand der Wissenschaft medizinisch vertretbar ist oder im Rahmen nichtkommerzieller klinischer Studien erfolgt.“
Rechtliche Kakophonie
Der Versorgungsanspruch bei Impfschäden wird immer wieder nicht ganz korrekt als „Haftungsübernahme“ durch den Staat bezeichnet. Ob allerdings ein Brief des Bundesgesundheitsministers an seine Landeskollegen, in der er 3 Wochen vor Veröffentlichung der entsprechenden STIKO-Empfehlung zur Booster-Dosis für 12- bis 17-Jährige den Versorgungsanspruch bei Impfschäden auch in dieser Situation bestätigt23, eine ausreichende Rechtsgrundlage darstellt, erscheint nicht final geklärt. Noch verwirrender wurde die (Des-?) Informationslage, als dann ein Landesgesundheitsminister diese Aussage als entsprechende Veränderung der Zulassung interpretierte und auf Twitter die Öffentlichkeit über die Umsetzung dieser Auffassung in seinem Bundesland informierte.24 Auch mit der Veröffentlichung der Aktualisierung der STIKO-Empfehlung5 bleibt zwar u.a. für die Booster-Impfung bei Kindern weiter eine Abweichung vom Zulassungstext, zumindest besteht damit aber eine dem Stand der Wissenschaft entsprechende und damit rechtskonforme bundeseinheitliche Empfehlung, deren detaillierte Begründung auch einsehbar ist.
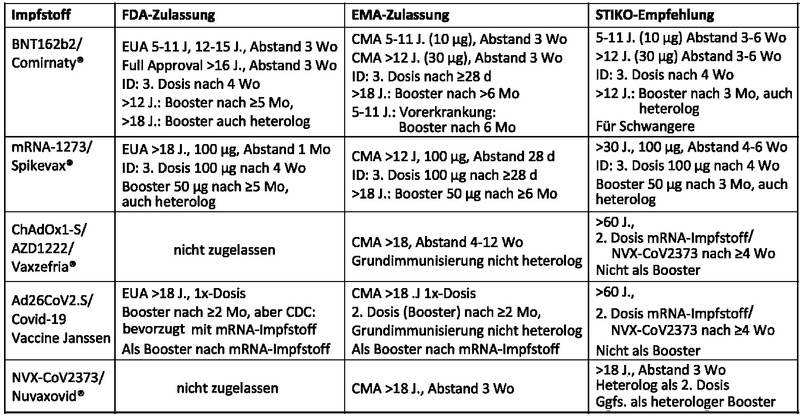
Eine kurze Übersicht über die Eckdaten der FDA- und EMA-Zulassungen sowie die aktuelle STIKO-Empfehlung zu den verschiedenen Impfstoffen ist in Tabelle 1 dargestellt.
Wichtig: Impfung nach Covid-19
Mit Fortschreiten der Pandemie erreichen immer mehr Menschen den „Genesenen-Status“. Das Auftreten neuer Varianten wie aktuell Omikron lässt aber die Schutzwirkung einer früher durchgemachten Infektion fraglich erscheinen, was auch die Verkürzung der Gültigkeit dieses Status25 von 6 Monaten auf nur noch 90 Tage26 nach PCR-Nachweis für „3G“- bzw. „2G“-Regelungen bewirkt hat. Aufgrund der reduzierten VE erkranken auch immer mehr 2- und 3-mal Geimpfte an Covid-19, so dass also die Impfung Genesener immer wichtiger wird.
Die aktuelle STIKO-Empfehlung5 macht hierzu klare Vorgaben. Generell zählt eine Covid-19-Erkrankung derzeit wie eine Impfdosis. Nach der Infektion sollen Personen >12 Jahre generell eigentlich erst mindestens 3 Monate später die erste Impfung erhalten. Allerdings kann dieses Intervall auf 4 Wochen nach Ende der (akuten) Symptome reduziert werden, wenn die durchgemachte Infektion (z.B. mit Delta) eine reduzierte Schutzwirkung gegenüber einer derzeit vorherrschenden Virusvariante mit immune-escape (z.B. Omikron!) erwarten lässt. Anfang 2022 stellt das 4-Wochen-Intervall nach Covid-19-Erkrankung daher also eher den Regelfall dar. Noch einmal mindestens 3 Monate später soll dann eine weitere (Booster-)Impfdosis erfolgen. Bei Menschen mit relevanter Immundefizienz kann auch nach einer Covid-19-Erkrankung eine vollständige und ggfs. erweiterte Impfserie (2 reguläre Dosen, 3. Dosis 4 Wochen nach der 2., Booster ab 3 Monate nach der 3. Dosis) erfolgen.
Tritt eine Infektion nach der 3. (Booster-) Dosis auf, so wird derzeit auch für RisikopatientInnen und MitarbeiterInnen im Gesundheitswesen keine 4. Dosis/2. Booster-Dosis mehr empfohlen.5
Neue Impfstoffe
Mit NVX-CoV2373 (Nuvaxovid®) ist seit Dezember 2022 für Menschen >18 Jahre in Europa der von einigen sehnlich erwartete erste SARS-CoV-2-Impfstoff zugelassen27, der auf einer „herkömmlichen“ (Protein-)Technologie basiert. Diese ist allerdings dann doch eher „Cutting-Edge“, ein mittels rekombinanter DNA-Technologie hergestelltes Spike-Protein wird mit 50 µg Matrix-M, einem Saponin-basierten Adjuvans, als Nanopartikel-Suspension verabreicht. Damit weist NVX-CoV2373 Ähnlichkeit mit dem rekombinanten adjuvantierten Zoster-Impfstoff (Shingrix®) auf. NVX-CoV2373 wird in zwei Dosen von jeweils 5 µg Protein in 0,5 ml Lösung im Abstand von 3 Wochen appliziert.
Die Zulassung beruht v.a. auf einer Phase-III-Studie mit >15.000 Teilnehmern in Großbritannien (2019nCoV-302)28 und einer weiteren mit knapp 30.000 Teilnehmern in den USA und Mexiko (2019nCoV-301).29 Die VE gegen rtPCR-bestätigte SARS-CoV-2-Infektion wurde in der UK-Studie mit 89,7% (86,3% gg. Alpha, 96,4% gg. non-Alpha), in der nordamerikanischen Studie mit 90,4% berechnet.
Eine in Südafrika durchgeführte Phase-IIb-Studie stellte bei v.a. durch die Beta-Variante geprägtem Infektionsgeschehen und einem mit 6% relativ hohen Anteil an Menschen mit HIV-Infektion eine deutlich niedrigere VE von 49,7% fest, bei Studienteilnehmern ohne HIV-Infektion lag sie bei 60,1%.30
Sicherheit
Sicherheitsdaten aus diesen Untersuchungen und einer weiteren Phase-II-Studie aus Australien31 sind inzwischen zu >30.000 mit NVX-CoV2373 geimpften Personen verfügbar. Reaktogenität wurde im erwarteten Rahmen festgestellt mit 75% Empfindlichkeit bzw. 62% Schmerzen an der Einstichstelle, 53% Abgeschlagenheit, 51% Myalgien, 50% Kopfschmerzen, 41% Krankheitsgefühl, 24% Arthralgien und 15% Übelkeit/Erbrechen. Die Beschwerden waren jeweils überwiegend mild bis moderat, die mediane Dauer lag bei maximal 2 Tagen für die lokalen und 1 Tag für die systemischen Nebenwirkungen. Sowohl lokale als auch systemische Nebenwirkungen traten nach der 2. Dosis häufiger auf.27 Die gleichzeitige Gabe einer Influenza-Impfung führte zu verstärkter Reaktogenität und niedrigeren anti-Spike-Antikörper-Titern.32
Damit liegen aus den kontrollierten Studien Sicherheitsdaten in mindestens dem der bisher zugelassenen Vakzine vergleichbaren Umfang vor. Die Erfahrung aus dem Routineeinsatz mit alleine in Deutschland täglich bis zu >500.000 und bis zum 23. Januar 2022 insgesamt >161 Mio. verabreichten Impfdosen, deren Sicherheit regelmäßig und strukturiert ausgewertet33 und bisher bestätigt wird, ist aber auch mittelfristig natürlich kaum aufzuholen.
Aktuelle Empfehlung
Die Verfügbarkeit von NVX-CoV2373 in Deutschland wird ab Ende Februar 2022 erwartet, Empfehlungen zum Einsatz sind von der STIKO jetzt publiziert5, NVX-CoV2373 wird ab 18 Jahren für die Grundimmunisierung empfohlen, ggfs. auch als heterologe 2. Dosis. Bei Kontraindikation gegen mRNA-Impfstoffe kann es trotz fehlender Zulassung auch als Booster eingesetzt werden.
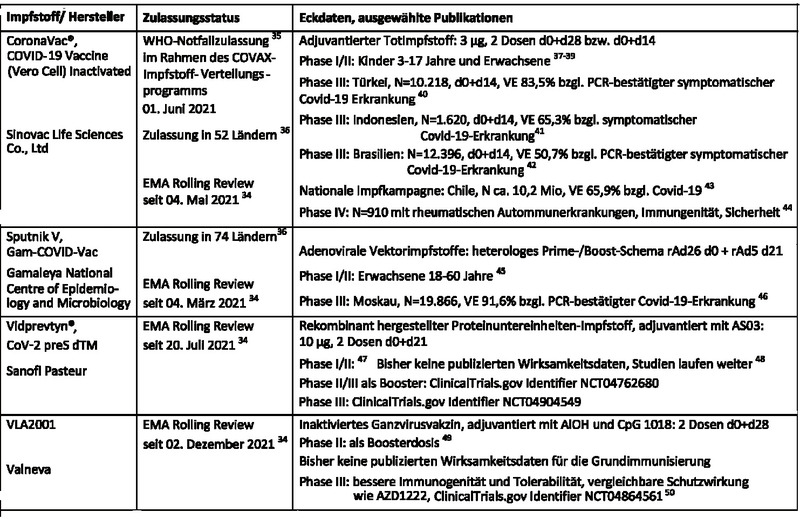
Die Zulassungsanträge von vier weiteren Impfstoffkandidaten werden von der EMA derzeit im beschleunigten Rolling Review-Verfahren34 geprüft, bisher bekannte Eckdaten zu diesen Präparaten sind kurz in Tabelle 2 zusammengefasst.
1 World Health Organization. COVID-19 vaccine tracker and landscape. Verfügbar unter https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines, zuletzt abgerufen am 4. März 2022
2 Seybold U. [Vaccines for adults: an update]. Dtsch Med Wochenschr 2020;145:1464-1468. 10.1055/a-0982-8894
3 United States Food and Drug Administration. COVID-19 Vaccines. Verfügbar unter https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/covid-19-vaccines , zuletzt abgerufen am 10. Januar 2022
4 European Medicines Agency. COVID-19 vaccines: authorised. Verfügbar unter https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-authorised#authorised-covid-19-vaccines-section, zuletzt abgerufen am 15. Februar 2022
5 Ständige Impfkommission beim Robert Koch-Institut. Beschluss der STIKO zur 18. Aktualisierung der COVID-19-Impfempfehlung: Epid Bull 2022;7:3-18
6 Rosenblum HG, Hadler SC, Moulia D, et al. Use of COVID-19 Vaccines After Reports of Adverse Events Among Adult Recipients of Janssen (Johnson & Johnson) and mRNA COVID-19 Vaccines (Pfizer-BioNTech and Moderna): Update from the Advisory Committee on Immunization Practices - United States, July 2021. MMWR Morb Mortal Wkly Rep 2021;70:1094-1099. 10.15585/mmwr.mm7032e4
7 Le Vu S, Bertrand M, Jabagi M-J, et al. Association entre les vaccins COVID-19 à ARN messager et la survenue de myocardite et péricardite chez les personnes de 12 à 50 ans en France - Etude à partir des données du Système National des Données de Santé (SNDS). EPI-PHARE - Groupement d’intérêt scientifique (GIS) ANSM-CNAM, 08. November 2021; verfügbar unter https://ansm.sante.fr/uploads/2021/11/08/20211108-covid-19-vaccins-rapport-epiphare-myocardite-pericardite.pdf, zuletzt abgerufen am 23. Januar 2022
8 Kirby AE, Welsh RM, Marsh ZA, et al. Notes from the Field: Early Evidence of the SARS-CoV-2 B.1.1.529 (Omicron) Variant in Community Wastewater - United States, November-December 2021. MMWR Morb Mortal Wkly Rep 2022;71:103-105. 10.15585/mmwr.mm7103a5
9 Cameroni E, Bowen JE, Rosen LE, et al. Broadly neutralizing antibodies overcome SARS-CoV-2 Omicron antigenic shift. Nature 202110.1038/s41586-021-04386-2
10 Collie S, Champion J, Moultrie H, Bekker LG and Gray G. Effectiveness of BNT162b2 Vaccine against Omicron Variant in South Africa. N Engl J Med 202110.1056/NEJMc2119270
11 Thompson M, Natarajan K, Irving S, et al. Effectiveness of a Third Dose of mRNA Vaccines Against COVID-19–Associated Emergency Department and Urgent Care Encounters and Hospitalizations Among Adults During Periods of Delta and Omicron Variant Predominance — VISION Network, 10 States, August 2021–January 2022. MMWR Morb Mortal Wkly Rep. ePub: 21 January 2022. DOI: 10.15585/mmwr.mm7104e3
12 Schmidt F, Muecksch F, Weisblum Y, et al. Plasma Neutralization of the SARS-CoV-2 Omicron Variant. N Engl J Med 2021. DOI: 10.1056/NEJMc2119641
13 Cele S, Jackson L, Khan K, et al. SARS-CoV-2 Omicron has extensive but incomplete escape of Pfizer BNT162b2 elicited neutralization and requires ACE2 for infection. medRxiv 2021. DOI: 10.1101/2021.12.08.21267417
14 Hogan AB, Wu2 SL, Doohan P, et al. The value of vaccine booster doses to mitigate the global impact of the Omicron SARS-CoV-2 variant. Imperial College London (15-12-2021) 2021. DOI: 10.25561/93034.
15 Nemet I, Kliker L, Lustig Y, et al. Third BNT162b2 Vaccination Neutralization of SARS-CoV-2 Omicron Infection. N Engl J Med 2021. DOI: 10.1056/NEJMc2119358
16 Bar-On YM, Goldberg Y, Mandel M, Bodenheimer O, Amir O, Freedman L, et al. Protection by 4th dose of BNT162b2 against Omicron in Israel, medRxiv. 2022:2022.02.01.22270232, verfügbar unter: https://www.medrxiv.org/content/10.1101/2022.02.01.22270232v1.full.pdf, zuletzt abgerufen am 15.02.2022.
17 Reuters. Deals - Pfizer CEO says Omicron-targeted vaccine is most likely outcome. Agenturmeldung vom 10. Januar 2022; verfügbar unter https://www.reuters.com/markets/deals/pfizer-joins-beam-therapeutics-develop-rare-disease-therapies-2022-01-10/ , zuletzt abgerufen am 23. Januar 2022
18 Centers for Disease Control and Prevention. Vaccines for COVID-19. Verfügbar unter https:// www.cdc.gov/coronavirus/2019-ncov/vaccines/index.html, zuletzt abgerufen am 15. Febr.2022
19 Bundesministerium der Justiz. Gesetz zur Verhütung und Bekämpfung von Infektionskrankheiten beim Menschen (Infektionsschutzgesetz - IfSG), § 60 Versorgung bei Impfschaden und bei Gesundheitsschäden durch andere Maßnahmen der spezifischen Prophylaxe. Verfügbar unter https://www.gesetze-im-internet.de/ifsg/__60.html, zuletzt abgerufen am 20. Januar 2022
20 Bundesministerium der Justiz. Sozialgesetzbuch (SGB) Fünftes Buch (V) - Gesetzliche Kran-kenversicherung - (Artikel 1 des Gesetzes v. 20. Dezember 1988, BGBl. I S. 2477) § 20i Leistungen zur Verhütung übertragbarer Krankheiten, Verordnungsermächtigung. Verfügbar unter https://www.gesetze-im-internet.de/sgb_5/__20i.html, zuletzt abgerufen am 20. Januar 2022
21 Bundesministerium der Justiz. Verordnung zum Anspruch auf Schutzimpfung gegen das Coronavirus SARS-CoV-2 (Coronavirus-Impfverordnung - CoronaImpfV)- § 1 Anspruch. Verfügbar unter https://www.gesetze-im-internet.de/coronaimpfv_2021-09/__1.html, zuletzt abgerufen am 10. Januar 2022
22 Bundesministerium für Gesundheit. Verordnung zur Änderung der Coronavirus-Impfverord-nung und der Coronavirus-Testverordnung - Vom 16. Dezember 2021. BAnz AT 17.12. 2021;V1:1-3.
23 Höhl R. Rechtssicherheit für Ärzte - Lauterbach: Für die Corona-Booster-Impfung haftet der Staat. ÄrzteZeitung online, 28.12. 2021:verfügbar unter https://www.aerztezeitung.de/Nachrichten/Lauterbach-Fuer-die-Corona-Booster-Impfung-haftet-der-Staat-425692.html . Zuletzt abgerufen am 10. Januar 2022.
24 Holetschek K. Gut, dass der Bund klarstellt: Boostern mit BioNTech ist für U18 von Zulassung umfasst & im Falle eines Impfschadens gilt Versorgungsanspruch. In: @klausholetschek, ed: Twitter (https://twitter.com/klausholetschek/status/1475867856764026880?s=20) 5:34 p.m., 28. Dez., 2021
25 Bundesministerium für Gesundheit. Verordnung zur Änderung der COVID-19-Schutzmaßnahmen-Ausnahmenverordnung und der Coronavirus-Einreiseverordnung - Vom 14. Januar 2022. BAnz AT 14.01. 2022;V1:1-3.
26 Robert Koch Institut. Fachliche Vorgaben des RKI für COVID-19-Genesenennachweise. Verfügbar unter https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Genesenennachweis.html, zuletzt abgerufen am 22. Januar 2022
27 European Medicines Agency. Nuvaxovid - Summary of product characteristics. Verfügbar unter https://www.ema.europa.eu/en/documents/product-information/nuvaxovid-epar-product-information_en.pdf, zuletzt abgerufen am 22. Januar 2022
28 Heath PT, Galiza EP, Baxter DN, et al. Safety and Efficacy of NVX-CoV2373 Covid-19 Vaccine. N Engl J Med 2021;385:1172-1183. 10.1056/NEJMoa2107659
29 Dunkle LM, Kotloff KL, Gay CL, et al. Efficacy and Safety of NVX-CoV2373 in Adults in the United States and Mexico. N Engl J Med 202110.1056/NEJMoa2116185
30 Shinde V, Bhikha S, Hoosain Z, et al. Efficacy of NVX-CoV2373 Covid-19 Vaccine against the B.1.351 Variant. N Engl J Med 2021;384:1899-1909. DOI: 10.1056/NEJMoa2103055
31 Formica N, Mallory R, Albert G, et al. Different dose regimens of a SARS-CoV-2 recombinant spike protein vaccine (NVX-CoV2373) in younger and older adults: A phase 2 randomized placebo-controlled trial. PLoS Med 2021;18:e1003769. 10.1371/journal.pmed.1003769
32 Toback S, Galiza E, Cosgrove C, et al. Safety, immunogenicity, and efficacy of a COVID-19 vaccine (NVX-CoV2373) co-administered with seasonal influenza vaccines: an exploratory substudy of a randomised, observer-blinded, placebo-controlled, phase 3 trial. Lancet Respir Med 2021 DOI: 10.1016/S2213-2600(21)00409-4
33 Paul-Ehrlich-Institut. Verdachtsfälle von Nebenwirkungen und Impfkomplikationen nach Impfung zum Schutz vor COVID-19 seit Beginn der Impfkampagne am 27.12.2020 bis zum 31.12.2021. Sicherheitsbericht, 7.2.2022; verfügbar unter https://www.pei.de/SharedDocs/Downloads/DE/newsroom/dossiers/sicherheitsberichte/sicherheitsbericht-27-12-20-bis-31-12-21.pdf?__blob=publicationFile&v=5 , zuetzt abgerufen am 15.02.2022
34 European Medicines Agency. COVID-19 vaccines: under evaluation. Verfügbar unter https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-under-evaluation# covid-19-vaccines-under-rolling-review-section, zuletzt abgerufen am 15. Februar 2022
35 World Health Organization. COVID-19 vaccines: product-by-product information. Verfügbar unter https://www.who.int/emergencies/diseases/novel-coronavirus-2019/covid-19-vaccines, zuletzt abgerufen am 23. Januar 2022
36 VIPER Group COVID19 Vaccine Tracker Team. COVID-19 vaccine tracker - Approved vaccines. Verfügbar unter https://covid19.trackvaccines.org/vaccines/approved/, zuletzt abgerufen am 23. Januar 2022
37 Zhang Y, Zeng G, Pan H, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis 2021;21:181-192. 10.1016/S1473-3099(20)30843-4
38 Wu Z, Hu Y, Xu M, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis 2021;21:803-812. 10.1016/S1473-3099(20)30987-7
39 Han B, Song Y, Li C, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy children and adolescents: a double-blind, randomised, controlled, phase 1/2 clinical trial. Lancet Infect Dis 2021;21:1645-1653. 10.1016/S1473-3099(21)00319-4
40 Tanriover MD, Doganay HL, Akova M, et al. Efficacy and safety of an inactivated whole-virion SARS-CoV-2 vaccine (CoronaVac): interim results of a double-blind, randomised, placebo-controlled, phase 3 trial in Turkey. Lancet 2021;398:213-222. 10.1016/S0140-6736(21)01429-X
41 Fadlyana E, Rusmil K, Tarigan R, et al. A phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-CoV-2 inactivated vaccine in healthy adults aged 18-59 years: An interim analysis in Indonesia. Vaccine 2021;39:6520-6528. 10.1016/j.vaccine.2021.09.052
42 Palacios R, Batista AP, Santos Nascimento Albuquerque C, et al. Efficacy and safety of a COVID-19 inactivated vaccine in healthcare professionals in Brazil: The PROFISCOV study. SSRN (Preprint) 2021 DOI: 10.2139/ssrn.3822780
43 Jara A, Undurraga EA, Gonzalez C, et al. Effectiveness of an Inactivated SARS-CoV-2 Vaccine in Chile. N Engl J Med 2021;385:875-884. 10.1056/NEJMoa2107715
44 Medeiros-Ribeiro AC, Aikawa NE, Saad CGS, et al. Immunogenicity and safety of the CoronaVac inactivated vaccine in patients with autoimmune rheumatic diseases: a phase 4 trial. Nat Med 2021;27:1744-1751. 10.1038/s41591-021-01469-5
45 Logunov DY, Dolzhikova IV, Zubkova OV, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet 2020;396:887-897. 10.1016/S0140-6736(20)31866-3
46 Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021;397:671-681. 10.1016/S0140-6736(21)00234-8
47 Goepfert PA, Fu B, Chabanon AL, et al. Safety and immunogenicity of SARS-CoV-2 recombinant protein vaccine formulations in healthy adults: interim results of a randomised, placebo-controlled, phase 1-2, dose-ranging study. Lancet Infect Dis 2021;21:1257-1270. 10.1016/S1473-3099(21)00147-X
48 Sanofi-Pasteur. Sanofi and GSK announce positive preliminary booster data for their COVID-19 vaccine candidate and continuation of Phase 3 trial per independent Monitoring Board recommendation. Pressemitteilung vom 15. Dezember 2021; verfügbar unter https://www.sanofi.com/en/media-room/press-releases/2021/2021-12-15-07-30-00-2352255, zuletzt abgerufen am 23. Januar 2022
49 Munro APS, Janani L, Cornelius V, et al. Safety and immunogenicity of seven COVID-19 vaccines as a third dose (booster) following two doses of ChAdOx1 nCov-19 or BNT162b2 in the UK (COV-BOOST): a blinded, multicentre, randomised, controlled, phase 2 trial. Lancet 2021;398:2258-2276. 10.1016/S0140-6736(21)02717-3
50 Valneva SE. Valneva annonce des résultats de Phase 3 positifs pour son candidat vaccin inactivé et adjuvanté contre la COVID-19, VLA2001. Pressemitteilung vom 18. Oktober 2021; verfügbar unter https://valneva.com/press-release/valneva-reports-positive-phase-3-results-for-inactivated-adjuvanted-covid-19-vaccine-candidate-vla2001/?lang=fr, zuletzt abgerufen am 23. Januar 2022










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
