Martin Däumer, Kaiserslautern, und Eva Wolf, München
Wie sinnvoll ist eine provirale Resistenztestung?
Technische Herausforderungen und klinische Einordnung
Die provirale DNA kann in besonderen klinischen Situationen ein alternativer Analyt für die genotypische Resistenztestung sein, insbesondere wenn die Verwendung plasmaviraler RNA nicht durchführbar oder nicht erfolgreich ist und zugleich die Reihenfolge des Auftretens der Resistenzmutationen von untergeordneter Bedeutung ist. Bei der Interpretation der Ergebnisse der proviralen Resistenztestung sollten jedoch Aspekte der Dynamik des zellulären HIV-Reservoirs wie auch der Technologie der Testung berücksichtigt werden. Trotz einiger Limitationen, die im Folgenden erläutert werden, liefert die provirale Resistenztestung für verschiedene Fragestellungen wichtige Informationen für den weiteren Therapieverlauf.
Virale Resistenztestung
Resistenztests vor Beginn einer Therapie bzw. bei virologischem Versagen gehören seit langem zum Behandlungsstandard. Dabei geben sie Aufschluss über das Vorhandensein Resistenz-assoziierter Mutationen (RAMs) und Polymorphismen. Der Goldstandard bei der Wahl des Untersuchungsmaterials ist die RNA der freien (nicht-zellassoziierten) Viruspartikel im Plasma. Insbesondere im Falle eines Therapieversagens ist RNA von Viren, die unter dem Selektionsdruck der aktuellen antiretroviralen Therapie (ART) replizieren, am besten geeignet.
Um Plasma-HIV-Resistenztests erfolgreich durchführen zu können und die Sequenzen der zirkulierenden HIV-Viruspartikel gut charakterisieren zu können, ist idealerweise eine nachweisbare Viruslast von mindestens 300-500 Kopien/ml erforderlich. Unterhalb der Grenze von ca. 200-300 Kopien/ml steigt die Ausfallquote drastisch. Bei nicht nachweisbarer Viruslast bzw. Viruslasten unter 50 Kopien/ml sind Plasma-basierte Resistenztests faktisch nicht durchführbar.
Provirale Resistenztestung
Das Problem der Low-Level-Virämie (<200 Kopien/ml) unter laufender ART hat zur Berücksichtigung der proviralen DNA als alternativen Analyten in der Resistenztestung geführt. Als Untersuchungsmaterial wird hierzu EDTA-Vollblut (statt EDTA-Plasma) benötigt.
Unter dem Begriff der proviralen DNA versteht man allgemein den transkribierten, zellassoziierten Teil der viralen Nukleinsäure (integriert oder episomal vorliegend), der in mononukleären Zellen des peripheren Bluts, insbesondere in Makrophagen oder CD4+- Lymphozyten des peripheren Blutes zu finden ist. Ein kleiner Teil der aktiv produzierenden HIV-infizierten Zellen geht in einen sogenannten Ruhezustand (Latenz) und entgeht somit dem schnellen Zelltod und ist auch durch die antivirale Therapie nicht zu erreichen. Latent infizierte Zellen tragen das Virusgenom in sich, produzieren jedoch keine neuen Viruspartikel. Die Gedächtnis (Memory)- CD4+ T-Zellen stellen den größten Anteil dieses zellulären HIV-Reservoirs dar.
Bei einer Low-Level-Virämie im Plasma kann es sich im Übrigen auch um HIV-1 Partikel handeln, die durch eine Aktivierung, z.B. durch eine (zufällige) Antigenstimulierung, aus den so genannten latenten Reservoirs freigesetzt werden und gegebenenfalls nicht replikationskompetent sind (nur ca. 10% der infizierten Zellen enthalten intaktes Virusgenom) (Liu 2016, Ho 2013, Bruner 2016).
RAMs früher und aktuell
Die Resistenzsituation in der proviralen DNA spiegelt in der Regel nicht die aktuelle Resistenzsituation der plasmaviralen RNA wider. Dass Testergebnisse aus plasmaviraler RNA und korrespondierender proviraler DNA teilweise deutliche Diskrepanzen aufweisen, ist seit langer Zeit bekannt (Smith 1993, Kaye 1995).
Auch die historische Resistenzsituation wird nicht unbedingt abgebildet, so auch in der deutschen LOWER-Studie, die in 13 großen HIV-Schwerpunktzentren durchgeführt wurde. In einem Kollektiv unter suppressiver ART jedoch historisch nachgewiesener Mehrklassen-Resistenz wurden insgesamt nur ca. 40%-60% der historischen RAMs in der proviralen Resistenztestung mittels NGS-Technologie (Next-Generation-Sequencing) wiedergefunden, abhängig davon, wie sensitiv gemessen wurde, d.h. ob ein Cut-off von 15% (vergleichbar mit den historischen Nachweisgrenzen der Populationssequenzierung) oder von 1% gewählt wurde (Daeumer 2019).
Auf individueller Ebene gab es eine hohe Variabilität der Re-Detektion von 0 bis 100%. Es gab Patient:innen, bei denen alle nachgewiesenen RAMs aus den historischen Resistenztests im Provirus redetektiert wurden, aber auch einige, bei denen im Provirus selbst mit niedrigem Cut-off die früheren Mutationen nicht gefunden wurden (Hoffmann 2019). Im Folgenden wird die Dynamik des proviralen Reservoirs in verschiedenen Therapiesituationen und mögliche zugrundeliegenden Mechanismen eingegangen.
Dynamik des proviralen Archivs
Zu Beginn dieses Abschnittes sollte festgehalten werden, dass die Autoren dieses Beitrags unter dem Begriff „provirales Archiv“ oder „HIV-Reservoir“ die Summe der proviralen DNA (pDNA), unabhängig von der Replikationsfähigkeit, verstehen.
Die Zusammensetzung des Reservoirs kann sich im Verlauf der HIV-Infektion ändern (Mullins 2017). Die zeitliche Entwicklung archivierter RAMs in proviraler DNA bei virologischem Versagen einerseits oder bei dauerhafter Virussuppression andererseits ist allerdings schwer vorherzusehen.
Somit liegt die Vermutung nahe, dass die Wahrscheinlichkeit der Detektion älterer pDNA-Varianten innerhalb dieser Population keine lineare Funktion der Zeit ist, was möglicherweise auf eine zufällige Elimination proviraler DNA-Varianten durch zytotoxische T-Zellen zurückzuführen ist (Chu 2022). Innerhalb der ersten Wochen nach Infektion akkumulieren bereits defekte Proviren zu einem Anteil von >90% (Bruner 2016).
Nach Beginn einer ART verlangsamt sich die Dynamik des proviralen Archivs. Dies könnte auf die immunologische Rekonstitution zurückgeführt werden, da sowohl die Immunaktivierung als auch die Elimination von CD4+-Lymphozyten reduziert ist (Cohn 2020). Fluktuationen im proviralen Archiv ergeben sich auch aus der Zunahme des Anteils latent infizierter Zellen, die eine klonale Expansion durchlaufen (Wagner 2013), so dass diese im weiteren Verlauf das Reservoir dominieren können (Crooks 2015). Eine klonale Expansion kann Gedächtnis-CD4+-T-Lymphozyten, die replikationskompetente oder defekte Proviren enthalten, betreffen (Hosmane 2017). Dennoch gibt es Hinweise auf eine fortschreitende Anreicherung defekter Proviren, da diese seltener reaktiviert werden, was zu einer Elimination durch zytotoxische T-Zellen führen würde (Ghandi 2021).
Die LOWER-Studie bestätigte die Dynamik des pDNA-Archivs. In einer Subpopulation wurde drei Jahre später erneut eine provirale Resistenztestung durchgeführt. Voraussetzung war eine dauerhafte Virussuppression zwischen beiden Messzeitpunkten. Es wurde eine hohe intraindividuelle Diskordanz beobachtet. In der 2. Messung wurden teilweise historische RAMs nachgewiesen, die in der 1. Messung nicht detektiert worden waren und umgekehrt (Hoffmann 2022).
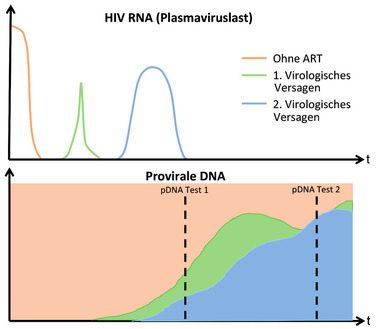
Abb. 1 Mögliche Zusammensetzung des proviralen Reservoirs nach mehrfachem virologischem Versagen (modifiziert nach D‘Antoni 2021)
Da selbst virale „Blips“ und eine Low-Level-Virämie Einfluss auf das Reservoir in Form der proviralen Last haben (Bachmann 2019), muss man davon ausgehen, dass multiple, resistenzbedingte Therapieversagen mit intermittierender Virussuppression zu einer deutlichen Umwälzung des proviralen Archivs führen können. Abhängig von der Höhe und Dauer der Virusreplikation im Plasma kann es Monate dauern bis bereits in der plasmaviralen RNA nachgewiesene Resistenzmutationen auch in der DNA in den Zellen des peripheren Blutes detektiert werden können (Abb. 1) (Bi 2003).
Fallstricke der proviralen Testung
Die Verwendung proviraler DNA als Analyt in der genotypischen Resistenztestung kann einige Fallstricke mit sich bringen. So beträgt die provirale Last nach mehrjähriger Virussuppression gerade einmal 1,5 bis 2,5 log/106 Zellen (Anderson 2018). Bei derart niedrigen Viruslasten ist eine selektive Amplifikation einzelner proviraler Klone nicht unwahrscheinlich. Nach eigener Erfahrung kann ein Triplikatansatz zumindest der PCR ein etwas genaueres Bild des proviralen Archivs liefern.
Wie bereits oben erwähnt ist unter ART der Großteil aller detektierten proviralen Genome defekt. Diese Provirus-Sequenzdefekte, die Mutationen (auch vorzeitige Stoppcodons) und Deletionen umfassen, entstehen durch verschiedene Mechanismen, im Wesentlichen durch die HIV-eigene Reverse Transkriptase und/oder die zelleigenen APOBEC3F/G Enzyme, die Guanin-zu-Adenin (G→A)-Hypermutationen verursachen (Ho 2013, Abram 2010). Das Problematische daran ist, dass APOBEC-induzierte Mutationen auch an Resistenz-assoziierten Positionen auftreten können (Protease: D30N, M46I, G48S, G73S; Reverse Transkriptase: D67N, E138K, M184I, G190S, M230I; Integrase G118R, E138K, G140RS, G163KR, D232N, R263K).
APOBEC-Filter
Um eine Überinterpretation der Resistenzsituation im proviralen Archiv weitgehend zu vermeiden, müssen APOBEC-Filter nach der Sequenzierung zur Anwendung kommen. Hier können Anwender von NGS-Technologien mithilfe bioinformatischer Applikationen diejenigen Sequenzabschnitte herausfiltern, auf denen APOBEC-induzierte „Resistenzmutationen“ mit APOBEC-induzierten Stoppcodons vorkommen (Thielen 2016). Wichtig ist, dass man als Behandler vom durchführenden Labor informiert wird, ob eine APOBEC-Filterung durchgeführt wurde, oder ggf. auf mögliche APOBEC- Mutationen hingewiesen wird.
Nutzen der proviralen Testung
Trotz obengenannter Limitationen kann die Testung proviraler DNA bei niedriger oder nicht nachweisbarer Viruslast z.B. vor einer Therapieumstellung aufgrund von Nebenwirkungen oder einer Therapievereinfachung hilfreich sein, insbesondere dann, wenn
- kein Resistenztest vor Therapiebeginn vorliegt,
- die Therapiehistorie lückenhaft ist oder
- keine historischen Resistenztests bei virologischen Versagen durchgeführt wurden bzw. vorliegen.
Als Beispiel genannt sei hier die Umstellung auf eine langwirksame Injektionstherapie mit Cabotegravir und Rilpivirin. Wenn keine historischen Resistenzinformationen vor ART-Beginn oder im Verlauf vorliegen, ist eine provirale Resistenztestung zu empfehlen.
In den klinischen Studien waren in der post-hoc Analyse Rilpivirin-assoziierte RAMs im Provirus mit einem erhöhten Risiko virologischen Versagens assoziiert (Rizzardini 2020). Unter den Ausschlusskriterien der Studien waren zwar historische oder aktuelle NNRTI- oder INSTI-Mutationen sowie vorausgegangenes virologisches Versagen, dennoch konnten damit RAMs im proviralen Archiv nicht ausgeschlossen werden. Insbesondere sei an dieser Stelle darauf hingewiesen, dass auch Polymorphismen mit einer (partiellen) RPV-Resistenz assoziiert sein können, so z.B. E138A im Reverse Transkriptase Gen, der mit einer Prävalenz von 2-5% bei ART-naiven Menschen mit HIV vorkommt.
Fazit
Die provirale Resistenztestung hat sich bereits bei vielen HIV-Behandlern als diagnostisches Tool bei bestimmten Fragestellungen bewährt. Sie hat ihren Stellenwert bei Therapieumstellungen im suppressiven Setting bzw. bei Low-Level-Virämie. Ziel der Sequenzierung des Provirus ist, Resistenz-assoziierte Mutationen, die in der Vergangenheit unter ART selektiert oder transmittiert wurden, nachzuweisen.
Eine Limitation der proviralen Resistenztestung ist, dass ein großer Teil der Proviren nicht replikationskompetent ist. Anwender von Next-Generation-Sequencing-Technologien können jedoch mithilfe bioinformatischer Tools Sequenzdefekte herausfiltern. Auch weil HIV-Reservoire einer gewissen Dynamik unterliegen, sollte ein provirales Resistenzmuster immer im Kontext der Therapiehistorie und, sofern vorhanden, historischer Resistenzbefunde beurteilt werden.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
