42TH EASL 11.-15. APRIL 2007 IN BARCELONA
Neue Therapieoptionen - Möglichkeiten und Probleme
 Die Tagung der
European Association for the Study of the Liver, kurz EASL genannt, erfreut sich stetiger Beliebtheit.
Auch in diesem Jahr waren wieder über 5.000 Teilnehmer angereist, um 128 Vorträge zu hören
sowie 666 Poster zu sehen. Im Mittelpunkt standen bei der Hepatitis C die neuen Substanzen und die
Resistenz. Bei Hepatitis B gab es Updates zu den bekannten großen Studien. Die Fragen nach der
optimalen Kombination und Sequenzierung der antiviralen Medikamente wurden bei beiden Arten der viralen
Hepatitis intensiv diskutiert.
Die Tagung der
European Association for the Study of the Liver, kurz EASL genannt, erfreut sich stetiger Beliebtheit.
Auch in diesem Jahr waren wieder über 5.000 Teilnehmer angereist, um 128 Vorträge zu hören
sowie 666 Poster zu sehen. Im Mittelpunkt standen bei der Hepatitis C die neuen Substanzen und die
Resistenz. Bei Hepatitis B gab es Updates zu den bekannten großen Studien. Die Fragen nach der
optimalen Kombination und Sequenzierung der antiviralen Medikamente wurden bei beiden Arten der viralen
Hepatitis intensiv diskutiert.
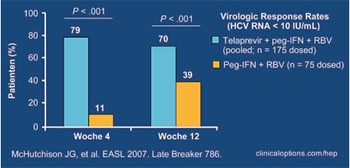
Abb. 1: Virologisches Ansprechen zu Woche 4
(RVR HCV-RNA <10 IU/ml)
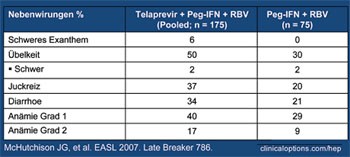
Tab. 1: Nebenwirkungen. Ausschlag war die häufigste
Ursache für einen Therapieabbruch unter Telapravir.
Mittlere Dauer bis zum Auf- treten des Exanthems: 62 Tage
Im Bereich der Hepatitis C unterscheidet man mittlerweile die konventionelle Therapie mit pegyliertem Interferon (pegIFN) und Ribavirin von der STAT-C ("Specifically Targeted Antiviral Therapy for HCV"), bei der spezifisch gegen HCV wirksame Medikamente eingesetzt werden. Am weitesten entwickelt ist hier der Proteasehemmer Telapravir (vormals VX-950). Neun Arbeiten wurden zu dieser Substanz vorgestellt. Die Präsentation der (vorläufigen) Ergebnisse der ersten Studie mit Telapravir (vormals VX 950) in Kombination mit pegIFN und Ribavirin bei therapienaiven Patienten, die mit großer Spannung erwartet wurden, waren das unumstrittene Highlight der Konferenz.
BESSERE RVR MIT TELAPRAVIR
In der noch laufenden Phase-2-Studie mit dem Namen PROVE 1 werden therapienaive Patienten (n=260) mit Genotyp 1 mit pegIFN plus Ribavirin plus entweder Telapravir in drei verschiedenen Dosierungen oder Placebo behandelt. Vorgestellt wurden die Ergebnisse einer planmäßigen Interim-Analyse der Daten der ersten 80 Patienten, die Woche 12 abgeschlossen hatten.
Nach vier Wochen (RVR) hatten signifikant mehr Patienten in der Telapravir-Gruppe eine HCV RNA <30 IU/ml bzw. <10 IU/ml erreicht (88% vs. 16% bzw. 79% vs. 11%) (Abb. 1). Nach 12 Wochen wiesen ebenfalls signifikant mehr Patienten in der Telapravir-Gruppe eine HCV RNA <30 IU/ml bzw. <10 IU/ml auf (85% vs. 43% bzw. 70% vs. 39%). In der Telapravir-Gruppe war es allerdings häufiger zu einem viralen Durchbruch gekommen, definiert als Anstieg der HCV RNA um +1 log vom Nadir bzw. bei >100 IU/ml bei Patienten, die eine HCV RNA <30 IU/ml erreicht hatten (3% vs 7%). Bei 9 dieser 12 Patienten unter Telapravir war die HCV RNA nie <30 IU/ml gefallen. Möglicherweise ist eine Resistenzentwicklung der Grund für das Therapieversagen, die genotypische Resistenztestung läuft noch.
Neue STAT-C
Die diesjährige EASL war der Kongress der neuen Substanzen. Die Zahl der neuen Substanzen, die mit der HCV-Replikation interferieren, war so groß wie noch nie. Die meisten davon sind in der frühen klinischen Entwicklung. Bei den Proteasehmmern ist Boceprevir (früher SCH 503034) nach Telapravir am weitesten fortgeschritten (Preston RA et al. #545). Hier wird demnächst die große Phase-2-Studie SPRINT-1 beginnen, mit Boceprevir 800 mg TID in Kombination mit pegINF-2b und Ribavirin. Bei den Polymerasehemmern gab es klinische Daten zum nicht-nukleosidischen HCV-796. Die Substanz führte in Kombination mit pegIFN bei Patienten mit Genotyp 1 zu einer Reduktion der Viruslast um bis zu 3 log im Vergleich zu 1,2 log unter pegIFN allein. Bei einem Drittel der Patienten entwickelte sich die Mutation C316Y. Die Verträglichkeit war gut, es wurden lediglich vermehrt Hautausschläge beobachtet (Villano SA et al. #50).
Neuartige Substanzen
Neuartig ist ACH-806, ein "small molecule". Die Substanz bindet an den NS4A-Kofaktor, der mit der NS3-Protease interagiert. Sie hat den Vorteil, dass es keine Kreuzresistenz mit den anderen HCV-Inhibitoren gibt. In einer ersten Studie an Patienten mit Genotyp 1 führte ACH-806 innerhalb von fünf Tagen zu einer Reduktion der Viruslast um knapp 1 log. Die Substanz scheint jedoch die Nierenfunktion zu beeinträchtigen und wird deshalb nicht weiterentwickelt (Pottage JC Jr et al. #783).
Im Hinblick auf die Verträglichkeit wurden erstmals relevante unerwünschte Wirkungen unter Telapravir berichtet. Häufigste Nebenwirkungen waren Hautausschlag, gastrointestinale Beschwerden und Anämie (Tab. 1). Mehr Patienten unter Telapravir brachen die Therapie wegen Nebenwirkungen ab (11% vs 3%). Da dieses Nebenwirkungsspektrum stark dem Nebenwirkungsprofil von Ribavirin ähnelt, wurde diskutiert, ob Telapravir möglicherweise die Ribavirin-Spiegel im Blut erhöht (McHutchinson JG et al. #786).
KOMBINATIONEN GEGEN HCV
Die STAT-C-Medikamente werden in Zukunft nicht allein, sondern in Kombinationen eingesetzt werden. Die Suche nach geeigneten Kombinationen läuft bereits auf Hochtouren. So zeigte im experimentellen Replicon-Zellsystem die Kombination aus dem "Small Molecule Inihibitor" ACH-806 (frührer GS 9132) mit Telapravir und dem Polymerasehemmer NM 107 (aktive Substanz von MN 238) einen synergistischen Effekt, d.h. die EC90 der Substanzen lag in der Kombination unter der bekannten Konzentration für die einzelnen Substanzen (Huang M et al. #13). Einen ähnlich günstigen Effekt zeigte die Kombination des Proteasehemmers Boceprevir mit den Polymerasehemmern HCV-796 bzw Valopicitabin (Howe AY et al. #432; Ralston R et al. #793).
VOLPICITABIN BESSER BEI THERAPIE-NAIVEN?
Bei den Polymerasehemmern ist Valopicitabin (MN238) am weitesten entwickelt. Es wurden Daten von Phase-2-Studien an Therapie-naiven Patienten bzw. Non-Respondern präsentiert, bei denen lediglich die Studie an den nicht vorbehandelten Patienten einen Vorteil zeigte. Im Rahmen dieser 5-armigen Studie wurden 173 Patienten mit Genotyp 1 mit Volpicitabin in verschiedenen Dosierungen in Kombination mit pegIFN behandelt. In einem Arm erhielten die Patienten allerdings vier Wochen lang pegIFN und danach bis Woche 48 die Kombination. Dabei war pegIFN in Kombination mit Valopicitabin besser als pegIFN allein. Die Kombination senkte die Viruslast in den ersten vier Wochen um 1 bis 1,7 log. Etwa die Hälfte der Patienten unter pegIFN plus Valopicitabin erreichte eine EVR, wobei die Dosis von 200 mg den besten Effekt und die beste Verträglichkeit aufwies (Lawitz E et al. #14). Bei den Nonrespondern (n=190, Genotyp 1) zeigte Valopicitabin allein keinen Effekt und pegIFN/Valocitabin eine ähnlich (schwache) Wirkung wie pegIFN/Ribavirin. Lediglich bei Patienten mit partiellem Ansprechen der Vortherapie war pegIFN/Valopicitabin besser. Die gastrointestinalen Nebenwirkungen waren unter 800 mg Valopicitabin am stärksten. Diese Dosis wird deshalb nicht weiterentwickelt (Afdhal N et al. #6).
ALBUMIN-INTERFERON
Albinterferon ist ein rekombinates Fusionsprotein aus Interferon alfa-2b und humanem Serumalbumin. Hauptvorteil ist die längere Halbwertszeit, die eine 14-tägige, möglicherweise sogar monatliche Gabe ermöglicht. Vorgestellt wurden die 60-Wochen-Daten einer Phase-2b-Studie an 458 Interferon-naiven Patienten mit Genotyp 1. Albinterferon 900 µg Q2W bzw. 1.200 µg Q2W bzw. 1.200 µg Q4W jeweils plus Ribavirin führte zu einer vergleichbaren Ansprechrate wie pegIFN/ Ribavirin (SVR 12 Wochen nach 48 Wochen 59% vs. 56% vs. 53% vs. 54%). Die hämatologischen Nebenwirkungen waren bei Albinterferon einmal alle zwei Wochen vergleichbar, bei Albinterferon einmal monatlich jedoch deutlich geringer (Zeuzem S et al. #779). Bei Patienten mit Genotyp 2/3 (n=43) führte Albinterferon 1.500 µg Q2W bzw. Q4W ebenfalls zu einer vergleichbaren SVR zu Woche 60 (67% vs. 73%) (Bain VG et al. #9).
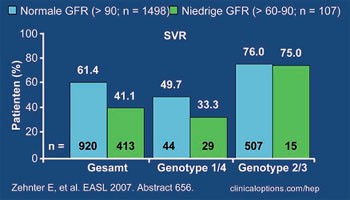
Abb. 2: Korrelation Glomeruläre Filtrationsrate und SVR
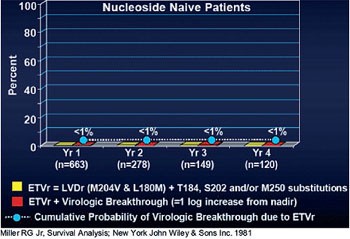
Abb. 3: Entecavir-Resistenz. 4-Jahres-Daten
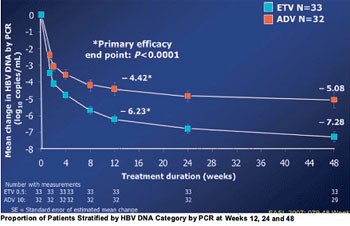
Abb. 4: Abfall der HBV-DNA unter Entecavir vs. Adefovir
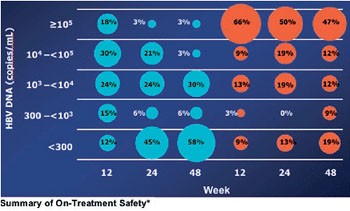
Abb. 5: Anteil der Patienten stratifiziert nach Viruslast
zu Woche 12, 24 und 48
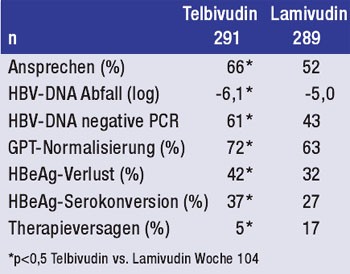
Tab. 2: Telbivudin vs. Lamivudin bei HBeAg-positiven
Patienten mit GPT >2x ULN
RIBIVARIN-DOSIERUNG NACH GFR?
Ribavirin wird derzeit nach dem Körpergewicht dosiert. Einer Studie des Bundes der niedergelassenen Gastroenterologen (bng) zufolge könnte die Dosierung nach der glomerulären Filtrationsrate (GFR) bei Patienten mit Genotyp 1 und 4 und eingeschränkter Nierenfunktion günstiger sein. In der Analyse korrelierte die GFR der Patienten (n=1.615) mit Geschlecht, Alter und HCV-Genotyp, nicht jedoch mit dem Körpergewicht oder Body Mass Index (BMI). Eine niedrige GFR (60-90 mL/min/1,73 m2) ging bei Genotyp 1 und 4 im Vergleich zu Patienten mit normaler GFR mit einer geringeren SVR-Rate einher (50% vs. 33%). Nebenwirkungen und Therapieabbrüche waren häufiger, die kumulative Ribavirin-Dosierung geringer. Die nicht optimale Ribavirin-Dosierung bei eingeschränkter Nierenfunktion könnte somit zu einer schlechteren Verträglichkeit, Dosisreduktion und dem schlechteren Outcome geführt haben (Abb. 2) (Zehnter E et al. #656).
HEPATITIS B
Bei der Indikation zur Therapie der Hepatitis B sollen sowohl die Viruslast als auch die entzündlichen Veränderungen berücksichtigt werden. Eine erhöhte GPT gilt als Zeichen einer erhöhten entzündlichen Aktivität mit Gefahr des Leberumbaus. Offenbar hat aber auch ein erheblicher Anteil von Patienten ohne erhöhte GPT bereits Leberschäden. In einer post-hoc-Analyse von zwei Phase-3-Studien an HBeAg-positiven wie -negativen Patienten mit einer GPT <2x ULN (Upper Limit of Norm) hatten bis zu 75% einen Knodell Score =7 und bis zu 17% einen Ishak Fibrosegrad =4 (Terrault N et al. #483).
INTERFERON PLUS NUKLEOSID?
PegIFN-2a hat bei HBeAg-negativen Patienten über 48 Wochen auch nach drei Jahren (n=315) mit oder ohne Lamivudin häufiger zu einem dauerhaften Therapieansprechen geführt als Lamivudin allein (HBV-DNA <400 Kopien/ml 18% vs. 13% vs. 6%, HBs Ag-Verlust 8 vs. 8 vs. 0) (Marcellin P et al. #53). Im Gegensatz dazu scheint die Kombination von pegIFN-2a mit Adefovir einen günstigeren Effekt zu haben als Interferon allein. In einer Untersuchung ebenfalls an HBeAg-negativen Patienten (n=60) war die Viruslast unter dieser Kombination nach 24 Wochen stärker gesunken (-4,5 vs. -2,78 log) und bei fast doppelt so vielen unter die Nachweisgrenze von 200 Kopien/ml (70,4% vs. 32%) (Piccolo P et al. #54).
ENTECAVIR: AUCH NACH 4-JAHRES-DATEN WENIGER ALS 1% RESISTENZ
Entecavir gilt als das Nukleosid mit der höchsten Resistenzbarriere. Dies bestätigen erneut die 4-Jahres-Daten. Bei 91% der 120 Nukleosid-naiven Patienten, die vier Jahre lang mit Entecavir behandelt wurden, lag die Viruslast <300 Kopien/ml. Lediglich 0,8% der Patienten hatten ein virologisches Versagen, definiert als Anstieg der Viruslast >1log (Abb. 3). Bei diesen wenigen Patienten gab es - sofern überhaupt Mutationen gefunden wurden - Hinweise darauf, dass es sich um bereits vor Therapiebeginn bestehende Veränderungen handelte.
PROBLEM: LAMIVUDIN-RESISTENZ
Um gegen Entecavir resistent zu werden, braucht das Hepatitis-B-Virus mindestens drei Mutationen, nämlich M204V und L180M plus entweder T184, S202 oder M250. Bei Patienten mit Lamivudin-Resistenz liegen die Mutationen M204V und L180M bereits vor, d.h. die Resistenzbarriere ist nicht so hoch wie bei den Nukleosid-naiven Patienten. Entsprechend geringer ist die Ansprechrate. Im vierten Jahr erreichten 47% der 43 Patienten dieser Gruppe die Grenze <300 Kopien/ml. Bei 39% der Lamivudin-resistenten Patienten war es zum virologischen Durchbruch gekommen, wobei alle Entecavir-resistenten Isolate auf Adefovir empfindlich reagierten (Colonno RJ et al. #781).
HCV-Resistenz: Neue Erkenntnisse
Ein klarer Nachteil der spezifischen antiviralen HCV-Therapie (STAT-C) ist die mögliche Resistenzentwicklung. HCV repliziert auf hohem Niveau, weitaus höher noch als HIV. Mutationen entstehen dabei auf natürliche Weise und können durch Medikamente selektiert werden. Die resistenten HCV-Varianten scheinen allerdings weniger fit zu sein und sich langsamer zu vermehren (Chu H-M et al. #609). Zudem werden sie (anders als bei HIV) nicht "archiviert", d.h. bei fehlendem Selektionsdruck könnte die Resistenz wieder verschwinden und das Medikament möglicherweise wieder wirksam sein. Es gibt allerdings bislang noch keine klinischen Daten darüber, wie lange es dauert, bis die Resistenz verschwindet und man ein Medikament wieder einsetzen kann.
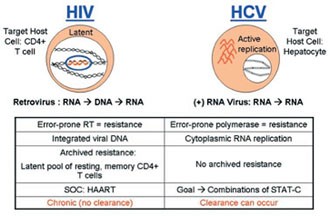
Nach Kieffer T et al., 42 EASL 2007
Erstmals wurde die HCV-Resistenz unter dem Proteasehemmer Telapravir beschrieben. Mittlerweile sind aber auch gegen die anderen, sich in der Entwicklung befindenden Proteasehemmer Resistenzmutationen beschrieben und es gibt Hinweise auf eine Kreuzresistenz.
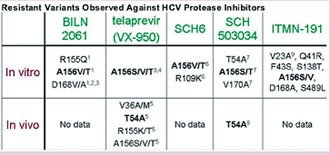
Nach Kieffer T et al., 42 EASL 2007
Die entscheidende Frage lautet somit, wie kann man die Resistenzentwicklung verhindern bzw. wie kann man sie überwinden, wenn sie aufgetreten ist. Eine Möglichkeit könnte die Kombination von verschiedenen Substanzklassen sein. Erste Untersuchungen zu solchen Kombinationen wurden bereits vorgestellt.
ENTECAVIR VS. ADEFOVIR
In einer kleinen Studie an HBeAg-positiven Patienten (n=69) war Entecavir Adefovir bereits von Tag 10 an überlegen. Nach 48 Wochen war die HBV-DNA unter Entevacir stärker gefallen (-7,28 vs. -5,08 log) und bei mehr Patienten <300 Kopien/ml (58% vs. 19%) (Leung N et al. #49) (Abb. 4/5).
TELBIVUDIN
Zu Telbivudin wurden insgesamt neun Arbeiten präsentiert, unter anderem die 2-Jahres-Daten der GLOBE-Studie. In dieser Untersuchung wurden 1.367 Patienten (921 HBeAg+ und 446 HBeAg-) mit Telbivudin bzw. Lamivudin behandelt. Nach 104 Wochen war Telbivudin bei den HBeAg-positiven Patienten mit Erhöhung der GPT >2x ULN (n=580) Lamivudin signifikant überlegen im Hinblick auf Therapieansprechen und antiviraler Wirksamkeit (Virus-last-Reduktion, PCR-Negativität, Resistenz und primäres Therapieversagen). Zudem kam es bei signifikant mehr Patienten zur HBeAg-Serokonversion und GPT-Normalisierung (Tab. 2) (Rasenack J et al. #513).
21 Telbivudin-Patienten in der GLOBE-Studie hatten ein virologisches Versagen. 16 davon wurden auf Adefovir umgestellt und fünf erhielten zusätzlich Adefovir. Nach 16 Wochen war die HBV-DNA in der ersten Gruppe um 3,8 log, in der zweiten um 5,1 log gefallen (Gane E et al. #493).
ABSETZEN NACH HBeAg-VERLUST
In einer französischen Untersuchung hatte rund ein Drittel der HBeAg-positiven Patienten nach einem Jahr die Option, die Therapie zu beenden, wenn HBeAg nicht mehr nachweisbar war und die Viruslast mehr als sechs Monate <5 log lag. 59/257 Patienten setzen die Medikation ab. Bei mehr als 80% dieser Patienten blieb der Zustand stabil. Bei den wenigen Patienten, die ein Rezidiv erlitten (meist innerhalb von sechs Monaten), konnte die Virämie in rund 90% der Fälle durch die erneute Behandlung wieder supprimiert werden (Poynard T et al. #58; Lai Cet al. #91).
ERFOLGREICHER SWITCH AUF TELBIVUDIN
Patienten, die auf Lamivudin nicht gut ansprechen, profitieren von einer Umstellung auf Telbivudin. In einer Studie wurden Patienten (n=146, HBeAg+ 81%) mit suboptimalem Ansprechen auf Lamivudin (HBV-DNA >3 log nach 6 Monaten) entweder weiterbehandelt oder auf Telbivudin umgestellt. 24 Wochen nach Umstellung war die Viruslastsenkung unter Telbivudin signifikant stärker (-1,9 log vs. 0,9 log) gesunken und lag bei mehr Patienten unter der Nachweisgrenze (40% vs. 31%) (Safadi R et al. #516).
HIV/HCV-KOINFEKTION
Viruslast und früheres Therapieansprechen scheinen auch bei HIV-Koinfizierten ein wichtiger Prädiktor zu sein. In der spanischen PRESCO-Studie wurden 389 Patienten (G1 49%, G2 <1%, G3 38% und G4 12%) mit Peg-IFN-2a plus 1.000-1.200 mg Ribavirin behandelt. Die Genotypen 1 und 4 wurden 48 bzw. 72 Wochen, die Genotypen 2 und 3 24 bzw. 48 Wochen behandelt.
Wichtigster Prädiktor für die SVR war der Abfall der Viruslast unter die Nachweisgrenze (20 IU/ml) vier Wochen nach Therapiebeginn (RVR vs Nicht-RVR): G1 69% vs 29%, G3 87% vs 57% und G4 83% vs 29%. Bei Genotyp 1 und 3 war eine Ausgangsviruslast <500.000 IU/ml ebenfalls ein günstiger Prädiktor für die SVR (G1: 69% vs. 34%, G3: 86% vs. 72%). Am besten schnitten Patienten mit einer Ausgangsviruslast <500.000 IU/ml und einer RVR ab. Hier erreichten alle Patienten die SVR.
Am schlechtesten war das Ergebnis bei Patienten mit Genotyp 1 und 4 und einer noch nachweisbaren Viruslast nach Woche vier. Hier lag die SVR unter 30% (Martin-Carbonero L et al. #616). RV










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
