GEORG BEHRENS, HANNOVER
Chronische Immunaktivierung Risikofaktor für CD4-Zellverlust, Aids und andere Erkrankungen?
Die chronische Immunaktivierung ist ein wichtiges Kennzeichen der progressiven HIV-Erkrankung. Bisher wurde als Ursache für die Immunaktivierung HIV selbst angenommen. Neure Untersuchungen zeigen, dass in der frühen Phase der Infektion die Translokation mikrobieller Produkte eine wichtige Rolle spielt. Die Ursachen der Immunaktivierung bei chronischer HIV-Infektion sind weniger klar. Die Surrogatmarker der Aktivierung, z.B. proinflammatorische Zytokine und D-Dimere, scheinen jedoch ein guter Prädiktor für die Erkrankungsprogredienz zu sein.
Die polyklonale B-Zellaktivierung wurde als eine der ersten immunologischen Veränderungen bei HIV-Patienten identifiziert. Auch über hohe Zahlen von T-Lymphozyten mit aktiviertem Phänotyp wurde schon in den ersten Publikationen über Patienten mit HIV-Infektion berichtet. Später zeigten Studien, dass HIV-Patienten einen vermehrten T-Zellumsatz und erhöhte Serumspiegel für proinflammatorische Zytokine und Chemokine haben. In den letzten Jahren haben wir neue Erkenntnisse über den Ort und den zeitlichen Verlauf von pathophysiologischen Phänomenen gewonnen, die zur chronischen Immunaktivierung bei HIV-Patienten beitragen.
FRÜHE SCHÄDEN AM DARM
Viele CD4+ T-Zellen befinden sich im Mukosa-assoziierten lymphatischen Gewebe, exprimieren zumeist CCR5 und werden den sogenannten Gedächtniszellen zugeordnet. Die massive Infektion und Depletion dieser CD4+CCR5+ Gedächtnis-T-Zellen ist eine zentrale Eigenschaft der SIV- und HIV-Infektion. In der Frühphase der SIV-Infektion, d.h. bereits wenige Tage nach der Infektion, sind bis zu 60% der CD4+ T-Zellen in der intestinalen Lamina propria infiziert und enthalten Virus-RNA. Die meisten der Zellen gehen kurze Zeit später durch direkte und indirekte Zerstörung endgültig verloren. Die Krankheitsprogression im weiteren Verlauf hängt nun offensichtlich davon ab, wie gut der Pool dieser Memory CD4+ T-Lymphozyten im lymphatischen Gewebe der Darmmukosa wieder hergestellt werden kann. Um den Schaden am Immunsystem zu begrenzen bzw. unter der Vorstellung einer besseren Erholung des Immunsystems unter einer Therapie, befürworten einige Forscher die frühe antivirale Behandlung im Rahmen einer akuten HIV-Infektion.
MIKROBIELLE PRODUKTE AKTIVIEREN IMMUNSYSTEM
Die frühe Beeinträchtigung der Barrierefunktion der mukosalen Immunität trägt zu einer systemischen Immunaktivierung in der chronischen Phase der HIV-Infektion bei. Möglicherweise kommt es über eine veränderte intestinale epitheliale Keimbesiedlung und gestörte antimikrobielle Funktion zu einer vermehrten Translokation von mikrobiellen Produkten aus dem Darmlumen in den Kreislauf und damit zur Immunaktivierung. Amerikanische Wissenschaftler beobachteten, dass chronisch infizierte HIV-Patienten und Aids-Patienten signifikant höhere Plasma-LPS (Lipopolysaccharid)-Spiegel hatten als nicht-infizierte Probanden. Als Quelle dieser Lipopolysaccharide im Plasma werden vor allem komensale (natürlich vorkommende) und pathogene Bakterien des Darms oder auch subklinische opportunistische Infektionen vermutet. Die Folge dieser mikrobiellen Translokation ist eine chronische Aktivierung der unspezifischen und spezifischen Immunantwort, erkennbar an den erhöhten Plasmaspiegeln für Interferon-a oder den vermehrten Aktivierungsmerkmalen von T-Zellen. Die antimikrobielle Beseitigung der Darmbakterien im Tierversuch an Rhesusmakaken nach SIV-Infektion führte zu einem deutlichen Abfall der LPS-Spiegel im Serum. Darüber hinaus fand sich eine signifikante Korrelation zwischen den Plasma-LPS-Spiegeln zu Beginn einer antiretroviralen Therapie und dem Anstieg der CD4+ Helferzellen 48 Wochen später. Je höher die LPS-Spiegel, desto niedriger war der Anstieg der Helferzellen. Außerdem wurden bei Patienten mit einer rascheren Progression der HIV-Infektion signifikant höhere Plasmaspiegel für mikrobielle Produkte nachgewiesen als bei seronegativen Kontrollpersonen oder HIV-Patienten, die die Infektion relativ gut kontrollieren. Die Autoren dieser Studien kommen zu dem Schluss, dass die Prävention oder Reduktion der Virusvermehrung in der Darmmukosa ein neuer sinnvoller Therapieansatz sein könnte. Auf diese Weise kann man möglicherweise die immunologische und epitheliale Integrität der mukosalen Barriere wieder herstellen und blockiert damit den zellulären und molekularen Weg der systemischen Immunaktivierung durch mikrobielle Produkte.
MEHR VULNERABLE ZELLEN
Die chronische Phase der HIV-Infektion dauert meist Jahre und ist charakterisiert durch einen langsamen, aber kontinuierlichen Abfall der CD4+ T-Helferzellzahlen im peripheren Blut, einer weitgehend konstanten Zahl infizierter CD4+ T-Lymphozyten und erhöhten Apoptoseraten von CD4+ und CD8+ T-Zellen. Besonders die vermehrte Apoptose wird als Ausdruck einer chronischen, generalisierten Immunaktivierung und als Ursache für den Abfall der Helferzellen angesehen. Diese Immunaktivierung (durch HIV und opportunistische Infektionen) bietet neues Substrat für HIV und virusinduzierten Zelluntergang. Sie konsumiert den Pool naiver und ruhender Gedächtniszellen bei gleichzeitiger Expansion kurzlebiger Effektor-T-Helferzellen und sie führt zu Störungen im Zellzyklus mit vermehrter aktivierungsinduzierter Apoptose.
Helferzellen sind offensichtlich besonders anfällig für diese Schädigungen. HIV kann infizierte Zellen direkt durch seine Hüllenproteine (env) oder durch Caspaseaktivierung (vpr) zerstören oder durch indirekte Effekte zwischen infizierten und nicht-infizierten Zellen (z.B. Fas-FasLigand) Apop-tose induzieren. Im Verlauf der unbehandelten HIV-Infektion ist parallel zum Abfall der CD4+ T-Zellen in der Regel ein Anstieg der Plasmavirämie zu beobachten. Im lymphatischen Gewebe entwickelt sich dabei als morphologisches Korrelat einer zunehmenden Immundefizienz an Stelle der follikulären Hyperplasie eine zunehmende Auflösung des Netzwerkes follikulärer dendritischer Zellen und eine progrediente Fibrose - alles Zeichen einer chronischen Inflammation.
Hypothese zur Pathogenese der HIV-Infektion und chronischen Immunaktivierung
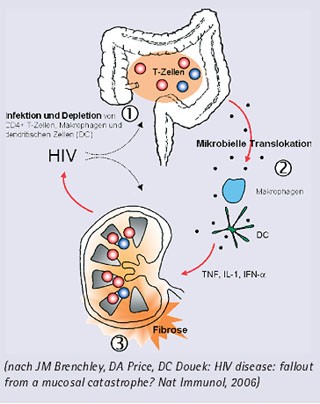
Die akute HIV-Infektion zerstört die Mehrzahl der mukosalen CD4+ T-Lymphozyten?, was zu einer Störung der Schleimhautbarriere und vermehrten Translokation bakterieller Produkte aus dem Darmlumen führt2. Dies führt zu einer Stimulation und Expansion von T-Zellen im Lymphknoten, wodurch sich das Substrat für die HIV-Replikation weiter vermehrt. Als Folge entwickelt sich eine Fibrose3 und Störung der Lymphknotenarchitektur mit Störungen der T-Zellhomeostase und Regenerationskapazität von CD4+ T-Lymphozyten, die wiederum ein wichtiges Substrat für die HIV-Replikation sind.
SMART: THERAPIEPAUSEN SCHADEN
In der SMART-Studie, die zwei Therapiestrategien (kontinuierliche Therapie versus Therapieunterbrechungen) bei fast 5.500 HIV-Infizierten untersuchte, war das Risiko für Nicht-Aids-typische Krankheiten bei Therapieunterbrechungen signifikant erhöht. Das Risiko zu sterben war für Patienten mit Therapiepausen um das 1,8-Fache erhöht. An Kreislauf-, Nieren-, Herz- oder Lebererkrankungen erkrankten 65 HIV-Infizierte mit Therapieunterbrechungen, aber nur 39 Patienten, die kontinuierlich ihre Medikamente einnahmen. Somit war auch das Risiko einer Herz-, Kreislauf-, Nieren- oder Lebererkrankung durch die Therapiepausen um das 1,7-Fache erhöht. Insgesamt war in der Studie die Prävalenz von schwerwiegenden Nicht-Aids-definierenden Ereignissen bei hohen Helferzellezahlen mindestens dreimal so hoch, wie die der Aids-definierenden Erkrankungen. Dabei hatte man ursprünglich erwartet, dass Therapieunterbrechungen die unerwünschten Wirkungen sowie die langfristig negativen Auswirkungen der Medikamente verhindern.
MEHR EREIGNISSE BEI IMMUNAKTIVIERUNG
Weitere Analysen der Studiendaten gingen der Frage nach, ob die Therapie der HIV-Infektion einen günstigen Einfluss auf die Inflammation und Aktivierung des Gerinnungssystems hat. Hierzu wurden unter anderem die D-Dimere bestimmt, die als Abbauprodukt des Fibrins eine Gerinnungsaktivierung anzeigen. Unbehandelte Patienten hatten zu Beginn der Studie signifikant höhere D-Dimere als behandelte Patienten. Bei zuvor unbehandelten Patienten fielen die D-Dimere signifikant ab, wenn eine kontinuierliche HIV-Therapie begonnen wurde. Bei Patienten, die eine zuvor begonnene HIV-Therapie pausierten, stiegen D-Dimere und Interleukin-6 an. Dieser Anstieg korrelierte direkt mit der Höhe bzw. dem Anstieg der Viruslast. Patienten mit D-Dimeren im Bereich der oberen Quartile zu Beginn von SMART hatten ein 12-fach höheres Risiko für ein tödliches Ereignis, als Patienten mit D-Dimeren in der untersten Quartile, selbst wenn statistisch für andere Variablen adjustiert wurde. "Surrogatmarker" einer Immunaktivierung, wie z.B. D-Dimere und IL-6, könnten somit den potentiellen Nutzen einer frühen HIV-Therapie anzeigen.
Für unbehandelte HIV-Patienten mit Helferzellzahlen von 400-500/µl ist es derzeit völlig unklar, ob das Morbiditäts- und Mortalitätsrisiko für Nicht-Aids-definierende Erkrankungen durch die HIV-Replikation und chronische Immunstimulation erhöht ist und ob es durch eine antiretrovirale Therapie gesenkt werden kann. Insbesondere ist es unklar, ob die Ergebnisse der SMART-Studie auf alle unbehandelten Patienten übertragen werden können. Deshalb wird mit der "Strategic Timing of AntiRetroviral Treatment" (START)-Studie der Versuch unternommen, Licht ins Dunkel zu bringen und die Risiko-Nutzen Bewertung einer früheren Therapieeinleitung im Hinblick auf harte klinische Endpunkte darzustellen. Die Überlegungen zur chronischen Immunaktivierung sind eine der Argumentation für diese Studie.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
