JOHANNES BOGNER, MÜNCHEN
Raltegravir in der klinischen Anwendung
Raltegravir ist der erste Vertreter der neuen Klasse der Integrasehemmer. Die Substanz zeigt keine Kreuzresistenz mit den herkömmlichen Substanzklassen und war in Studien bei vorbehandelten wie therapienaiven Patienten gut wirksam. Unabhängig davon hat Raltegravir Eigenschaften, die für einen besonderen Stellenwert des Integraseinhibitors sorgen werden, nämlich die gute Verträglichkeit und die große therapeutische Breite sowie der rasche Abfall der Viruslast. Dies macht Raltegravir für den frühen Einsatz attraktiv. Derzeit ist das Medikament allerdings nur zum Einsatz bei vorbehandelten Patienten zugelassen.
Raltegravir ist in Europa zur Behandlung von erwachsenen Patienten mit HIV-Infektion zugelassen, wenn trotz antiretroviraler Therapie eine erhöhte Plasma-Viruslast als Indikator eines virologischen Therapieversagens vorliegt. Damit ist die Zulassung durch die entsprechende Behörde nicht auf Patienten mit Multiresistenz eingeschränkt. Es können lege artis Patienten ab dem ersten virologischen Therapieversagen behandelt werden.
Erfahrungen und Empfehlungen zur Anwendung in der Schwangerschaft liegen noch nicht vor. Raltegravir passiert die Placentaschranke. Für Kinder liegen bislang ebenfalls keine Studien, keine Zulassung und keine Dosisempfehlung vor.
WIRKMECHANISMUS
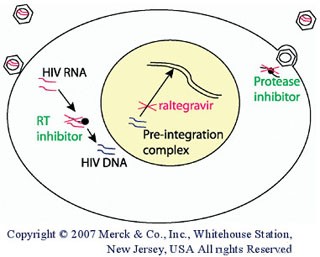
Abb. 1: Integrasehemmer haben einen neuen Angriffspunkt bei der HIV-Replikation: Sie inhibieren die Integration der HIV-DANN
Die Integrase ist ein Enzym, das für HIV spezifisch ist(1). Integrasehemmer inhibieren den Einbau proviraler HIV-DNA innerhalb des Zellkerns in die DNA der Wirtszelle (Abb. 1). Damit greifen die Integrasehemmer erst nach der Virusaufnahme in die Zelle (hier wirken Attachment-Inhibitoren und Fusionsinhibitoren) und nach der reversen Transskription (hier wirken Nukleoside und NNRTI) und nach Bildung des sogenannten Prä-Integrations DNA-Komplexes in die HIV-Replikation ein.
Die Wirkung der HIV-Integrase verläuft in mehreren Schritten(2). Zunächst kommt es im Zytoplasma zur Bindung der Integrase an Virus-DNA. Dadurch entsteht ein stabiler Prä-Integrationskomplex. Anschließend durchtrennt die Integrase je zwei Nukleotide an den Enden der Virus-DNA. Es entstehen neue Enden am Prä-Integrationskomplex. In einem dritten Schritt wird die HIV-DNA in den Zellkern eingeschleust und nach Bindung der Integrase in die Wirts-DNA eingebaut. Genau dieser Strangtransfer genannte Schritt wird durch Raltegravir gehemmt.
Danach kann die Virusvermehrung nur voranschreiten, wenn neue Messenger-RNA als Matrize für die Proteinbildung gebildet wird. Die Wirkung von Proteaseinhibitoren setzt im Vergleich dazu später ein, nachdem auf einen Aktivierungsreiz aus dem Zellkern hin erneut Messenger-RNA zur Translation und ein Vorläuferprotein gebildet werden.
Pharmakologische Eckdaten
Die normale Tagesdosis von Raltegravir beträgt 800 mg. Sie wird aufgeteilt in die 12stündliche Einnahme je einer Tablette 400 mg Raltegravir (3;3). Die Absorption über den Darm ist gut. Daten zur absoluten Bioverfügbarkeit fehlen allerdings noch. Maximale Plasmaspiegel werden drei Stunden nach Einnahme erreicht, wenn die Medikation nüchtern eingenommen wird.
Der steady state stellt sich bei zweimal täglicher Gabe nach wenigen Tagen ein. Es kommt weder zur Akkumulation noch zum Anstieg der Dosis-Zeit-Beziehung noch der Maximalspiegel. Durch die gleichzeitige Anwendung von Protonenpumpeninhibitoren oder anderen Substanzen, die die Magensäure neutralisieren, wird die Resorption von Raltegravir erhöht. Die Fläche unter der Kurve (AUC) kann dabei 3fach erhöht sein. Wegen der hohen therapeutischen Breite von Raltegravir ist jedoch keine Dosisänderung erforderlich.
Die hohe therapeutische Breite von Raltegravir zeigt sich auch durch die erhebliche interindividuelle Schwankung der Plasmaspiegeln ohne vermehrte Nebenwirkungsrate. Der Variationskoeffizient der Spiegel zwischen Studienteilnehmern der BENCHMRK-Studien beispielsweise betrug 212%. Die intraindividuelle Schwankungsbreite lag bei 122%.
WIRKUNG IN VITRO
In der Zellkultur entfaltet Raltegravir eine starke Wirkung bereits in sehr niedrigen Konzentrationen von im Mittel 33 nM ± 23 nM(3). Es ist virologisch aktiv gegen HIV mit Multiresistenz gegen herkömmliche Substanzen und es wirkt sowohl gegen Viren, die den CCR5-Tropismus besitzen, als auch gegen Viren, die den CXCR4-Rezeptor benutzen. In der Praxis ist somit vor der Anwendung von Raltegravir kein Tropismus-Test erforderlich. Virologische Untersuchungen zeigen ferner, dass Viren, die eine Resistenz gegen Raltegravir entwickeln, empfindlich bleiben gegenüber den herkömmlichen antiviralen Substanzklassen.
KLINISCHE STUDIEN
Die Phase-II-Dosisfindungsstudien mit Raltegravir an Patienten mit multiplen Resistenzen zeigen eine starke antivirale Wirkung und eine Überlegenheit der zweimal täglichen Anwendung gegenüber der einmal täglichen Gabe. Den Beweis der Wirksamkeit erbrachten zwei große Phase-III-Zulassungsstudien unter dem Akronym BENCHMRK (Protokolle 018 und 019)(2, 4). Die Zulassung von Raltegravir stützt sich auf 24-Wochen-Daten dieser beiden, aktuell noch laufenden, randomisierten und placebokontrollierten Studien. Des weiteren wurden die 48-Wochen-Daten aus Protokoll 005 veröffentlicht, einer Studie an therapienaiven Patienten, die ebenfalls eine klinische Überlegenheit zeigen.
ResistenzWie bei jeder antiretroviralen Substanz entstehen auch bei Raltegravir in der Monotherapie sowie in Kombination mit unzureichend wirksamen Partnern Resistenzmutationen. Raltegravir gehört zu den Substanzen mit einer relativ niedrigen genetischen Barriere(3). Derzeit sind zwei Resistenzpfade bekannt und zwar über Mutationen des Integrase-Gens an den Positionen 148 (zusammen mit Positionen 138 und 140) und 155 (zusammen mit Positionen 74, 92 oder 97). Die zusätzlichen Mutationen erhöhten die Resistenz. So erhöht die Mutation Q148H in Verbindung mit G140S die "fold change" etwa auf das 500fache. Zwischen Integraseinhibitoren mit demselben Wirkmechanismus (Stranginhibition) scheint eine Kreuzresistenz zu bestehen. Die genotypische Analyse der Integrase-Resistenz kann bereits in einigen HIV-Labors bestimmt werden. Sie ist derzeit noch keine Leistung der gesetzlichen Krankenkassen. Einige Labore bieten die Untersuchung jedoch kostenfrei an. BU: Struktur der HIV-Integrase nach De Clercq E Nat Rev Drug Discov 2007  |
Genotypischer Resistenztest für Integrase-Gen
|
PATIENTEN MIT MULTIRESISTENZ
In den BENCHMRK-Studien 1 und 2 wurde die zweimal tägliche Gabe von Raltegravir 400 mg in Kombination mit einer optimierten Background-Therapie (OBT) geprüft im Vergleich zu Placebo plus OBT. Eingeschlossen wurden vorbehandelte Patienten mit mindestens einer Resistenzmutation in jeder der drei gebräuchlichen antiviralen Klassen (RTI, NNRTI und PI). Die Auswahl der OBT erfolgte nach dem Screening und vor der Randomisierung aufgrund der Ergebnisse eines genotypischen/phänotypischen Resistenztests im Zusammenhang mit der Vorbehandlung. Die Ergebnisse der beiden Studien wurden zusammen analysiert. Die gepoolte Analyse beinhaltet die Daten von 462 Patienten in der Raltegravir-Gruppe und 237 in der Placebogruppe. Etwa 12% der Studienteilnehmer waren weiblich. Das mittlere Alter von 45 Jahren zeigt, dass es sich um Patienten mit langer Vortherapie handelt(4). Die mittlere CD4-Zahl war bei Beginn mit 119 Zellen/µl niedrig, die Viruslast (VL) mit 4,8 log10 relativ hoch. 35% der Patienten hatten zu Beginn eine VL über 100.000 K/ml, 92% waren im Vollbild AIDS und die mittlere Vorbehandlung lag bei 10 Jahren und 12 verschiedenen Substanzen. Etwa 16% der Patienten hatten eine Hepatitis B oder C Ko-Infektion.
Zu Woche 24 (286 Raltegravir-Patienten vs. 150 Placebo-Patienten) hatten 75,5% der Patienten unter Raltegravir eine Viruslast <400 K/ml im Vergleich zu nur 39,3% in der Placebogruppe. Ähnlich deutlich fiel der Unterschied für die Nachweisgrenze von <50 K/ml aus: 62,6% vs. 33,3%) (Abb. 2). Dementsprechend war die Häufigkeit eines virologischen Therapieversagens unter Raltegravir signifikant seltener (16% gegenüber 51,1%). Die mittlere Abnahme der Viruslast betrug 1,85 log-Stufen bei Raltegravir und 0,84 im Vergleichskollektiv. Der CD4-Zellanstieg war mit 89 Zellen/µl unter Raltegravir fast dreimal so hoch wie im Placeboarm (35/µl).
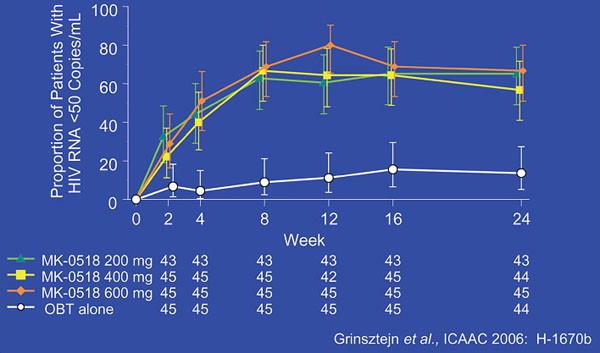
Abb. 2: % Patienten (95% CI) mit HIV RNA <50 Kopien/ml (NC = F)
INITIALTHERAPIE
Zum Einsatz von Raltegravir in der ersten Therapie wurde ebenfalls eine doppelblinde und randomisierte Studie durchgeführt(5). 160 der 198 therapienaiven Studienteilnehmer erhielten Raltegravir plus Emtricitabin/Tenofovir und 38 Efavirenz plus Emtricitabin/Tenofovir. Raltegravir wurde in den Dosierungen 100, 200, 400 und 600 mg zweimal täglich eingesetzt. In der frühen Therapiephase nach 2, 4 und 8 Wochen hatten mehr Patienten unter Raltegravir (und zwar in allen Dosisgruppen) eine nicht nachweisbarer Viruslast als in der Efavirenzgruppe. Knapp 90% aller Patienten erreichten nach 48 Wochen eine Viruslast unter 50 K/ml. In der auf Nicht-Unterlegenheit angelegten Studie erreichte Raltegravir das gesetzte Ziel. Bis zum Zeitpunkt der 48 Wochen-Analyse bestand keine Unterlegenheit gegenüber dem Efavirenz-haltigen Vergleichsregime(5) (Abb. 3).
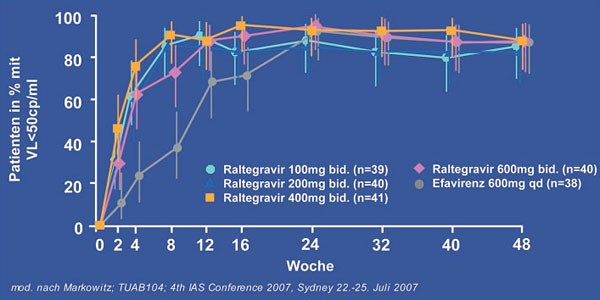
Abb. 3: Vergleichbare antivirale Wirksamkeit von RAL+TDF+3TC und EFV+TDF+3TC nach 48 Wochen
BESONDERHEIT: GUTE VERTRÄGLICHKEIT
Die Informationen zu Sicherheit und Verträglichkeit von Raltegravir stammen aus klinischen Prüfungen sowie aus den verfügbaren Daten der den beiden großen Zulassungsstudien BENCHMRK 1 und 2 und Protokoll 005 (Studie an therapienaiven Patienten). Insgesamt wurde festgestellt, dass Raltegravir keine eigenen substanzspezifischen Nebenwirkungen hat. Die am häufigsten genannten Nebenwirkungen waren unter Raltegravir (332 Patientenjahre) statistisch gleich häufig wie in den Vergleichsgruppen und die Häufigkeit von Nebenwirkungen unterschied sich in keinem Punkt von der in den jeweiligen Placebogruppen(4;6). Schwerwiegende Nebenwirkungen waren unter Raltegravir sogar tendentiell etwas seltener als in der Vergleichsgruppe: Diarrhoe (3,7% vs. 4,6%), Übelkeit (2,2% vs. 4,6%) und Kopfschmerz (2,4% vs. 1,4%). Ähnlich sieht es bei den Veränderungen der Laborwerte aus. Bezüglich Blutbild, Leberwerten und Stoffwechselparametern gibt es keinen Hinweis auf substanzspezifische Nebenwirkungen.
In den Untersuchungen wurden zwei unerwünschte Ereignisse einer Hypersensitivitätsreaktion von den Studienärzten mit Raltegravir in Verbindung gebracht. Die Therapie mit Raltegravir konnte jedoch nach Pausieren des Medikaments erfolgreich weitergeführt werden.
Zur Lebertoxizität liegen Erfahrungen aus den BENCHMRK-Studien vor. Patienten mit chronischer Hepatitis B und C konnten an der Studie teilnehmen, wenn die Leberwerte um weniger als das Fünffache der Norm erhöht waren. Die Transaminasen stiegen bei den Koinfizierten sowohl unter Raltegravir als auch in der Vergleichsgruppe häufiger an als bei Patienten ohne Hepatitis. Etwa ein Viertel der Patienten mit Hepatitis-Koinfektion zeigte solch einen Anstieg verglichen mit 9% bei Patienten ohne Hepatitis. Das Sicherheitsprofil von Raltegravir war somit bei Patienten mit chronischer Hepatitis nicht schlechter als bei den Patienten, die "nur" eine optimierte ART erhielten(7).
BESONDERHEIT: RASCHERER VIRUSABFALL
Bereits eine erste Monotherapie-Pilotstudie zeigt nicht nur einen starken, sondern auch einen raschen Abfall der Viruslast(8). Raltegravir hatte die Viruslast am Tag 10 um 2,2 log10 K/ml reduziert (Protokoll 004). Die mittlere Halbwertszeit der Viren in der ersten Phase des raschen Viruslast-Abfalls betrug 1,2 Tage und der mittlere Viruslastabfall war in den Raltegravir-Gruppen von 58.350 K/ml auf 98 K/ml stärker ausgeprägt als im Vergleich mit Efavirenz (von 70.200 auf 537 K/ml).
Die Daten aus der Studie an therapienaiven Patienten, in der Raltegravir in Dosierungen von 100, 200, 400 und 600 mg zweimal täglich gegeben wurde, zeigen ebenfalls unter Raltegravir einen deutlich rascheren Abfall der Viruslast als unter Efavirenz (Abb. 4). Dies gab Anlass zu neuen Hypothesen, auf welche Weise es zur Abnahme der Viruskonzentrationen in den verschiedenen Phasen und Kompartimenten kommt(8).
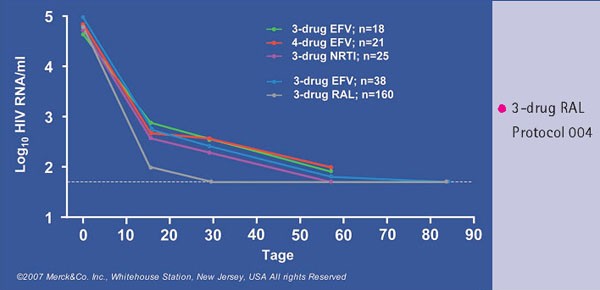
Abb. 4: Protokoll 004. Mehr Patienten unter einem Raltegravir-haltigen Regime erreichen zu Woche 2, 4 und
8 eine Viruslast < 50 K/ml
BESONDERHEIT: WENIG INTERAKTIONEN
Raltegravir wird vorwiegend durch Glucuronidierung in der Leber, d.h. über das Enzymsystem Uridin-Diphosphat-Glukuronosyltransferase (UGT) 1A1 abgebaut(6,7,9). Der Integrasehemmer hat daher keinen relevanten Einfluss auf das Cytochrom-System CYP3A4. Interaktionen mit Proteaseinhibitoren und NNRTIs, mit anderen antiviralen Substanzen sowie anderen Antiinfektiva (Pilzmittel, Antibiotika der Makrolid-Reihe usw.) sind nicht zu erwarten. Die Notwendigkeit des "Boosterns" wie bei den Proteaseinhibitoren entfällt(3).
In Kombination mit sehr starken Induktoren des UGT1A1 (z.B. Rifampicin) kann eine Reduktion der Plasmaspiegel von Raltegravir erfolgen. Im individuellen Fall sollten dann Therapiealternativen (z.B. Rifabutin) überdacht werden oder Plasmaspiegelbestimmungen beider Substanzen vorgenommen werden(3).
RALTEGRAVIR IN ERADIKATIONSKONZEPTEN
Aus den genannten Eigenschaften (rasche Viruslastsenkung, Verhindern des Entstehens von latent infizierten Zellen, gute Kombinierbarkeit) ergibt sich, dass Raltegravir ein idealer Kombinationspartner in Eradikationskonzepten ist. Die Integrationshemmung ist ein wichtiger Bestandteil bei dem Versuch, das Reservoir von latent infizierten Zellen zu dezimieren.
In New York am Aaron Diamond AIDS Research Center (ADARC) wird derzeit eine Studie geplant, bei der Patienten mit symptomatischer primärer HIV-Infektion entweder eine 5fach-Kombination (PI/r, 2NRTI, RAL, MVC) oder eine klassische 3fach-Kombination (PI/r + 2NRTI) erhalten. Endpunkte sind unter anderem die virologische Überlegenheit und die Reduktion der proviralen DNA. Ähnliche Konzepte könnten hierzulande für chronisch Infizierte als Studie Wirklichkeit werden.
Literatur
1 .Wong JK, Lampiris H. Covering all the bases: targeting HIV-1 integrase. J Acquir Immune Defic Syndr 2006; 43(5):507-508.
2. Lataillade M, Kozal MJ. The hunt for HIV-1 integrase inhibitors. AIDS Patient Care STDS 2006; 20(7):489-501.
3. MERCK & CO. IWSN0U. Isentress: Prescribing Information. U S 2007.
4. Grinsztejn B, Nguyen BY, Katlama C et al. Safety and efficacy of the HIV-1 integrase inhibitor raltegravir (MK-0518) in treatment-experienced patients with multidrug-resistant virus: a phase II randomised controlled trial. Lancet 2007; 369(9569):1261-1269.
5. Markowitz M, Nguyen BY, Gotuzzo E et al. Rapid and durable antiretroviral effect of the HIV-1 Integrase inhibitor raltegravir as part of combination therapy in treatment-naive patients with HIV-1 infection: results of a 48-week controlled study. J Acquir Immune Defic Syndr 2007; 46(2):125-133.
6. Iwamoto M, Wenning L, Petry A et al. Safety, Tolerability, and Pharmacokinetics of Raltegravir After Single and Multiple Doses in Healthy Subjects. Mol Ther 2008; 83(2):293-299.
7. Kassahun K, McIntosh I, Cui D et al. Metabolism and disposition in humans of raltegravir (MK-0518), an anti-AIDS drug targeting the human immunodeficiency virus 1 integrase enzyme. Drug Metab Dispos 2007; 35(9):1657-1663.
8. Murray JM, Emery S, Kelleher AD et al. Antiretroviral therapy with the integrase inhibitor raltegravir alters decay kinetics of HIV, significantly reducing the second phase. AIDS 2007; 21(17):2315-2321.
9. Monteagudo E, Pesci S, Taliani M et al. Studies of metabolism and disposition of potent human immunodeficiency virus (HIV) integrase inhibitors using 19F-NMR spectroscopy. Xenobiotica 2007; 37(9):1000-1012.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
