CHRISTIAN HOFFMANN, HAMBURG
Opportunistische Infektionen -
Teil 4 - Kryptokokkose
Infektionen durch den Hefepilz Cryptococcus neoformans sind gefürchtet, wenn auch in Europa relativ selten. In den USA, Afrika und in Südostasien sind sie sehr viel häufiger und gehören weltweit zu den wichtigsten AIDS-definierenden Erkrankungen. Unbehandelt verläuft die Kryptokokkose letal. Die Therapie ist kompliziert, langwierig und nur stationär zu empfehlen. Rezidive waren in der prä-HAART-Ära häufiger (mindestens 15%) als heute. Die Prognose hat sich deutlich verbessert - allerdings bei gleich bleibender Frühmortalität.
Cryptococcus neoformans wird überwiegend per Inhalation übertragen. Vogelkot ist ein wichtiges Erregerreservoir. Wichtigster Manifestationsort neben der Lunge ist, nach hämatogener Streuung, das ZNS. Allerdings kommen auch isolierte Hautmanifestationen und Lymphadenitiden vor. Die Kryptokokkose tritt fast immer bei massiver Immunschwäche auf. In einer Fallsammlung von 114 Patienten in Deutschland hatten 87% weniger als 100 CD4-Zellen/µl, der Median lag bei 30/µl. Die Kryptokokkose wird außerdem relativ häufig im Rahmen eines Immunrekonstitutionssyndroms gesehen.
KLINIK
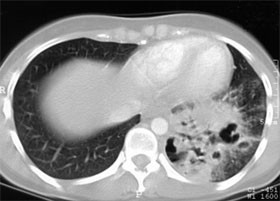
Abb. 1: CT-Thorax, pulmonale Kryptokokkose
Die ZNS-Manifestation mit einem enzephalitischen Bild ist am häufigsten (ca. 80%). Die Patienten klagen vor allem über Kopfschmerzen und Fieber. Die ebenfalls häufigen Bewusstseinsstörungen (Verwirrung) nehmen oft im Laufe weniger Tage rasch zu. Mitunter bestehen Gang-, Hör- oder Visusstörungen sowie Paresen, vor allem der Hirnnerven - fast immer ist der Hirndruck erhöht. Eine meningeale Reizsymptomatik fehlt dagegen üblicherweise. Im Rahmen eines IRIS ist die Klinik oft untypisch.
Bei pulmonalem Befall bestehen Symptome einer atypischen Pneumonie mit unproduktivem Husten und Brustschmerzen. Kutane Läsionen können anfangs wie Mollusca contagiosa aussehen, die später zu größeren ulzerativen Läsionen konfluieren. Andere Organbeteiligungen mit Befall des Urogenital- oder Gastrointestinaltrakts sind eher selten.
Fallbeispiel Klinik
Eine 34jährige thailändische Patientin wird mit einer neu vom Hausarzt diagnostizierten HIV-Infektion überwiesen. Die Patientin ist seit einigen Monaten in Deutschland. Sie klagt über seit mindestens 4 Wochen bestehenden Husten, leichte Schmerzen beim Atmen, Gewichtsabnahme von 8 kg, das aktuelle Körpergewicht liegt bei 42 kg (157 cm). Auskultatorisch ist kein pathologischer Befund zu erheben, auch neurologisch finden sich keine Auffälligkeiten. Es besteht allerdings ein deutlicher Mundsoor. Unter dem initialen Verdacht auf eine PCP wird die Patientin stationär aufgenommen.
DIAGNOSTIK
Eine Kryptokokkose ist lebensgefährlich, die Mortalität bei HIV-Patienten wird in der Literatur mit 6 bis 25% angegeben. Es sollte keine Zeit vertan werden: bei jedem Verdacht (zum Beispiel positiver Kryptokokken-Antigen-Test) müssen vor allem Lunge und ZNS zügig untersucht werden. Im Röntgen-Thorax sieht man allerdings oft nicht viel, weshalb bei Verdacht auf pulmonalen Befall unbedingt ein HR-CT gemacht werden sollte. Das bildmorphologische Spektrum der Läsionen ist vielfältig: Verstreute, kleine Herde wie bei Tuberkulose sind möglich, ebenso scharf abgrenzbare Infiltrate, die eher an eine Bronchopneumonie erinnern. Kavernen-Bildungen, auch Bronchiektasen kommen vor. Es sollte daher auf jeden Fall versucht werden, den Erreger über eine BAL eindeutig zu identifizieren.
Bei neurologischen Symptomen sollte immer ein MRT des Kopfes gemacht werden. Im Gegensatz zur Toxoplasmose und zum zerebralen Lymphom ist es allerdings oft unauffällig, und einzelne oder multiple Massenläsionen (Kryptokokkome) sind selten. Dennoch ist der Hirndruck bei den Patienten oft erhöht (Funduskopie: Papillenödem?).
Wichtigste Untersuchung bei der Kryptokokkose ist die Liquorpunktion (nach Funduskopie und MRT!). Meist besteht eine Pleozytose, die Glucose ist erniedrigt, das Eiweiß erhöht. Die Liquorpunktion bringt mit einem Tuschepräparat oder mittels Kultur in vielen Fällen die Diagnose. Auch bei pulmonaler oder anderer Lokalisation muss der Liquor untersucht werden, um einen ZNS-Befall auszuschließen. Cryptococcus-Antigen im Blut (Titer >1:8) sowie die Blutkultur sind wichtige Parameter und sollten immer bestimmt werden. Bei kutanem Befall wird die Diagnose zumeist nur bioptisch gestellt.
FALLBEISPIEL DIAGNOSTIK:
Die Eingangsuntersuchung ergibt bei der Patientin einen fortgeschrittenen Immundefekt von 60 CD4-Zellen/µl (8%), die Viruslast liegt bei 108.000 Kopien/ml. Das CRP ist deutlich erhöht (60 mg/l), das Hämoglobin erniedrigt (8,4 g/dl). Die LDH ist normal. Im infektiologischen Screening findet sich ein positives Kryptokokken-Antigen im Serum. Ein MRT des Kopfes ist unauffällig, ebenso eine Funduskopie. In einem HR-CT der Lunge finden sich dagegen ausgedehnte Läsionen links basal (siehe Abbildung). In der daraufhin veranlassten bronchoalveolären Lavage wird C. neoformans mikroskopisch nachgewiesen, wie auch in einer Liquoruntersuchung.
THERAPIE
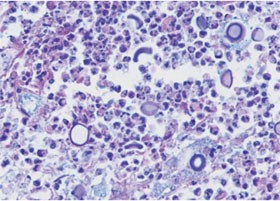
Abb. 2: Histopathologisches Bild. Pulmonale Kryptokokkose bei immungeschwächtem Patienten. Alcian blau-PAS Färbung
Bei der Meningitis ist akut eine Kombination aus mehreren Antimykotika erforderlich. Die Kombination verhindert Resistenzen und erlaubt eine Verkürzung der Akuttherapie auf vier bis sechs Wochen. Welche Kombination verwendet werden soll, ist nicht eindeutig geklärt. In Deutschland wird bei Meningitis oft eine Kombination mit den drei Antimykotika Amphotericin B, Flucytosin und Fluconazol eingesetzt. Die Raten für eine Vollremission bei Meningitis liegen unter der Dreifachtherapie bei etwa 80% und damit möglicherweise etwas höher als unter der in den USA bevorzugten Duotherapie mit Amphotericin B und Flucytosin. Neuere Daten lassen jedoch Zweifel an der Überlegenheit der Dreifachtherapie aufkommen. So war in einer kleinen, randomisierten Studie aus Thailand an 64 Patienten die Kombination aus Amphotericin B und Flucytosin am effektivsten - gemessen an der Kryptokokken-Clearance im Liquor. Sie war sogar signifikant besser als die Dreifachtherapie oder auch Amphotericin B und Fluconazol.
Dennoch: Angesichts der Toxizität von Flucytosin (das es überdies in Deutschland nur noch als Infusion und nicht mehr in Tablettenform gibt) favorisieren wir die Kombination aus Amphotericin B und Fluconazol. Wir fangen außerdem noch während der Akuttherapie bei den fast immer unbehandelten Patienten mit einer antiretroviralen Therapie an.
Liposomales Amphotericin (Ambisome®) ist - abgesehen von einer deutlich geringeren Toxizität - wahrscheinlich etwas wirkungsvoller als konventionelles Amphotericin B. Die Therapie ist jedoch auch bei Ambisome®-haltigen Kombinationen sehr toxisch. Tägliche Kontrollen von Nieren- und Leberwerten, Blutbild und Elektrolyten sind zu empfehlen. Fluconazol sollte insbesondere bei verwirrten Patienten als Infusion gegeben werden.
Bei isoliert pulmonalem Befall (Liquor negativ!) oder anderen extrazerebralen Manifestationen behandeln wir ebenfalls ohne Flucytosin und beenden die Akuttherapie mit Amphotericin B und Fluconazol schon nach zwei statt nach vier Wochen. Einen positiven Kryptokokken-Antigen-Test ohne Nachweis für ZNS-, Lungen- oder andere Infektion würden wir nur mit Fluconazol behandeln.
Der Therapieerfolg wird durch Klinik und wiederholte Lumbalpunktionen überwacht. Nach zwei Wochen ist der Liquor in rund 60% der Fälle negativ. Ist dies der Fall, frühestens aber nach vier Wochen, kann auf eine Erhaltungstherapie umgestellt werden. Bei erhöhtem Hirndruck kann eine Liquordrainage notwendig werden, Steroide haben hier keinen Effekt.
Fallbeispiel Therapie
| Therapie/Prophylaxe der Kryptokokkose, zur Applikation und Dosierung siehe auch die Fachinformationen | |
|---|---|
| Akuttherapie | Dauer: Immer mindestens 4-6 Wochen |
| Therapie der Wahl | Amphotericin B + Flucytosin* + Fluconazol |
| Erhaltungstherapie | Absetzen ab >200 CD4-Zellen/µl >6 Monate mgl. |
| Therapie der Wahl | Fluconazol |
| Alternative | Itraconazol |
| Primär-Prophylaxe | Nicht empfohlen |
| * Anmerkung: Wir lassen das Flucytosin meist weg. Stattdessen fangen wir noch während der Akuttherapie bei den fast immer unbehandelten Patienten mit einer antiretroviralen Therapie an. | |
Die Patientin erhält eine Therapie aus Ambisome® und Fluconazol. Nach 10 Tagen wird zusätzlich eine antiretrovirale Therapie mit Tenofovir, FTC und Efavirenz begonnen (angesichts möglicher Interaktionen wird kein geboosterter PI verwendet, wegen der Anämie wird auf AZT, wegen des Fiebers auch auf Abacavir verzichtet - eine HLA-Typisierung ist zu diesem Zeitpunkt noch nicht möglich). Unter der Kombination aus Ambisome® und Tenofovir entwickelt die Patientin innerhalb von zwei Wochen ein akutes Nierenversagen, das vorübergehend den Einsatz einer Dialyse erfordert. Nach Ersatz von Tenofovir durch Stavudin rasche Besserung der renalen Situation. Nach insgesamt 6 Wochen Akuttherapie wird die Patientin schließlich auf eine Erhaltungstherapie mit Fluconazol umgestellt. Eine Kontroll-Liquorpunktion ist negativ. Angesichts des positiven Antigentiters im Serum auch nach einem Jahr wird entschieden, trotz sehr guter Immunrekonstitution auf über 500 CD4-Zellen (ART besteht inzwischen aus DDI+3TC+EFV) die tägliche Gabe von Fluconazol 200 mg weiter zu führen.
PROPHYLAXE
Eine Primärprophylaxe gegen Cryptococcus neoformans wird nicht empfohlen, da selbst in Endemiegebieten wie Thailand kein Überlebensvorteil gezeigt wurde. Die Exposition kann man wohl ebenfalls nicht verhindern. Die Sekundärprophylaxe bzw. Erhaltungstherapie besteht aus Fluconazol. Fluconazol ist wirksamer als Itraconazol - in einer randomisierten Studie betrug die Rezidivrate unter Fluconazol nur 4% gegenüber 23% im Itraconazol-Arm, und die Studie wurde vorzeitig abgebrochen. Fluconazol kann wahrscheinlich, wie einige Studien nahelegen, bei ausreichender Immunrekonstitution (über 100 CD4-Zellen, Viruslast drei Monate unter der Nachweisgrenze) und nach mindestens sechs Monaten Erhaltungstherapie abgesetzt werden. Zuvor sollte sicherheitshalber das Cryptococcus-Antigen kontrolliert werden. Bei positivem Antigen, das insbesondere bei hohen Titern mit einem erhöhten Rezidivrisiko assoziiert ist, sollte die Erhaltungstherapie sicherheitshalber fortgesetzt werden.

KATHRIN TINTELNOT, BERLIN
Cryptococcus species als Erreger der Kryptokokkose beim Menschen
Pilze der Gattung Cryptococcus gehören zur Klasse der Basidiomyzeten. Die 3-10µm großen sprossenden Hefezellen sind in vivo umhüllt von einer Schleimkapsel unterschiedlicher Dicke. Diese Kapsel ist von weitreichender immunologischer und diagnostischer Bedeutung. Sie hat einen antiphagozytären Effekt und steht im Focus beim mikroskopischen und serologischen Nachweis der Kryptokokkose. Die Erreger besitzen eine Phenoloxidase (Laccase), die zur Melaninsynthese aus Dopamin und L-Dopa befähigt. Anders als Hefen der Gattung Candida können pathogene Cryptococcus species mithilfe dieses Enzyms auch Katecholamine des Gehirns verstoffwechseln, was bei dem ausgeprägten Neurotropismus von Cryptococcus neoformans von Bedeutung ist.
Der häufigste Erreger der Kryptokokkose ist C. neoformans. Zunehmende Bedeutung erfährt eine weitere Cryptococcus Art, Cryptococcus gattii, die bis vor kurzem als Varietät von C. neoformans galt. Die beiden Arten unterscheiden sich unter anderem hinsichtlich der Verbreitung in der Natur, ihrer Virulenz und zahlreicher phänotypischer Merkmale. Während Vogel-, insbesondere Taubenkot, die bekannteste ökologische Nische von C. neoformans darstellt, kann C. gattii in Umgebung von Eucalyptus-Bäumen und Koniferen isoliert werden. C. neoformans ist weltweit verbreitet, während C. gattii vorwiegend in tropischen/subtropischen Regionen in Australien, Afrika, Amerika (USA, Mittel- und Südamerika) und Südostasien vorkommt. Seit wenigen Jahren gehört British Columbia/Canada zu Endemiegebieten von C. gattii. In Europa können autochthone Infektionen durch C. gatti am ehesten in Mittelmeerregionen mit Anpflanzungen von Eucalyptus-Bäumen erworben werden. C. gattii ist für Mensch und Tier virulenter als C. neoformans, daher erkranken vergleichsweise häufiger auch immunkompetente Personen an einer Kryptokokkose durch C. gattii. Infektionen durch andere Cryptococcus-Arten sind eine Rarität.
Bei HIV-Infizierten ist die Kryptokokkose seit Einführung einer HAART deutlich rückläufig. Während der Anteil von HIV-Infizierten bei Patienten mit Kryptokokkose in Deutschland in einer Erhebung der Paul-Ehrlich-Gesellschaft 1992-1997 noch bei 90% lag, fiel der Anteil auf 65% in den Jahren 1998-2003.
Erworben wird die Infektion in der Regel per inhalationem, seltener werden die Erreger traumatisch inokuliert. Die Infektion der Lunge verläuft meist subklinisch oder mit unklaren pulmonalen Beschwerden ("katarrhalischer Infekt"), sodass die Kryptokokkose in diesem Stadium äußerst selten erkannt wird. Typischerweise beginnt die Diagnostik daher erst anlässlich unspezifischer neurologischer Symptome wie zunehmenden Kopfschmerzen, psychischen Alterationen, Parästhesien oder auch fokalen Anfällen.
Mikrobiologische Diagnostik der Kryptokokkose
Am häufigsten wird die Diagnose einer Kryptokokkose aus dem Liquor gestellt, gefolgt vom Nachweis in Blutkulturen, bioptisch gewonnenen Proben und BAL. Bei entsprechender Erregerlast ist die Diagnose meist umgehend durch die Darstellung bekapselter Hefezellen im Liquor-Sediment mittels Tusche-Präparat nach Burri zu stellen. Die Antigenbestimmung zum Nachweis von Kapselpolysaccharid von C. neoformans bzw. C. gattii aus Serum, Liquor oder Urin gehört aufgrund hoher Sensitivität und Spezifität zum unverzichtbaren weiteren Parameter der Diagnostik. Am zuverlässigsten sind Teste auf der Basis polyklonaler Antikörper. Generell sollte bei jedem Cryptococcus-Antigen-screening aus Liquor parallel auch eine Serumprobe untersucht werden, da ein fehlender Cryptococcus-Antigennachweis eine Kryptokokkose nicht ausschließt. Jeder Cryptococcus-Antigen-Nachweis - unabhängig von der Höhe des Titers - ist bis zum Beweis des Gegenteils als Zeichen einer bestehenden oder kürzlich abgelaufenen Kryptokokkose zu bewerten. Falsch negative Befunde sind insbesondere bei un- bzw. wenig bekapselten Stämmen möglich.
Zum kulturellen Nachweis eignet sich am besten ein Indikator-Agar (Guizotia abyssinica-Kreatinin-Agar, syn. Nigersaat-Agar, syn. Staib-Agar), benannt nach Friedrich Staib, dem ehemaligen Leiter des Fachgebietes Mykologie am RKI. Auf diesem Medium sind Kolonien von C. neoformans bzw. C. gattii auch in Misch-Kulturen, z.B. mit Candida albicans, an ihrem Braunfarbeffekt zu erkennen. Der kulturelle Nachweis von C. neoformans bzw. C. gattii sollte in jedem Fall versucht werden. Kommerzielle biochemische Verfahren zur Identifizierung von Hefen differenzieren bislang nicht zwischen C. neoformans und C. gattii, so dass C. gattii möglicherweise als C. neoformans verkannt wird. Die zuverlässige Differenzierung und Typisierung erfolgt heutzutage mit molekularbiologischen Methoden. Die Re-Identifizierung klinischer Cryptococcus-Isolate aus den deutschsprachigen Ländern am RKI ergab, dass der Anteil von C. gattii in den letzten 10 Jahren 4,4% betrug. Aufgrund der regional unterschiedlichen Prävalenz von HIV-Infektionen einerseits und der Verbreitung von C. gattii in der Natur andererseits ist der Anteil von C. gattii-Infektionen bei AIDS-Patienten in Mittel-Europa noch selten.
Bis auf weiteres bietet das Konsiliarlaboratorium für C. neoformans am Robert Koch-Institut einen kostenlosen Service an, klinische Isolate der Gattung Crytococcus zu identifizieren, sofern Angaben zur Herkunft des Isolates gemacht werden. Erregersteckbriefe, Erhebungsbögen und Begleitscheine für das Untersuchungsmaterial sind unter www.rki.de > Infektionskrankheiten A bis Z > Mykosen abrufbar.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
