JOHANNES BOGNER, MÜNCHEN
Etravirin: ein NNRTI der zweiten Generation
Nicht nukleosidische Inhibitoren (NNRTI) in Kombination mit zwei Nukleosiden (NRTI) sind bewährte und erfolgreiche Firstline-Regime und auch als Folgeoption bei zuvor mit Proteaseinhibitoren behandelten Patienten einsetzbar. Zu den Nachteilen der NNRTI gehört allerdings die niedrige Resistenzbarriere. Die Einführung des neuen NNRTI Etravirin mit einer höheren Resistenzbarriere bedeutet daher für viele vorbehandelte Patienten eine deutliche Verbesserung ihrer Therapieoptionen.
Seit 10 Jahren sind nichtnukleosidische Hemmstoffe der reversen Transkriptase (NNRTI) bewährte Substanzen in der antiretroviralen Therapie. Die bisherigen Hauptvertreter dieser Substanzklasse Efavirenz und Nevirapin haben aber auch "Schwächen". Neben der schlechten Resorption und den substanzspezifischen Nebenwirkungen stellt insbesondere die niedrige Resistenzbarriere ein Problem für die Nachhaltigkeit der virologischen Wirkung dar. Bei unzureichender Adhärenz und/oder schlechten Resorption kann sich rasch eine Resistenz entwickeln. Die nahezu hundertprozentige Kreuzresistenz, die beispielsweise eine Mutation an Position 103 des RT-Gens verursacht, führte bislang zum Verlust der gesamten Wirkstoffklasse für die weitere Therapie eines Patienten.
VERBESSERTES RESISTENZPROFIL
Der neue NNRTI Etravirin zeigt im Vergleich zu den bisherigen Vertretern der Substanzklasse eine höhere Resistenzbarriere und keine Kreuzresistenz bei Vorligen der K103N-Mutation. Der Grund dafür ist, dass die Substanz Etravirin Konformationsänderungen mitmachen kann, die eine flexiblere und bessere Bindung an die HIV-spezifische reverse Transkriptase (RT) ermöglicht.1 Veränderungen der räumlichen Beschaffenheit an der Bindungsstelle der RT durch eine oder mehrere Mutationen können dadurch nicht gleich die Wirkung neutralisieren.2
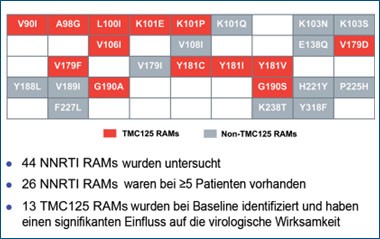
Abb. 1: Etravirin: Resistenz-assoziierte Mutationen
Bei herkömmlichen NNRTI genügt eine einzige Mutation an der Position 103, um eine komplette Resistenz hervorzurufen. Bei Etravirin hingegen sind hierfür drei oder mehr NNRTI-Resistenzmutationen erforderlich. Mutationen, die in Studien mit einer Etravirin-Resistenz assoziiert waren, sind: V90I, A98G, L100I, K101E, K101P, V106I, V179D, V179F, Y181C, Y181I, Y181V, G190A und G190S.11 Vingerhoets und Kollegen berichteten, dass die Mutation Y181C zusammen mit Mutationen an den Positionen 101, 179, 190, und 230 in vitro die Resistenz gegenüber Etravirin deutlich ansteigen lässt (Abb. 1).1
ANTIVIRALE WIRKSAMKEIT IN STUDIEN
Zunächst wurde Etravirin in den frühen Studienphasen unter dem Produktkürzel TMC-125 geprüft. In einer Phase I/II-Studie an bisher nicht vorbehandelten HIV- infizierten Probanden führte TMC-125 bereits nach einer Woche zu einer Reduktion der Plasma-Viruslast um 2 log10 Stufen beobachtet.3; 4 Bei vorbehandelten Patienten mit NNRTI-Mutationen kam es ebenfalls zu einer deutlichen Senkung der Viruslast, beispielsweise um 0,9 log10 Stufen.4; 5 Eine Phase II-Studie mit der Bezeichnung C233 an 199 vorbehandelten Patienten mit NNRTI- und PI-Mutationen, zeigte nach 48 Wochen eine signifikant niedrigere Viruslast unter TMC-125 im Vergleich zum Placeboarm.6 In dieser Studie wurde auch beobachtet, dass mit Vorliegen mehrerer NNRTI-Resistenzen die klinische Wirksamkeit geringer wurde. Bei Vorliegen einer Mutation nahm die Viruslast um 1,38 log10-Stufen ab, wenn aber mehr als zwei Mutationen vorlagen, lag die Reduktion der Viruslast nur noch bei 0,54 log10 Stufen.
DUET-STUDIEN
Die entscheidenden Zulassungsstudien, die DUET-Studien, wurden in der Salvage-Therapie durchgeführt. Bei diesen Studien handelt es sich - wie meist von den Zulassungsbehörden gefordert - um zwei gleichartig aufgebaute Untersuchungen (Nordamerika/Europa und weitere Länder), die einzeln und gemeinsam ausgewertet wurden. An der Studie DUET 1 nahmen 612 Patienten teil. Einschlusskriterien waren u.a. eine Vorbehandlung mit mehreren Substanzklassen, eine Viruslast über 5.000 Kopien/ml sowie eine Resistenz gegen NNRTI und das Vorliegen von mindestens drei PI-Mutationen. Als Medikation erhielten die Patienten entweder Etravirin 2x 200 mg oder Placebo zusammen mit Darunavir/r (alle Patienten Verum) und nukleosidische Reversetranskriptase Inhibitoren (NRTI) nach Wahl des Prüfarztes sowie optional Enfuvirtid (T20) als optimierte Hintergrundtherapie. Nach 24 Wochen lag der Prozentsatz von Patienten mit einer Viruslast <50 Kopien/ml in der Etravirin-Gruppe bei 56% verglichen mit 39% in der Placebogruppe.7
Die Studie DUET 2 hatte dasselbe Design, jedoch einen anderen Einzugsbereich (DUET 1: Thailand, Australien, Europa und "Americas"; DUET 2: Nordamerika). Hier waren es 591 Teilnehmer. Die Erfolgsraten (Viruslast <50 Kopien/ml) lagen nach 24 Wochen bei 62% in der Etravirin-Gruppe und 44% in der Placebogruppe.8
Mittlerweile liegt die gemeinsame Auswertung beider Studien zu Woche 48 vor. In der gepoolten Analyse erreichten 61% der Etravirin-Patienten eine Viruslast <50 Kopien/ml verglichen mit 40% der Patienten im Placebo-Arm.9 Immunologisch zeigte sich eine signifikant stärkere Zunahme der CD4-Zellen unter Etravirin im Vergleich zu Placebo (Abb. 2a und b).
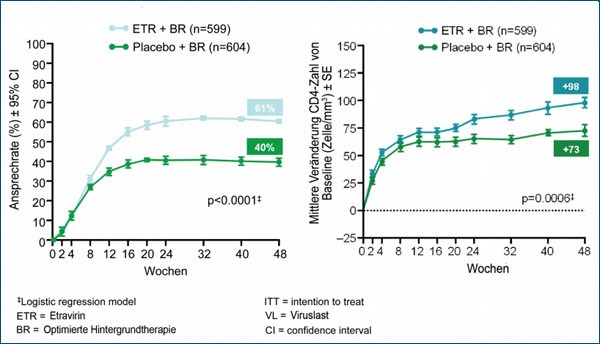
| Abb. 2a: Gepoolte Analyse der Studien DUET 1 und 2: Nach 48 Wochen erreichen 61% der Etravirin-Patienten eine Viruslast <50 Kopien/ml verglichen mit 40% der Patienten im Placebo-Arm (R. Haubrich et al., Abbildung gezeigt bei CROI 2008) | Abb. 2b: Zunahme der CD4-Helferlymphozyten in der gepoolten Analyse der Studien DUET 1 und 2: Zunahme im Mittel um 98 CD4-Zellen bei den Etravirin-Patienten und nur 73/µl im Placebo-Arm (R. Haubrich et al., Abbildung gezeigt bei CROI 2008) |
ZULASSUNG UND ANWENDUNG
In der Zulassung durch die Food and Drug Administration (FDA) der USA wird die Anwendung empfohlen für HIV-Infizierte mit Nachweis einer vorbestehenden NNRTI-Resistenz und Resistenzen gegen weitere Substanzen.10 Etravirin soll nach FDA nicht alleine mit NRTI kombiniert werden. Das bedeutet, dass andere Substanzgruppen wie geboosterte PI oder Substanzen der neuen Wirkstoffklassen (CCR5-Inhibitor, Fusionsinhibitor, Integrasehemmstoff) in die Kombination mit einbezogen werden sollen.
Die Zulassung durch die europäische Zulassungsbehörde ist im Text noch nicht im Detail bekannt. Es wird aber erwartet, dass ähnliche Empfehlungen bezüglich der Kombinationsnotwendigkeit ausgesprochen werden. Die Begründung dafür liegt auch nahe: die wichtigste Studie (DUET) wurde ebenfalls in Kombination mit einem geboosterten Proteasehemmer der zweiten Generation durchgeführt und es gibt keine Salvage-Studie, in der Etravirin mit Nukleosiden alleine kombiniert wurde.
DOSIERUNG
Etravirin wird zusammen mit NRTI in einer Dosierung von 2 x 200 mg pro Tag (2 x 2 Tabletten à 100 mg) nach einer Mahlzeit eingenommen.10 Dabei ist die Art der Nahrung unerheblich. Die Einnahme auf nüchternen Magen kann eine Reduktion der Wirkspiegel bis 50% verursachen. Falls eine Schluckstörung vorliegt, können Etravirin-Tabletten auch in Wasser aufgelöst werden. Etravirin sollte infolge von Wechselwirkungen nicht zusammen mit Atazanavir/r, Fosamprenavir/r und Tipranavir/r oder einem nicht-geboosterten Proteasehemmer eingenommen werden.10
PHARMAKOLOGISCHE EIGENSCHAFTEN UND INTERAKTIONEN
Etravirin ist ein kleines, wasserunlösliches Molekül mit einem Molekulargewicht von 435.10 Die Substanz wird nach oraler Einnahme gut resorbiert und verteilt. Die Spitzenspiegel werden nach 2,5 bis 4 Stunden erreicht. Bei gesunden Probanden wurde der Einfluss des Magen-pH untersucht. Die Gabe von Säureblockern wie Ranitidin oder Omeprazol hatte keinen klinisch bedeutsamen Einfluss auf die Bioverfügbarkeit.
Die Verstoffwechslung und der Abbau erfolgen über das Cytochrom p450-System in der Leber. Etravirin ist ein Induktor von CYP3A4 und ein Inhibitor von CYP2C9 und 2C19. Die gleichzeitige Gabe mit Substanzen, die eine Hemmung oder Induktion der Untereinheiten CYP3A4, CYP2C9 oder CYP2C19 verursachen, kann den therapeutischen Nutzen und die Sicherheit des Einsatzes von Etravirin oder der gleichzeitig verabreichten Substanzen verursachen.
Etravirin soll nicht zusammen eingenommen werden mit Diazepam, Midazolam, Triazepam, Phenobarbital, Phenytoin, Carbamazepin, Rifampicin, Terfenadin und einigen Antiarrhythmika. Die gleichzeitige Verabreichung mit Azol-Antimykotika bedarf der Beachtung folgender Interaktionsmöglichkeiten:
Itraconazol und Ketoconazol können die Etravirin-Konzentrationen erhöhen. Gleichzeitig kann Etravirin die Konzentration dieser Antimykotika erniedrigen. Die gleichzeitige Anwendung von Voriconazol mit Etravirin kann die Spiegel beider Medikamente erhöhen. Am unproblematischsten ist die Kombination mit Flucaonazol.
Etravirin und Methadon können ohne Dosisanpassung miteinander kombiniert werden. Die klinische Beobachtung des Patienten bezüglich möglicher Entzugssymptome und ggf. eine Anpassung der Methadondosis nach oben sind jedoch empfohlen.
Für die Anwendung in der Schwangerschaft gibt es keine ausreichenden klinischen Daten. Tierexperimentelle Daten geben jedoch nicht Anlass zur Sorge, dass mit Missbildungen zu rechnen ist. Deshalb wurde die Substanz in Kategorie "B" bezüglich der Möglichkeit der Anwendung in der Schwangerschaft gruppiert.10
NEBENWIRKUNGEN
Die häufigsten Nebenwirkungen von Etravirin sind Hautausschlag und Übelkeit. In klinischen Prüfungen waren diese beiden Reaktionen jeweils häufiger als im Placeboarm. Die Häufigkeit von Hautausschlag jeglichen Schweregrades lag bei 14 bis 20%. Die Häufigkeit von Schweregrad 2 betrug allerdings nur 9%. Diese Nebenwirkung muss nicht zum Behandlungsabbruch führen, wie der geringe Prozentsatz von 2% Behandlungsabbruch durch Hautausschlag zeigt. Das Exanthem trat hauptsächlich in der zweiten Behandlungswoche auf und kam praktisch nach der vierten Woche nicht mehr vor. Auch unter fortgesetzter Therapie kam es meist zum Verschwinden des Ausschlags. Patienten, die früher schon ein Exanthem auf andere NNRTI entwickelt hatten, zeigten keine höhere Wahrscheinlichkeit, auch auf Etravirin mit Ausschlag zu reagieren.
Nimmt der Ausschlag allerdings Charakteristika des Stevens-Johnson Syndroms an, so ist auf alle Fälle ein Behandlungsabbruch erforderlich. Solche Fälle waren in Studien ebenso selten (<0,1%) wie andere Manifestationen, z.B. im Sinn von Erythema multiforme oder Hypersensitivitätsreaktion. Behandlungsabbrüche waren in den DUET-Studien im Etravirin-Arm nicht signifikant häufiger als in den Kontrollarmen.
Weitere Nebenwirkungen sind, vor allem Durchfall, Kopfschmerzen, Müdigkeit, Sehstörungen und Konzentrationsschwierigkeiten. Veränderungen von Laborwerten waren unter Etravirin nicht signifikant häufiger als im Vergleichsarm. Das betrifft auch die Leber. Ähnlich wie bei anderen Substanzen kam es allerdings in den DUET-Studien bei Patienten mit einer Hepatitis B- oder C-Koinfektion unter Etravirin häufiger zum Anstieg von Transaminasen und GGT als bei Patienten ohne Koinfektion. Eine Zunahme der Transaminasen vom Grad 2 oder höher wurden bei etwa 20% der Koinfizierten beobachtet (Vergleich: ca. 6%).
Literatur
1. Vingerhoets J, Azijn H, Fransen E et al. TMC125 displays a high genetic barrier to the development of resistance: evidence from in vitro selection experiments. J Virol 2005; 79(20):12773-12782.
2. Das K, Lewi PJ, Hughes SH, Arnold E. Crystallography and the design of anti-AIDS drugs: conformational flexibility and positional adaptability are important in the design of non-nucleoside HIV-1 reverse transcriptase inhibitors. Prog Biophys Mol Biol 2005; 88(2):209-231.
3. Gruzdev B, Rakhmanova A, Doubovskaya E et al. A randomized, double-blind, placebo-controlled trial of TMC125 as 7-day monotherapy in antiretroviral naive, HIV-1 infected subjects. AIDS 2003; 17(17):2487-2494.
4. Sankatsing SU, Weverling GJ, Peeters M et al. TMC125 exerts similar initial antiviral potency as a five-drug, triple class antiretroviral regimen. AIDS 2003; 17(18):2623-2627.
5. Gazzard BG, Pozniak AL, Rosenbaum W et al. An open-label assessment of TMC 125--a new, next-generation NNRTI, for 7 days in HIV-1 infected individuals with NNRTI resistance. AIDS 2003; 17(18):F49-F54.
6. Efficacy and safety results at 48 weeks with the novel NNRTI, TMC125, and impact of baseline resistance on the virologic response in study TMC125-C223. XVI International AIDS Conference; 06; Toronto: 2006.
7. Madruga JV, Cahn P, Grinsztejn B et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in DUET-1: 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet 2007; 370(9581):29-38.
8. Lazzarin A, Campbell T, Clotet B et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in DUET-2: 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet 2007; 370(9581):39-48.
9. 48-week data released for etravirine (TMC125). AIDS Patient Care STDS 2008; 22(3):254-255.
10. Janssen Cilag / Tibotec. Intelence TM (etravirine) Tablets. Full prescribing Information. 2008.
11. Geretti AM. Shifting paradigms: the resistance profile of etravirine. J Antimicrob Chemother 2008.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
