16TH CROI 2009, MONTREAL, KANADA, 08.-11. FEBRUAR 2009
Bunte Mischung spannender Arbeiten

Auf der diesjährigen CROI gab es nur wenige Aufsehen erregende neue Therapiestudien, dafür umso mehr spannende Daten aus anderen Bereichen. Die Highlights waren über den ganzen Kongress verstreut von der Plenarsitzung bis hin zur Posterdiskussion. Die Stimmung war entspannt, die Forscher gelassen. Selbst so brisante Themen wie latente Reservoire und HIV im Sperma wurden in aller Ruhe diskutiert.

Oliver "Tuku" Mtukudzi aus Simbabwe singt auch über HIV
Die diesjährige CROI eröffnete mit zwei Vorträgen zu den wichtigsten Themen im HIV-Bereich. Robert Siliciano, Baltimore, erklärte den aktuellen Stand des Wissens zu den latenten Reservoiren. Glenda Grey und James McIntyre von der Universität Witwaterstrand in Johannesburg gaben einen Überblick über die Geschichte von HIV in Soweto. Der musikalische Rahmen wurde von Oliver "Tuku" Mtukudzi aus Simbabwe gestaltet. Der Musiker ist einer der wenigen afrikanischen Künstler, die HIV thematisieren und zwar sowohl in seinen Liedern als auch mit dem öffentlichen Bekenntnis, dass sein Bruder an AIDS verstorben ist.
VIRÄMIE UNTER DER NACHWEISGRENZE
In der 14ten Bernard Fields Lecture demonstrierte Robert Siliciano, dass auch bei Patienten mit einer Viruslast unter der Nachweisgrenze gemessen mit den gängigen Testverfahren mit hochsensitiven Methoden noch HIV nachweisbar ist. "Die minimale Viruslast schwankt, im Schnitt liegt sie bei 1 Kopie/ml", erklärte Siliciano, "und manchmal übersteigt sie die Nachweisgrenze und manifestiert sich als Blip". Die Viren stammen wie phylogenetische Analysen belegen aus latent infizierten Zellen und sind nicht gegen das aktuelle HAART-Regime resistent. Eine Intensivierung der HAART bei diesen mit herkömmlichen Regimen bereits optimal supprimierten Patienten hatte keinerlei Einfluss auf die minimale Virämie. Viele der latent infizierten Zellen, die intermittierend HIV sezernieren, konnte die Arbeitsgruppe um Siliciano identifizieren, aber nicht alle. "Es gibt ein zweites, bislang nicht bekanntes Reservoir", meinte der Wissenschaftler.
INHIBITORISCHES POTENTIAL
Zudem stellte Siliciano einen neuen Weg zur Beurteilung der Wirksamkeit von antiretroviralen Substanzen vor. Dieser berücksichtigt anders als die bisherigen pharmakologischen Methoden, die lediglich den log-Abfall der Viruslast abbilden, die Geschwindigkeit, mit der der HIV-Replikationszyklus gestoppt wird. In dem neuen pharmakodynamischen Modell schneiden Proteasehemmer am besten ab. "Es muss jedoch auch der Effekt der Kombination und die Verträglichkeit berücksichtigt werden", betonte Siliciano. Nach seiner Einschätzung könnte das neue Modell insbesondere zur Vorhersage der Wirksamkeit von Zweittherapien und Salvageregimen hilfreich sein (Siliciano R #16).
FRÜHER THERAPIEBEGINN
Erneut bestätigten zwei Kohortenanalysen den Nutzen eines früheren Therapiebeginns als bislang üblich. In der Analyse der NA-ACCORD (North American AIDS Cohort Collaboration on Research and Design)-Kohorte wurden die Daten von 9.174 Patienten (28.032 Personenjahre) mit einem Therapiebeginn >500 und <500 CD4-Zellen/ µl verglichen. Der frühere Therapiestart verminderte die Gesamtmortalität um 60% (Kitahata M et al. #71). In der ART Cohort Collaboration, einem Zusammenschluss nordamerikanischer und europäischer Kohorten mit 21.000 Patienten (68.253 Personenjahre), ging ein Therapiebeginn bei 251-350 CD4-Zellen/ µl im Vergleich zu einem früheren Start bei 351-450 CD4-Zellen/µl mit einer um 28% erhöhten Rate an AIDS oder Tod einher. Der Nutzen des früheren Therapiebeginns wurde mit zunehmender CD4-Zahl geringer und bei einer CD4-Zahl >400/µl ergab sich kein zusätzlicher Benefit (Sterne J et al. #72LB).
FIRSTLINE-THERAPIEN
In der Studie STARTMRK, in der Raltegravir und Efavirenz in Kombination mit Tenofovir/Emtricitabin nach 48 Wochen vergleichbar wirksam waren (86% vs 82%), zeigte sich auch in den Subgruppen kein Unterschied (Lennox J et al. #573). In ARTEMIS trat im Verlauf der ersten 96 Therapiewochen unter Darunavir/r (800/100 mg OD) seltener ein Therapieversagen auf als unter Lopinavir/r BID (11,7% vs 17,1%). Die verfügbaren Isolate waren phänotypisch auf alle Proteasehemmer empfindlich. Es wurden keine primären PI-Mutationen beobachtet (Dierynck I et al. #655). Patienten mit suboptimaler Adhärenz (<95%) entwickelten seltener unter Darunavir/r ein virologisches Therapieversagen als unter Lopinavir/r (47% vs 24%) (Nelson M et al. #575).
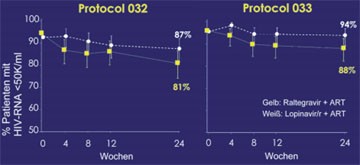
Abb. 1: SWITCHMRK: Patienten mit HIV-RNA <50 Kopien/ml (NC = F)
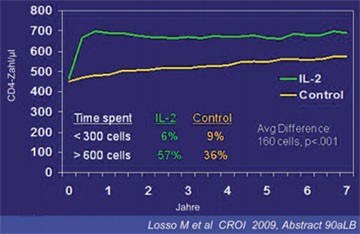
Abb. 2a: ESPRIT: Mediane CD4-Zahl - Follow-up
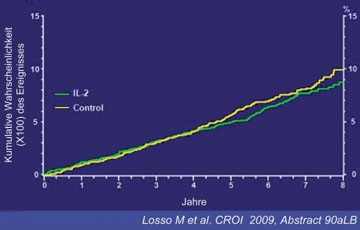
Abb. 2b: ESPRIT: Opportunistische Erkrankung oder Tod
SWITCH AUF RALTEGRAVIR
Eine große Überraschung auf dem Kongress war das Ergebnis der SWITCHMRK-Studie. In der randomisierten Untersuchung war der Wechsel von Raltegravir auf Lopinavir/r häufiger mit einem virologischen Versagen verbunden als die Fortführung des ursprünglichen Regimes. Die Studie besteht aus zwei gleichen Teilen SWITCHMRK I und II. Es nahmen 355 Patienten teil, deren Viruslast seit mindestens drei Monaten unter einer Lopinavir/r-basierten HAART <50 Kopien/ml lag. Bei 176 Patienten wurde von Lopinavir/r auf Raltegravir umgestellt, 178 Patienten nahmen Lopinavir/r weiter. Nach 24 Wochen lag die Viruslast unter Raltegravir bzw. Lopinavir/r bei 88% bzw. 93,8% der Patienten unter der Nachweisgrenze (Abb. 1). Raltegravir hatte das Kriterium der Nicht-Unterlegenheit nicht erreicht. Versagt hatten insbesondere vorbehandelte Patienten. 84% der Patienten mit Therapieversagen unter Raltegravir waren beim Switch nicht mehr auf ihrem Firstline-Regime und bei 66% hatte bereits früher einmal eine Therapie versagt (Eron J et al. #70a).
Dagegen erwies sich der Switch von Enfuvirtid auf Raltegravir bei stark vorbehandelten Patienten unter erfolgreicher HAART als virologisch sicher. Innerhalb der ersten 24 Wochen kam es lediglich bei je einem Patienten (1,2%) pro Gruppe zum virologischen Versagen (De Castro N et al. #138).
MOST: PI-MONOTHERAPIE
Eine Monotherapie mit einem Proteasehemmer ist insbesondere für Patienten mit niedrigem CD4-Nadir nicht geeignet. In der Studie MOST kam es bei 21% der Patienten, die von einem erfolgreichen Regime auf eine Lopinavir/r-Monotherapie umgestellt wurden, in den ersten 24 Wochen zum virologischen Versagen. Alle diese Patienten (6/29) hatten einen CD4-Nadir von <200/µl (Gutmann C et al. #578).
AUS FÜR INTERLEUKIN-2
Auf die adjuvante Therapie mit Interleukin-2 war viel Hoffnung gesetzt worden. Interleukin-2 zusätzlich zur HAART führte in den Studien ESPRIT und SILCAAT auch wie erwartet zu einem stärkeren Anstieg der CD4-Zellen als die HAART allein - doch leider ohne klinischen Nutzen. Die Mortalität und AIDS-definierende Ereignisse waren in beiden Gruppen vergleichbar. In ESPRIT (Evaluation of Subcutaneous Proleukin in a Randomized International Trial) und SILCAAT (Subcutaneous IL-2 in patients with Low CD4 Counts under Active Antiretroviral Therapy) wurden 4.111 bzw. 1.695 Patienten mit HAART allein oder zusätzlich mit Interleukin-2 in verschiedenen Dosierungen rund sieben Jahre lang behandelt. Die CD4-Zahl in ESPRIT bei Studienbeginn lag bei >300/µl (median 457/µl) und war am Ende um 153/µl gestiegen. An SILCAAT nahmen Patienten mit weiter fortgeschrittenem Immundefekt und einer CD4-Zahl zwischen >50 und <300/µl (Median 202/µl) teil. Hier betrug der CD4-Anstieg 57/µl.

Enttäuscht: Die Autoren der ESPRIT und SILCAAT Studie, Marcelo Losso und Yves Levy
Die primären Endpunkte AIDS und Tod traten jedoch in beiden Studien trotz höherer CD4-Zahl durch Interleukin gleich häufig auf (Abb. 2a und b). Die Autoren der Studien Marcelo Losso und Yves Levy boten verschiedene mögliche Erklärungen für das Fehlen eines klinischen Nutzens von Interleukin-2 an. Zum einen könnten die durch das Zytokin gewonnenen CD4-Zellen weniger gut "funktionieren", zum anderen könnten ungünstige Effekte von Interleukin-2 den Nutzen des CD4-Anstiegs ausgleichen. Als dritte Erklärung wurde diskutiert, dass der CD4-Anstieg unter dem Interleukin bei Patienten mit einer gut supprimierten Viruslast unter HAART möglicherweise zu gering ist, um klinisch relevant zu sein (Losso M et al. #90aLB, Levy Y et al. #90bLB).
KARDIOVASKULÄRES RISIKO
Das kardiovaskuläre Risiko war ein intensiv diskutiertes Thema auf dem Kongress und es wurden sehr viele Arbeiten dazu präsentiert. In der DAD-Studie hatten 580 der 33.000 Patienten einen Herzinfarkt erlitten. Meist waren es Männer mit einem bereits erhöhten kardiovaskulären Risiko. Das Risiko unter einzelnen Medikamenten wurde analysiert, wenn mehr als >30.000 Personenjahre dazu dokumentiert waren. Abacavir erhöhte das Herzinfarkt-Risiko innerhalb der ersten sechs Monate. Didanosin, Indinavir und Lopinavir hatten bei langfristiger Einnahme einen negativen Einfluss, auch nach Adjustierung für die Lipide (Lundgren J et al. #44LB). In der Analyse der FHDB (French Hospital Data Base) war das Infarktrisiko unter Abacavir im ersten Jahr erhöht ebenso wie bei langfristiger Einnahme unter Lopinavir und Fosamprenavir (Lang S et al. #43LB). In Auswertungen randomisierter Studien, z.B. ALLRT (10.000 Patientenjahre), wurde dagegen kein negativer Effekt von Abacavir beobachtet (Benson C et al. #721). Ähnlich widersprüchlich waren die Daten zu kardiovaskulären Entzündungsmarkern wie dem hochsensitiven CRP, IL-6, VCAM-1, D-Dimer usw. Zudem scheint die HIV-Infektion selbst ein unabhängiger, kardiovaskulärer Risikofaktor zu sein vergleichbar mit Rauchen und Diabetes mellitus. Das ergab zumindest der Vergleich der Intima-Media-Dicke von zwei großen Kollektiven mit und ohne HIV (Grunfeld C et al. #146).
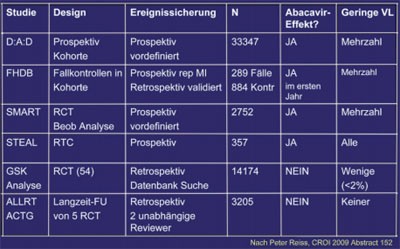
Abb. 3a: Kardiovaskuläres Risiko unter Abacavir Studienübersicht
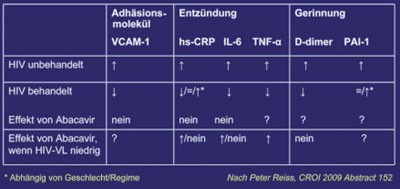
Abb. 3b: Kardiovaskuläre Biomarker unter Abacavir Studienübersicht
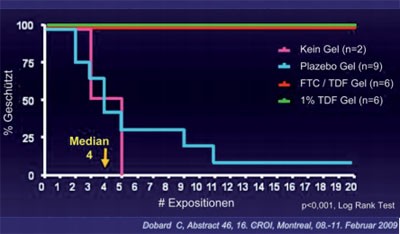
Abb. 4: TDF- und TDF/FTC-Gel im Tierversuch
EMPFEHLUNG ZU ABACAVIR BLEIBT
Am Ende der Konferenz gelang es Peter Reiss, Amsterdam, die verschiedenen Puzzle-Teile zu sortieren und ein verständliches - wenn auch hypothetisches Bild - zusammenzusetzen. Nach Reiss führt die unbehandelte HIV-Infektion zur Hochregulierung der endothelialen Aktivierung, der Entzündung sowie der Gerinnung. Wird eine HAART eingeleitet, kommt es zur Downregulation der Biomarker, wobei hier offenbar Unterschiede im Hinblick auf Geschlecht und Regime bestehen. In dieser Phase scheint Abacavir keinen negativen Effekt zu haben. Bei Patienten mit nicht nachweisbarer bzw. geringer Viruslast finden sich jedoch laut Peter Reiss Hinweise auf erhöhte Entzündungsmarker und auf einen ungünstigen Einfluss von Abacavir, auch wenn das Bild lange noch nicht einheitlich ist (Abb. 3a und b) (Reiss P #152). Was unverändert bleibt, ist die Empfehlung, Abacavir bei Patienten mit deutlich erhöhtem kardiovaskulärem Risiko - wenn möglich - nicht einzusetzen.
HIV/HCV
Bei der HIV/HCV-Koinfektion scheint eine hohe HCV-Viruslast die Mortalität zu erhöhen. In einer Auswertung der Daten von 1.952 Koinfizierten der EuroSIDA-Kohorte hatten Patienten mit hoher HCV-Viruslast eine fast doppelt so hohe Sterblichkeit wie Patienten mit weniger HCV im Blut (Rockstroh JK et al. #101). Bei einer HCV-Therapie ist das frühe Ansprechen (EVR) der beste Prädiktor für einen dauerhaften Therapieerfolg, wobei komplette Responder deutlich bessere Chancen haben als Patienten, die lediglich eine Reduktion der HCV-Viruslast um mindestens 2 log erreichen (SVR 62% vs 17%) (Chung R et al. #103). Wichtig für das Ansprechen ist hier unter anderem die Aktivierung der T-Zellen. Diese scheint bei einigen HIV-Infizierten vermindert zu sein, kann aber durch eine HAART möglicherweise verbessert werden (Rohrbach J et al. #105).
HIV/HBV
Tenofovir im Rahmen einer HAART ist auch gut gegen HBV wirksam. In einer französischen Studie kam es unter Tenofovir (75% in Kombination mit Lamivudin) bei 98% der HIV/HBV-Koinfizierten rasch (Median 8 Monate) zu einer dauerhaften Suppression der HBV-DNA <10.000 Kopien/ml. Bei vier Patienten (2,6%) wurden Blips und bei zwei (1,3%) ein Rebound beobachtet. Primäre Resistenz-Mutationen sind nicht beschrieben (Lacombe K et al. #100, Sitou H et al. #817).
Zu Telbivudin wurde eine interessante Kasuistik präsentiert. Bei einem koinfizierten Patienten fiel die HIV-Viruslast unter Telbivudin ohne HAART bis unter die Nachweisgrenze. HIV-Resistenzmutationen wurden nicht beobachtet. Auf einem Poster des Herstellers von Telbivudin wurde dagegen gezeigt, dass Telbivudin im Gegensatz zu Entecavir bei allen bisher geprüften HIV-Isolaten (Wildtyp und multiresistente Isolate) keinen Einfluss hat (Low E et al. # 813a, Avila C et al. #813b).
NEUE SUBSTANZEN
KEINE VIREN IM BLUT, ABER IM SPERMA
Auf internationalen Kongressen wird stets vermieden, über das EKAF-Papier zu sprechen. Die Botschaft sei - so die einhellige Meinung der internationalen Vereinigungen - nicht für die Prävention geeignet. Dennoch kam die Schweizer These zur Sprache, als in zwei Studien bei Männern ohne HIV im Blut, HIV im Sperma nachgewiesen wurde. In einer kanadischen Studie wurde nach Einleitung der HAART der Abfall der Viruslast im Blut und Sperma verfolgt (Abb. 5). Bei allen 25 Patienten war 24 Wochen nach Therapiebeginn HIV im Blut nicht mehr nachweisbar. Im Sperma wurde jedoch bei 3 Männern HIV gefunden ebenso bei 4/13 Männern in einem Kollektiv mit schon lange nicht nachweisbarer Viruslast bei einer sporadischen Untersuchung (Sheth P et al. #50).
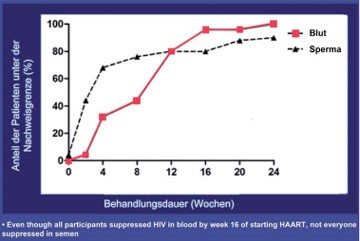
Abb. 5: Patienten HAART-Beginn - HIV-RNA im Blut und Sperma
In der zweiten französischen Studie lag die Viruslast länger als sechs Monate unter der Nachweisgrenze und es bestanden keine sexuell übertragbaren Erkrankungen, d.h. die Männer erfüllten die sogenannten EKAF-Kriterien. Hier war bei 7/145 Männern die Viruslast im Blut negativ, im Sperma aber positiv mit bis zu 1.200 Kopien/ml (Marcelin A-G et al. #51). Was dies für die These der EKAF bedeutet, die besagt, dass Personen mit den oben genannten Kriterien ein vernachlässigbares Risiko der Transmission aufweisen, ist nicht ganz klar. Es wurden methodische Zweifel angemeldet und bis heute ist nicht bekannt, wie viele Viren für eine Übertragung vorhanden sein müssen. Widerlegt ist die These somit nicht. Ob sie stimmt, lässt sich allerdings ebenso wenig belegen.
Am meisten Beachtung fanden die neuen Substanzen SPI-452 von Sequoia Pharmaceuticals und GS-9350 vom Unternehmen Gilead. Beide hemmen CYP3A, sollen ähnlich wie Ritonavir zum Boostern eingesetzt werden und können einmal täglich gegeben werden. GS-9350 soll zudem in Kombination mit dem Integrasehemmer Elvitegravir und TDF/FTC zur ersten 4er-Pille entwickelt werden (Gulnik S et al. #41, Mathias A et al. #40).
FORTSCHRITT BEI MIKROBIZIDEN
Bislang sind alle klinischen Studien mit Mikrobiziden gescheitert. Endlich gibt es nun eine gute Nachricht. Das ionische Polymer PRO2000 vermindert das Infektionsrisiko um rund 30%. In der Untersuchung an 3.000 Frauen in Afrika und den USA hatte das Mikrobizid bei Frauen, die selten Kondome verwandten, aber dafür sehr häufig das Gel, sogar noch mehr Erfolg. Das Transmissionsrisiko in dieser Gruppe wurde durch PRO2000 um 78% gesenkt (Karim A et al. #48LB). Weitere vielversprechende Präparate in der Pipeline sind Tenofovir bzw. Tenofovir/Emtricitabin-haltiges Gel. Die Präparate schützen Affen komplett vor einer HIV-Infektion, wobei das Kombinationsgel interessanterweise nicht wirksamer war als das Tenofovir-Gel (Abb. 4) (Garcia-Lerma G et al. #47). Auch bei der oralen Präexpositionsprophylaxe (PrEP) gibt es Fortschritte. Es wurde zwar noch kein Ergebnis der laufenden klinischen Studien mit Tenofovir bzw. Tenofovir/Emtricitabin präsentiert, doch im Tierexperiment wird das Konzept bereits weiter entwickelt. Hier erwies sich die intermittierende PrEP mit einmal Tenofovir alle sieben bzw. alle drei Tage plus jeweils einmalig Tenofovir zwei Stunden nach der Exposition als genauso wirksam wie die tägliche Einnahme (Dobard C et al. #46).











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
