 10th International Workshop of Clinical
Pharmacology in HIV-Therapy, 16.-18.4.2009 in Amsterdam
10th International Workshop of Clinical
Pharmacology in HIV-Therapy, 16.-18.4.2009 in Amsterdam
Neue pharmakologische Einblicke
Der „Clinical Pharmacology Workshop on HIV-Therapy“ feierte diesen April in Amsterdam sein 10-jähriges Jubiläum. Die Anzahl der Teilnehmer sowie das Themenspektrum stiegen über die letzten 10 Jahre kontinuierlich. Wichtige Themen waren die Pharmakokinetik verschiedener Kompartimente, neue Substanzen, die Pharmakogenetik und HIV im Alter.
Um eine HIV-Transmission zu verhindern, wird über antiretrovirale Medikamente als präventive Maßnahme nachgedacht. Optimale Kandidaten für eine PrEP und PEP sind Arzneimittel, die nach einer Einzeldosis schnell in hohen Dosen im Genitaltrakt (GT) anfluten. Dumond et al. fanden für alle Arzneimittel messbare Konzentrationen nach 2-4h im GT, wobei Maraviroc (MVC) sehr hohe Konzentrationen erreichte. Weitere exzellente Kandidaten sind Epivir (3TC), Retrovir (AZT), Emtricitabin (FTC) und Tenofovir (TDF). Die Konzentrationen dieser Substanzen im GT entsprachen den Konzentrationen im Blut oder lagen sogar darüber. Moderate Konzentrationen wurden für Lopinavir (LPV) und Atazanavir (ATV) gemessen.1 Eine Studie von Jones et al. zeigte, dass das Raltegravir (RAL) auch in diesem Bereich liegt. An Tag 1 wurden 60% der RAL-Konzentration, an Tag 7 100% im Vergleich zu den Konzentrationen im Blut gemessen.2 Efavirenz (EFV) und Stavudin (d4T) wiesen dagegen nur 10% der Plasmaspiegel im GT auf und sind damit zur Prävention eher ungeeignet. In der ACTG Studie A5077 wurde bei stark vorbehandelten Frauen zudem eine erhöhte Rate von NNRTI Mutationen im GT gefunden. Der Zusammenhang zwischen Arzneistoffkonzentration und Resistenzprofil im GT ist derzeit noch unklar und muss weiter untersucht werden.
Liquorgängigkeit
Letendre et al. beschäftigten sich mit der ART-Konzentration in der cerebrospinalen Flüssigkeit (CSF), um das häufige Vorkommen von HIV-assoziierten neurokognitiven Erkrankungen zu senken. In der vorgestellten Studie wurden Fosamprenavir/Ritonavir (FPV/r) und Abacavir (ABC) unter die Lupe genommen. Beide erreichten im CSF ausreichend hohe Konzentrationen. Amprenavir konnte den HIV-Wildtyp zu 100% inhibieren, Abacavir zu 50%. Somit ist die Aktivität von FPV/r im Nervensystem vergleichbar mit Indinavir (IDV) und LPV/r. Bei den NRTIs wird die ABC Aktivität im Nervensystem höher eingeschätzt als die von TDF, da TDF im CSF keine Konzentration erreichte, die die IC50 für den HIV-Wildtyp überschreitet.3
Booster-Dosierung
In Bezug auf die Boosterforschung wurde diskutiert, welche Ritonavir (RTV)-Dosis nötig ist, um Proteasehemmer (PIs) zu boostern. Beim Vergleich von 16 PK Booster-Studien stellten Hill et al. fest, dass sich die PIs in zwei Gruppen unterteilen lassen: Saquinavir (SQV), Fosamprenavir (FPV) und Darunavir (DRV) gehören zu den PIs, die unabhängig von der RTV-Dosis geboostert werden. Atazanavir (ATV) wurde auch hierzu gezählt, doch für eine endgültige Einteilung war die Datenlage noch nicht ausreichend. Lopinavir (LPV), Tipranavir (TRV) und Indinavir (IDV) wurden abhängig von der RTV-Dosis geboostert. In einer Meta-Analyse zeigten ansteigende RTV-Dosen und nicht LPV-Dosen eine Proportionalität zu ansteigenden LPV-AUC, -Cmax und -Cmin. Daraus resultiert, dass unter LPV/r 400/100 mg BID höhere LPV-Spiegel gemessen werden als unter LPV/r 400/50 mg BID.4
Integrasehemmer sind anders
Bisher wurde die Dosis-Wirkungsbeziehung einer effektiven Therapie zugrunde gelegt, d.h. Ctrough wurde als Indikator für die Wirksamkeit der Therapie herangezogen. Dieses Prinzip scheint für RAL nicht zu gelten. In-vitro und in-vivo Studien zeigten keine Beziehung zwischen der Wirksamkeit und Ctrough. Das klinische Outcome korrelierte nicht mit den gemessenen C12h-trough-Konzentrationen. Hier wird an Erklärungsmodellen gearbeitet. Bekannt ist, dass das Enzym Integrase und die virale DNA den Präintegrationskomplex bilden und dieser veränderte Komplex in den Zellkern transportiert wird, wo die irreversible Integration der viralen DNA an die Wirts-DNA stattfindet. Dieser letzte Schritt wird durch RAL spezifisch gehemmt.
Entscheidend:
Inhibitorisches Fenster
Grobler et al. zeigten in Washout-Studien, dass RAL den Wildtyp-HIV-1 nur dann blockiert, wenn RAL während eines relativ kurzen Zeitfensters nach der Vervollständigung der reversen Transkription präsent ist. Die Verweildauer („inhibitorisches Fenster“) an dem Integrase/DNA-Komplex beträgt für RAL 4-12h und ist mit der Halbwertszeit des Präintegrationskomplexes in der Zelle vergleichbar bzw. übersteigt sie. Dieses Phänomen wird auch postantibiotischer Effekt genannt. Die Integrase-N155h-Mutation beschleunigt in viralen Replikationsassays die Dissoziation von RAL um das 10-fache. Dabei geht der inhibitorische Effekt verloren. Der zweite Generations-Integrasehemmer InSTI MK2048, der auch RAL-Resistenzen hemmt, besitzt eine signifikant längere Verweilzeit an der Integrase als RAL. Auch hier ist die Dissoziationsrate unter der N155h Mutation erhöht, aber die Halbwertszeit entspricht immer noch der von RAL. Die Kernaussage des Autors war, dass eine ausreichende Verweildauer des Integrasehemmers auf dem Integrase/DNA-Komplex die Integration mit einem „one-shot“ irreversibel inhibieren kann.
Kombinationspartner für Raltegravir
Entscheidend für die Wirksamkeit von RAL sind somit die aktiven Substanzpartner, die auf das Resistenzprofil des individuellen Patienten abgestimmt werden müssen. Diskutiert wurde die Notwendigkeit einer hohen genetischen Barriere der Partner (z.B. PI/rs), da die von RAL im Mittelfeld liegt.
Bei der Vorstellung der Studienergebnisse von Ripamonti D et al. zur Kombination von RAL mit ungeboostertem Atazanavir (ATV) wurde im Auditorium Kritik laut. Die niedrige genetische Barriere des ungeboosterten PIs wurde besonders bei vorbehandelten Patienten als riskant eingeschätzt, zumal Säureblocker die ATV-Spiegel noch zusätzlich senken können.
Zhu L et al. hatten auf der CROI 2009 Ergebnisse der Kombination ATV 300 mg BID + RAL 400 mg BID an gesunden Probanden vorgestellt. Die ATV-Cmin lag dabei durchschnittlich bei 817 ng/mL (250-1.550 ng/mL) und damit 29% niedriger als ohne RAL.6 Ripamonti D et al. untersuchten die ATV-Spiegel unter ATV 200 mg BID + RAL 400 mg BID an 21 Patienten. Die ATV-C12 war 227 ng/ml (122-332), wobei bei 5 Patienten die ATV C12 unter die minimale effektive Konzentration (MEC) von 150 ng/ml fiel. Bei 62% der Patienten lag die Viruslast zu Beginn und auch nach zwei Wochen <50 Kopien/ml. Kein Patient brach die Therapie ab.7
Bei Salvage-Patienten sind auch Etravirin (ETR) und Darunavir (DRV) interessante Partner für RAL. Tommasi C et al. ermittelten an 29 Patienten mit virologischem Versagen und limitierten Therapieoptionen das Interaktionspotential der drei Substanzen. 11 Patienten nahmen RAL alleine (A), 13 DRV-RAL (B), 5 DRV-RAL-ETR (C) und 5 Patienten fügten nach vier Monaten ETR zu DRV-RAL(D) hinzu. Die RAL-Ctrough-Konzentrationen waren in allen Gruppen gleich. Nur die DRV-Spiegel veränderten sich nach Zugabe von ETR in Gruppe D (3039 + 2103 (B) vs 4633 + 2114 (D)). Das Gleiche galt für ETR. Auch hier stiegen die Ctrough-Spiegel (380 + 131 (C) vs 719 + 388 (D)). Die Autoren erklärten die Spiegelschwankungen durch die gegensätzlichen Effekte von ETR und DRV/r. ETR induziert das Isoenzym CYP 3A4, so dass der Abbau anderer Substanzen über das Enzym beschleunigt wird. DRV/r hemmt das Enzym und damit den Abbau anderer Substanzen. Bei gleichzeitiger Gabe, so schlussfolgerte der Autor, neutralisieren sich die Effekte. Bei Zugabe von ETR zu einem bestehenden DRV/r-Regime herrschte der inhibierende Effekt von DRV/r vor. Die Spiegel beider Substanzen stiegen an.8
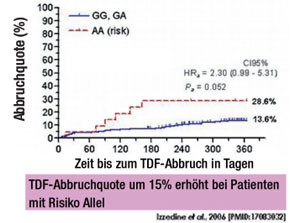
Abb. 1: Einjährige TDF-Abbruchquote (n=500) gemäß genetischem Risiko (Präsentation nach Colombo S)14
Einfluss des Alters
HIV und Alter ist auch bei den Pharmakologen ein aktuelles Thema. C. Flexner, Baltimore, beklagte die schlechte Datenlage. Es gäbe bislang nur wenige Hinweise, dass pharmakokinetische Veränderungen im Alter z.B. bei der Arzneistoffverteilung oder beim Metabolismus über das Isoenzym CYP3A4 bei der HIV-Therapie eine Rolle spielen. Hentig N et al. und Parson T et al. stellten eine Assoziation zwischen dem Alter und den LPV-Spiegeln her, wobei Parson T et al. auf die bessere Adhärenz im Alter hinwies. Das muss noch näher geprüft werden. M Boffito, London, sah die Herausforderung eher in der Polypharmazie durch die altersbedingt vermehrten Komorbiditäten. Für Flexner ist dagegen die renale Clearance der entscheidende Faktor. Die Nierenleistung sinkt bei älteren Frauen stärker ab als bei Männern. Eine entsprechende Dosisanpassung aller NRTIs ist notwendig.
Die daraus resultierenden Fragen, ob Tenofovir (TDF) ein Prädiktor für die tubuläre Dysfunktion ist und welchen Einfluss erhöhte intrazelluläre TDF-Konzentrationen in den renalen proximalen Tubuluszellen bei eingeschränkter Nierenfunktion oder durch den genetischen Polymorphismus ABCC2rs 2273697 haben, blieben offen (Abb. 1).9-12
Literatur
1 Dumond JB et al. Antiretroviral drug exposure in the female genital tract: implications for oral pre- and post exposure prophylaxis. AIDS 2007,21: 1899-1907.
2 Jones A et al. First dose and steady-state pharmacokinetics of raltegravir in the genital tract of HIV uninfected women. Abstract O_06.
3 Letendre S et al. Therapeutic
amprenavir and abacavir con-
centrations in CSF from the
same individuals. AbstractP_18
4 Hill A et al. How much ritonavir is needed to boost protease inhibitors? Systematic review of 16 dose-ranging PK trials.
5 Grobler JA et al. Functionally irreversible inhibition of integration by slowly dissociating strand transfer inhibitors. Abstract O_10.
6 Zhu L et al. Pharmacokinetics and safety of twice daily atazanvir 300 mg and raltegravir 400 mg in healthy subjects, Abstract 696. CROI 2009 8.-11.2.2009 Montreal.
7 Ripamonti D et al. Steady-state pharmacokinetics of atazanavir 200 mg BID when combined with raltegravir 400 BID in HIV-1 infected adults. Abstract O_14.
8 Tommasi M et al. Pharmacokinetics of darunavir/ritonavir, raltegravir and etravirin co administered in HIV-1-infected patients. Abstract O_11
9 Flexner C et al. The effect of Aging on Human Pharmacology. Presentation I_08
10 Von Hentig N et al. Factors related to very high lopinavir plasma concentrations in an unselected outpatient cohort of HIV-1 infected adults. Abstract P_43
11 Parson T et al 6th IWCPHIVT,2005, abstract 40
12 Kiser J et al. Clinical and genetic determinants of intra-
cellular tenofovir diphosphate concentrations in
HIV-
infected patients. Acquir
Immune Defic Syndr 47: 298-303
13 Boffito M &Taylor S. Clinical Case presentation
14 Colombo S et al. Association of pharmacogenetic markers with premature discontinuation of first-line ART, Abtract O_03











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
