Matthias Stoll, Hannover
Dogma-Dämmerung – Wirkt die Monotherapie doch dauerhaft?
Während im Jahre 1999 gerne auch bei 800 Helferzellen und einer Viruslast unter 1.000 Kopien/ml symptomlose Patienten vorsorglich behandelt wurden, war es im Jahre 2004 zuweilen schwierig, selbst bei 200 Helferzellen und Beschwerden gegenüber dem Patienten den Beginn der antiretroviralen Behandlung durchzusetzen. Im Gegenteil, funktionierende Behandlungen wurden im großen Stile in unterschiedlichsten Rhythmen und rückblickend mit recht abenteuerlichen Begründungen „strukturiert pausiert“. Mittlerweile bewegt sich das Pendel des Therapiebeginns aus verschiedensten Gründen wieder hin zu früheren Phasen der Infektion.
Warum Monotherapie?
Gründe, warum die Diskussion zur antiretroviralen Monotherapie wieder aufkommt, sind:
- Die Durchführung einer antiretroviralen Monotherapie widerspricht einem Dogma, das schon vor Einführung der HAART aufkam. Die CONCORDE-Studie (Concorde 1994) zeigte, dass der Benefit einer früh eingeleiteten (AZT-)Monotherapie gewissermaßen ins Nichts verpuffte. Wenig später konnte eine drückende Überlegenheit der Kombinationstherapien gezeigt werden (Hammer 1997).
- Die langfristige Durchführung einer HAART scheitert in einem Teil der Fälle an deren Toxizität – und ein minimalistischer Ansatz könnte die Ergebnisse in diesen Fällen günstiger gestalten.
- Durch die zunehmende Ausweitung der Indikation für die antiretrovirale Therapie steigt der Kostendruck und damit die Bereitschaft, das Individuum mit dem minimal vertretbaren Aufwand zu versorgen.
- Wenn der Therapiebeginn künftig nicht mehr allein von der medizinischen Indikation des individuell behandelten Patienten bestimmt wird, sondern aus Gründen der Transmissionsprophylaxe vorverlegt wird, ergibt sich schon aus ethischen Gründen ein zusätzlicher Bedarf, eine Option mit dem minimal vertretbaren Aufwand anbieten zu können.
Rückblick
Sicherlich ist eine Diskussion um die Optionen einer Monotherapie mit geboosterten Proteinaseinhibitoren nicht (allein) vom neuen Paradigma des früheren Therapiebeginns angefacht worden. Deshalb soll an dieser Stelle ein Überblick über die bisherigen Daten zur Monotherapie gegeben werden. Der Siegeszug der Proteinaseinhibitoren hat damit begonnen, dass Ende der 1990er Jahre die Überlegenheit der Kombinationstherapie gezeigt wurde (Hammer 1997). Damals hatten die Optimisten unter uns noch an eine kurative Option der HAART geglaubt und vorhergesagt, dass nach zwei bis drei Jahren die antiretrovirale Therapie ganz abgesetzt werden könne. Immerhin wurden auch schon damals Deeskalationsstudien durchgeführt. Sie erbrachten allesamt das Ergebnis, dass selbst die Patienten, die schon längere Zeit unter HAART mit ihrer Viruslast unterhalb der Nachweisgrenze waren, früher einen Rebound hatten, wenn beispielsweise auf eine Monotherapie mit dem Proteinaseinhibitor Indinavir deeskaliert wurde (Havlir 1998).
Erste Studien zu klein und zu kurz
Ermutigt durch die Zugewinne an Wirksamkeit und Forgivingness, die die Einführung der geboosterten Proteinaseinhibitoren mit sich brachte, wurden wenig später erneut Studien zur Monotherapie, teilweise auch in der Erstlinienbehandlung durchgeführt. Erste Ergebnisse davon wurden teilweise in Vorabanalysen (out of protocol mit sehr kurzer Nachbeobachtungszeit und unvollständig dokumentierten Patienten) in einer unerträglichen, marktschreierischen Art und Weise auf Kongressen präsentiert, die es schwer machte, sich dem Thema unvoreingenommen und ohne die Sorge um Selbstbeschädigung der eigenen wissenschaftlichen Reputation zu nähern. Dankenswerterweise haben dies aber doch eine ganze Reihe von Arbeitsgruppen in seriöser Weise getan, wenn auch bedauerlicherweise fast ausschließlich in (zu) kleinen Studien. Die Ergebnisse waren dementsprechend heterogen, ließen kaum Schlüsse zu und die meisten Autoren schlussfolgerten daher lediglich übereinstimmend, dass nun eine noch größere Studie gemacht werden müsse.
Mono-PI in der Firstline unterlegen
Einen recht guten Einblick in die Monotherapie mit geboosterten Proteinaseinhibitoren (ATV/r, IDV/r, LPV/r und SQV/r) bietet ein kürzlich erschienener systematischer Review (Bierman 2009). Von den 22 zitierten Arbeiten verglichen aber leider nur sechs randomisierte Studien die Monotherapie direkt mit dem Standard of Care (HAART) und trotz der hohen Zahl an Studien waren es insgesamt nur 582 Patienten. Meist war LPV/r eingesetzt worden.
Die Analyse zeigte, dass die Mono-PI/r-Therapie als Erstlinienbehandlung einer Tripel-HAART unterlegen war. Als Deeskalation in einer Induction(=HARRT)/Maintenance(=PI/r-Mono)-Strategie konnte hingegen auch in der Metaanalyse keine klare Unterlegenheit gezeigt werden. In einigen Studien wurde unter der PI-Monotherapie virologisches „Versagen“ häufiger beobachtet. Grund hierfür war ganz überwiegend eine „low-level Replikation“, meist unter 200 oder zumindest unter 500 Kopien/ml Plasma. Nur in ganz wenigen Fällen kam es zu Resistenzen gegen Proteinaseinhibitoren. Zudem fiel die Viruslast bei Patienten, die unter alleiniger Protease-Inhibitor Therapie virämisch wurden und wieder auf HAART umgestellt wurden, in der Regel erneut unter die Nachweisgrenze.
Erfolgreiche Deeskalation
Auf der IAS Konferenz in Kapstadt wurden nunmehr zwei größere Studien zur Monotherapie mit geboosterten Darunavir vorgestellt, randomisiert, doppelblind, multizentrisch, jeweils mit großer Fallzahl (zusammen n=482): Die Studien MONET und MONOI (Arribas 2009, Katlama 2009). MONET war vom Unternehmen Tibotec und MONOI von den Autoren initiiert worden. Die Patienten waren unter laufender antiretroviraler Therapie bei Studieneinschluss komplett virologisch supprimiert und naiv für DRV/r.
MONET zeigte eine Nichtunterlegenheit des DRV/r-Mono-Arms. In MONOI hatte die Monotherapie diese in der ITT-Analyse knapp verfehlt. Die Nichtunterlegenheitgrenze betrug -10%, das Ergebnis war -11% . In der AT-Analyse hat die Monotherapie jedoch das Ziel erreicht (94,1% vs 99,0%) (Abb. 1 und 2).
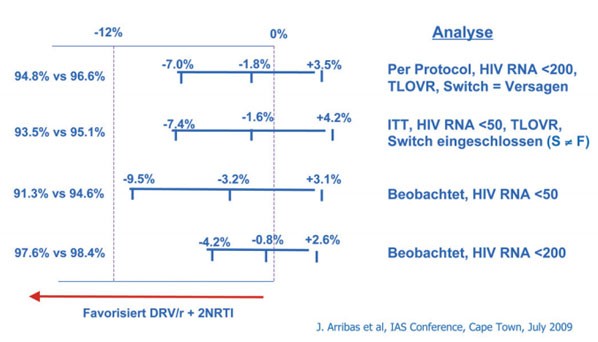
Abb. 1: MONET-Studie (Arribas, 2009): Nachweis der
virologischen Nicht-Unterlegenheit bis Woche 48. Sensitivitätsanalyse für
verschiedene Endpunkte und Annahmen
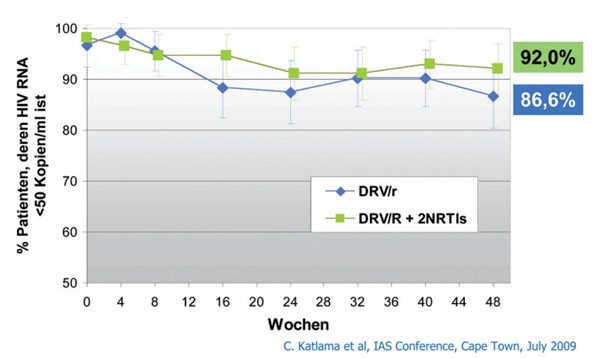
Abb. 2: MONOI-Studie (Katlama, 2009): Anteil der Patienten
mit einer Plasmavirämie unter der Nachweisgrenze (50 cp/ml, ITT) bis Woche 48
Interessanterweise kam es unter Darunavir Monotherapie gegenüber der HAART nicht häufiger zu Fällen mit virologischer Low-Level-Replikation, wie dies in mehreren Mono PI/r-Studien mit anderen geboosterten Proteinaseinhibitoren beschrieben worden war. Die meisten Fälle, die im Beobachtungszeitraum virologisch versagten, hatten aber eine niedrige Virusreplikation – unabhängig von der Zuordnung zum Therapiearm. Wesentliche Unterschiede in der Toxizität wurden nicht beschrieben.
Aufgrund dieser Datenlage wankt das bisherige Dogma, dass die Therapieintensität einer HAART bei der Reduktion auf eine Monotherapie in jedem Falle suboptimal ist. Offensichtlich sind geboosterte Proteinaseinhibitoren, – derzeit am besten belegt für DRV/r – eine geeignete Option, eine einmal erreichte virologische Suppression zumindest für 48 Wochen aufrecht zu erhalten. Man darf hier gespannt auf ein längeres Follow-up und auf weitere Subanalysen sein.
Cave: Langzeiterfahrung fehlt
Schon jetzt könnte das Konzept der geboosterten Mono-PI/r Maintenance eine viel versprechende Option für Patienten mit langfristigen Unverträglichkeiten gegen Nukleosidanaloga unter laufender HAART sein. Diese Patienten sind aber möglicherweise nicht so häufig für viele Monate stets unter der Nachweisgrenze gewesen, wie dies für die handverlesenen Teilnehmer der hier vorgestellten randomisierten Studien galt.
Vor einem generellen Umsetzen aller erfolgreich behandelten Patienten auf eine Mono PI/r-Kombination muss man derzeit noch warnen. Bisher fehlen vor allem noch ausreichende Langzeiterfahrungen. Diese Überlegung gilt in gleicher Weise für „trendige“ Behandler wie für kostendruckgetriebene Krankenkassenvertreter.
Eine Auflistung der grundsätzlichen Argumente des Für und Wider zur Monotherapie mit geboosterten Proteinaseinhibitoren findet sich in Tabelle 1.
|
| Pro | Contra |
|---|---|---|
| Evidenzgrad | • Einzelne kleinere Studien sprechen für eine vergleichbare Wirksamkeit zur HAArt als Maintenance einer zuvor durch HAArt induzierten virologischen Kontrolle • zusätzlich zeigen zwei größere Studien nicht unterlegenheit von drV/r (2009 auf dem iAS-Kongress präsentiert) | • Mehr Evidenz für HAArt
• unterlegenheit der Mono-Pi/r Strategie als
antiretrovirale Induktionstherapie in zahlreichen
(kleineren) Studien und einer Meta-Analyse gezeigt • Kaum langzeitdaten vorhanden |
| Klinische Wirksamkeit und virologische Potenz | • Kurzfristig als Erhaltungstherapie vergleichbar zur HAArt | • Einige Ergebnisse statistisch wackelig (Monoi- Studie), fehlende langzeitdaten |
| toxizität | • Hohes Potenzial von limitierenden langzeitneben- wirkungen der nukleosidanaloga • geringere toxizität zu erwarten: Pi/r werden nicht höher dosiert als in HAArt regimen, aber nukleosidanaloga werden eingespart. | • im Falle von individueller unverträglichkeit (z.b. für den booster) wären Pi/r auch als Mono- therapie die schlechtere option |
| resistenzinduktion | • im Falle des Versagens unter Mono-Pi/r meist keine
genotypische resistenz. • im Falle des Versagens unter divergenter HAArt häufig auch nachweisbare resistenz gegen die Substanzklasse(n) im regime mit der geringeren resistenzbarriere (nukes oder nnrti) | • Potenziell häufigeres (low-level-replikation) therapieversagen unter Mono Pi/r (n.b.: gilt offenbar nicht für drV/r-Monotherapie: 48-Wochen-daten) |
| nachfolgeoption nach virologischem Versagen | • Alle nachfolgeoptionen bleiben offen. • Sogar Pi/r können meist weiter eingesetzt werden. | • langzeitwirksamkeit der nachfolge-HAArt nach dem Versagen der Mono-Pi/r-therapie ist bisher nicht belegt. |
| Kosten | • direkte Kosten ca. 1/3 niedriger | • Einspareffekte von Mono-Pi/r im Vergleich zu
nnrti/nuke-basierter HAArt nur gering. • Mögliche nachfolgekosten im Falle eines Scheiterns der Mono-Pi/r Strategie bisher spekulativ. |
| Pill-burden/convenience (Einzunehmende tägliche zahl der Pillen/Einnahme- zeitpunkte) |
| • Pill burden der Mono Pi/r-optionen oft höher als bei etablierter divergenter nnrti-basierter HAArt |
| Forgivingness (langzeit- auswirkungen von Einnah- mefehlern) | • Verzögerte genotypische resistenz gegen Pi im Falle des Versagens von Pi/r als Monotherapie | • geringere Forgivingness als bei nnrti-basierter divergenter HAArt (daten aus dem Vergleich Pi/r- gegenüber nnrti/r-basierter konventioneller HAArt) |
| Folgen einer zusätzlichen therapieoption Mono-Pi/r | • Abnahme der behandlungsoptionen im Falle der Priorisierung des Wirtschaftlichkeitsgebotes | • zunahme der behandlungsoptionen im Sinne einer
optimierten, individualisierten therapie. • Mehr Verhandlungsspielraum für Kostenträger |
Tab. 1: Pro und Contra der Mono-PI/r als Alternative zur kombinierten, divergenten HAART
1 Arribas JR, A Horban, J Gerstoft, G Fätkenheuer, M Nelson, N Clumeck, F Pulido, A Hill, Y van Delft, C Moecklinghoff, T Stark for the MONET Study Group: The MONET trial: darunavir/ritonavir monotherapy shows non-inferior efficacy to standard HAART, for patients with HIV RNA <50 copies/mL at baseline. Late-Breaker presentation at 5th IAS Conference, Cape Town, South Africa, July 2009, Abstract TUAB106-LB
2 Bierman WF, van Agtmael MA, Nijhuis M, Danner SA, Boucher CA. HIV monotherapy with ritonavir-boosted protease inhibitors: a systematic review. AIDS 2009;23:279-91.
3 Concorde: MRC/ANRS randomised double-blind controlled trial of immediate and deferred zidovudine in symptom-free HIV infection. Concorde Coordinating Committee. Lancet 1994;343:871-81.
4 El-Sadr WM, Lundgren JD, Neaton JD, et al. CD4+ count-guided interruption of antiretroviral treatment. N Engl J Med 2006;355:2283-96.
5 Hammer SM, Squires KE, Hughes MD, et al. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less. AIDS Clinical Trials Group 320 Study Team. N Engl J Med 1997;337:725-33.
6 Havlir DV, Marschner IC, Hirsch MS, et al. Maintenance antiretroviral therapies in HIV infected patients with undetectable plasma HIV RNA after triple-drug therapy. AIDS Clinical Trials Group Study 343 Team. N Engl J Med 1998;339:1261-8.
7 Katlama C, MA Valantin, M Algarte-Genin, C Duvivier, S Lambert-Niclot, PM Girard, JM Molina, B Hosten, S Pakianather, G Peytavin, AG Marcelin, P Flandre: MONOI ANRS 136 study - A randomized multicenter study to compare the efficacy of a monotherapy of darunavir to a triple therapy with 2 nucleosides analogues combined to darunavir/r in HIV infected patients with full viral suppression. Late-Breaker presentation at 5th IAS Conference, Cape Town, South Africa, July 2009, Abstract WELBB102-LB










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
