Nils Postel 1 , Kathrin Tintelnot 2 , Stephan Dupke 3 , Keikawus Arastéh 1 , Berlin
Aids ist nicht tot!
Wie man auch heute noch vier Pneumonien gleichzeitig haben kann
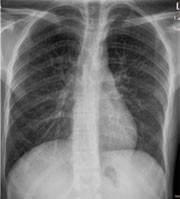
Abb. 1: PCP-Ausgangsbefund
28.7.2009
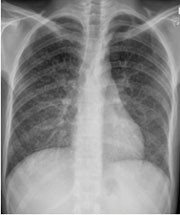
Abb. 2: Verschlechterung Histoplasmose, Besserung PCP 11.8.2009
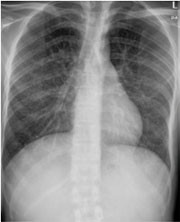
Abb. 3: Allmähliche Besserung nach 4-fach-Pneumonie-Therapie 17.8.2009
HIV-Patienten mit schweren opportunistischen Infektionen lassen sich meist zwei großen Gruppen zuordnen. Zur ersten, größeren Gruppe gehören intravenöse Drogenkonsumenten (IVDU), die auf Grund von Komorbidität (psychiatrisch, hirnorganisch, aktive Suchterkrankung) und wegen schwerwiegender psychosozialer Probleme die ART gar nicht oder nur sehr unregelmäßig einnehmen können. Bei der zweiten Gruppe handelt es sich um schwule oder bisexuelle Männer (MSM), die ungetestet erkrankt sind oder wegen einer Vielzahl von Gründen keine HIV-spezifische medizinische Versorgung in Anspruch genommen haben (Verdrängung/Verleugnung, Angst vor Diskriminierung, unklarer Versicherungsstatus, unklarer Aufenthaltsstatus). Beiden Gruppen gemeinsam ist, dass die HIV-Infektion auch in Zeiten einer stetig weiterentwickelten ART einen natürlichen Verlauf nimmt – mit opportunistischen Erkrankungen und bisweilen gar Tod. Zu letzterer Gruppe gehört ein 22-jähriger Thailänder, über dessen Kasus im Folgenden berichtet wird.
Vorgeschichte
Seit 2005 ist bei dem seit zwei Jahren mit einem Deutschen verpartnerten Mann eine HIV-Infektion bekannt. Aus Scham und Angst, verlassen zu werden, hat er sich seinem Partner jedoch nicht anvertraut. Um nicht entdeckt zu werden, hat er in Deutschland keinen ärztlichen Rat gesucht und selbst dann nicht von seiner HIV-Infektion berichtet, als er mit subfebrilen Temperaturen, Gewichtsverlust, Dyspnoe und starkem (produktivem!) Husten in eine pulmonologische Klinik eingeliefert worden war. Dort wurde erneut die HIV-Infektion festgestellt. Später wurde der Patient auf eigenen sowie auf Wunsch des Partners ins Vivantes Auguste-Viktoria-Klinikum (AVK) verlegt.
Verlauf
Bei stationärer Aufnahme waren in der Lungenklinik bereits eine Pneumocystis-jiroveci- und eine CMV-Pneumonie diagnostiziert worden. Erstere war zum Aufnahmezeitpunkt im AVK seit zwölf Tagen mit Cotrimoxazol 1.200-1.600-1.200 mg/d, letztere mit Ganciclovir 2x 5 mg/kgKG/d behandelt worden – allerdings ohne signifikante Besserung. Die Therapie wurde mit Cotrimoxazol 4x 1.920 mg/d und die CMV-Therapie unverändert über weitere 14 Tage fortgeführt. Klinisch kam es nach insgesamt 30 Tagen zu einer deutlichen Besserung. Auch die arterielle Blutgasanalyse besserte sich, nur in der Röntgen-Thorax-Kontrolle war noch ein „deutlicher Restbefund wie bei PcP“ zu sehen (siehe Abb. 1). Auf Grund der klinischen Besserung war die Entlassung des Patienten bereits geplant.
Nochmals BAL
Kurz vor Entlassung traten aber dann erneut subfebrile Temperaturen und später Fieber auf. Die Laktatdehydrogenase (LDH) stieg an auf 300 U/l. Die im Rahmen der FUO-Diagnostik (Fever of unknown Origin) durchgeführte Knochenmarkspunktion ergab keinen wegweisenden Befund. Von den Kollegen der Lungenfachklinik war im Rahmen der Routinediagnostik eine Untersuchung auf Histoplasma capsulatum im Urin durchgeführt worden. Die PCR war positiv (s. Kasten „Histoplasmose“), die Serologie jedoch negativ.
Auf Grund der klinischen Befundverschlechterung wurde erneut eine Bronchoskopie durchgeführt. In der Lavage fanden sich eine sehr hohe CMV-Viruslast von >100.000 Kopien/ml, in der Kultur wuchs E. coli und es zeigte sich ein erheblicher Befall mit Histoplasma capsulatum. Aus diesem Grund wurde der Patient über 21 Tage (und nicht leitliniengerecht über 14 Tage) mit liposomalem Amphotericin B 5 mg/kgKG/d behandelt. Diese Therapie wurde abgesehen von einer ausgeprägten Hypokaliämie und gelegentlichen stechenden thorakalen Schmerzen problemlos vertragen. Die auch im post-BAL-Sputum bestätigte E. coli-Pneumonie wurde antibiogrammgerecht mit Ceftriaxon 2 g/d behandelt. Gleichzeitig wurde die CMV-Akuttherapie wieder aufgenommen, zunächst über 14 Tage intravenös. Dann wurde bei äquivalenter Dosierung auf Valganciclovir umgestellt; nach neun Tagen erfolgte die Deeskalation auf 900 mg/d. Der Patient stabilisierte sich klinisch zunehmend und die objektiven Parameter besserten sich.
ART-Beginn
Am 17. Tag des stationären Aufenthaltes und 28 Tage nach Behandlungsbeginn der opportunistischen Infektionen – und damit nach Studie ACTG 5164 (s. Kasten) zu spät – wurde eine antiretrovirale Therapie mit Tenofovir, Emtricitabin und Efavirenz eingeleitet. Die Viruslast vor Therapiebeginn betrug 184.000 Kopien/ml, die CD4-Zellen lagen bei 70/µl (15%). Abgesehen von Sekundärmutationen und Polymorphismen im Protease-Gen handelte es sich um Wildtyp-Virus. Bereits nach drei Wochen ART war die Viruslast auf 510 Kopien/ml abgefallen (>2log).
Wieder Verschlechterung
Diagnosen
- Pneumocystis-jiroveci-Pneumonie
- CMV-Pneumonie
- pulmonale Histoplasmose
- bakterielle Pneumonie durch E. coli
- atypische Mykobakteriose durch M. kansasii
- oropharyngeale Candidose
ACTG 5164: Optimaler Zeitpunkt der ART bei OI
Die Studie ACTG 5164, die auf der CROI 2008 vorgestellt wurde, ist eine randomisierte Phase IV-Strategie-Studie, die sich mit dem optimalen ART-Beginn im Rahmen einer akuten opportunistischen Infektion beschäftigt. 282 Patienten erhielten entweder zwölf oder 45 Tage (Median) nach Behandlungsbeginn ihrer opportunistischen Infektion (in 63% der Fälle PcP, 13% Kryptokokken-Meningitis, Tbc ausgeschlossen) eine leitliniengerechte ART. Im Frühbehandlungs-Arm traten nach 48 Wochen Beobachtungszeit signifikant weniger Aids-bedingte Todesfälle bzw. neue Aids-Diagnosen auf und auch der CD4-Anstieg war schneller. In beiden Armen wurden gleich viele Nebenwirkungen und IRIS-Fälle beobachtet.
Trotz dieser zunächst positiven Entwicklung traten abermals Fieberschübe auf und der Patient verlor weiter an Gewicht. Schließlich traf nach sechs Wochen Bebrütungszeit der Befund der Tuberkulose-Kultur aus dem Sputum ein. Mycobacterium kansasii war gewachsen. In der klinischen Gesamtschau handelte es sich somit am ehesten um eine klinisch relevante atypische Mykobakteriose, möglicherweise auch im Rahmen eines beginnenden Immunrekonstitutions-Syndrom (IRIS). Trotz fraglicher Signifikanz des Erreger-Nachweises (kein Nachweis aus sterilem Medium, BAL und Magensaft negativ) erhielt der Patient eine Therapie mit Azithromycin, Rifabutin und Ethambutol in typischer Dosierung. Hierunter entfieberte er endgültig. Transaminasen und alkalische Phosphatase normalisierten sich, der Gewichtsverlust sistierte.
Die Histoplasmose-Therapie war nach der interavenösen Amphotericin-Gabe auf Itraconazol 3x 200 mg/d umgestellt worden.
Ambulante Versorgung
In der ambulanten Weiterbetreuung stellte sich unter Erhaltungstherapie mit Valganciclovir eine schwere Neutropenie ein (neutrophile Granulozyten 450/µl). Bei negativer CMV-PCR im Blut wurde die CMV-Therapie beendet und die schwere Neutropenie wurde einmalig mit Granulozyten-stimulierendem Faktor behandelt. Im weiteren Verlauf blieben die Granulozyten im unteren Normbereich. Bei Spiegelmessungen fanden sich für Itraconazol subtherapeutische Werte, der Efavirenz-Spiegel lag im Normbereich, der Rifabutinspiegel war dagegen stark erhöht. Angesichts des niedrigen Itraconazol-Spiegels durch die Interaktion mit Rifabutin sowie der nicht sicheren Signifikanz des M. kansasii-Nachweises wurde Rifabutin abgesetzt und mit einer 2-fach-Therapie (Ethambutol, Azithromycin) weiterbehandelt. Bei erneuter Messung lag der Itraconazol-Spiegel dann schließlich im therapeutischen Bereich. Die Itraconazol-Therapie wurde wegen der anfangs subtherapeutischen Spiegel 14 statt wie empfohlenen zwölf Wochen fortgesetzt. Die Zahl der CD4-Zellen des Patienten stieg und liegt aktuell bei 170/µl, die Viruslast ist noch nicht ganz supprimiert (300 Kopien/ml). Eine Resistenzbestimmung wird gegenwärtig durchgeführt. Der Patient ist beschwerdefrei. Bei der letzten Röntgen-Thorax-Kontrolle fand sich nur noch ein geringgradiger Restbefund.
1 Dr. med. Nils Postel und PD
Dr. med. Keikawus Arastéh, Vivantes Auguste-Viktoria-Klinikum, Berlin
2 Dr. med. Kathrin Tintelnot,
Robert-Koch-Institut, Berlin
3 Dr. med. Stephan Dupke,
Gemeinschaftspraxis Driesener Straße, Berlin
Kommentar aus dem Konsiliarlabor für Histoplasma capsulatum
Epidemiologie
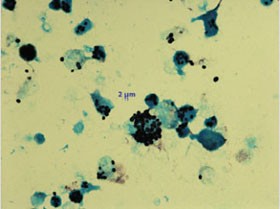
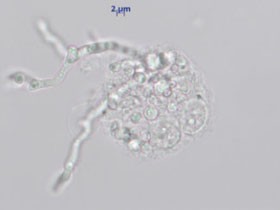
Abb. 1 und 2: Mikroskopie nach bronchioalveolärer Lavage (BAL).
Abb. 1: Erreger intrazellulär in Makrophagen
nach Versilberung. Abb. 2: Ebenfalls intrazelluläre Erregger in einer 4 Tage
bei 26°C inkubierten Anreicherung (ungefärbt). Hier sind bereits auskeimende
Pilzzellen erkennbar.
In Mitteleuropa diagnostizierte Infektionen durch Histoplasma capsulatum sind selten, da sie bei Immunkompetenz überwiegend subklinisch bzw. selbstlimitierend verlaufen. Von wenigen Ausnahmen abgesehen werden Histoplasmosen aus Endemiegebieten, v.a. aus Mittel-, Süd- und Nordamerika, Afrika und Asien (Thailand) importiert. Aufgrund einer möglichen Erregerpersistenz im RES ist bei späterer Immunschwäche eine Reaktivierung noch nach Jahrzehnten möglich. CD4-Zahlen <200/ µl sind prädisponierend für eine disseminierte Histoplasmose. Diese sind Aids-definierend, lebensbedrohlich, doch bei rechtzeitiger Diagnose heilbar. Da Histoplasmosen unter HAART in Deutschland so selten geworden sind (mutmaßlich <10 Fälle von Histoplasmose bei Aids-Patienten/Jahr) werden sie in Mitteleuropa differentialdiagnostisch zu selten erwogen, sodass die Diagnose nicht selten post mortem gestellt wird. Alle am RKI in den letzten Jahren kulturell bestätigten Histoplasmosen bei HIV-Infizierten betrafen Aids-Patienten mit disseminierter Infektion.
Diagnostik
Die Diagnostik beginnt damit, an eine importierte Systemmykose zu denken. Aufgrund der möglichen Reaktivierung sollte eine Histoplasmose bei jedem Patienten im Stadium Aids, der jemals in einem Endemiegebiet für H. capsulatum war (Langzeit-Reise-Anamnese !), bei unklarem Antibiotika-refraktärem Fieber, Haut- und pulmonalen Herden, Hepatosplenomegalie, Schleimhaut-Ulcera – auch im Gastrointestinaltrakt – abgeklärt werden.
Der direkte Erregernachweis, z.B. aus Bioptaten, ist in jedem Fall anzustreben.
H. capsulatum ist bei einer generalisierten Infektion zu 72-90% aus dem Knochenmark, in 57-91% aller Fälle aus Blutkulturen anzüchtbar. Bei pulmonaler Manifestation ist der Erregernachweis aus BAL möglich. Eine ausführliche Mikroskopie versilberter Präparate von Untersuchungsmaterial kann u.U. innerhalb weniger Stunden die Verdachtsdiagnose liefern, die dann molekularbiologisch und kulturell bestätigt werden sollte. Cave: histologisch kann die Histoplasmose mit einer Leishmaniose verwechselt werden.
Die diagnostische Wertigkeit von Testen zum Histoplasma-Antigennachweis bzw. einer Histoplasma-spezifischen PCR zur Diagnosestellung und Verlaufskontrolle bei Histoplasmose wird noch kontrovers diskutiert.
Da kommerzielle Teste zu Histoplasma-Antigen-Nachweis aus Serum und/oder Urin noch nicht zur Verfügung stehen, werden zunehmend molekularbiologische Methoden zum Infektionsnachweis eingesetzt. Eindeutige Aussagen zur Wertigkeit einer Histoplasma-PCR aus Urin sind z.Z. noch nicht möglich, da diese in-house-Teste bislang nicht ausreichend evaluiert sind.
Ein Antikörpernachweis gegen Histoplasma capsulatum ist nur bei weniger als der Hälfte der Patienten mit disseminierter Histoplasmose möglich. Im positiven Fall können spezifische Antikörper gegen H. capsulatum zumindest auf eine abgelaufene Infektion und das Gefährdungspotential für eine Dissemination bei sinkenden CD4-Zahlen hindeuten.
Infektionsrisiko
Immer wieder wird nach dem Risiko, welches von einem Patienten mit florider Histoplasmose für Mit-Patienten, Pflege-Personal oder Ärzte ausgeht, gefragt. Anders als bei einer Infektion durch manche Hautpilze, z.B. Trichophyton tonsurans, wird eine Histoplasmose nicht von Mensch zu Mensch übertragen. Die Erreger wachsen intrazellulär in ihrer Hefe-Phase, ein Risiko besteht letztlich nur für Transplantat-Empfänger eines unerkannt an Histoplasmose erkrankten Organ-Spenders, im Sektions-Saal oder für Menschen, die im mikrobiologischen Labor tätig sind.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
