Rainer Jordan, Witten
Orale Manifestationen in der HAART-Ära – Nichts Neues?

Abb. 1: EC-Clearinghouse-Klassifikation oraler Läsionen bei der HIV-Infektion (Axéll et al. 1993)
Orale Manifestationen im Zusammenhang mit HIV wurden bereits zu Beginn der weltweiten Epidemie berichtet und waren — historisch betrachtet — häufig eine Erstmanifestation der Progression zu AIDS (Gottlieb et al. 1981), darunter vor allem das Kaposi Sarkom (Mostofi et al. 1985). Da die Abwehrbereitschaft gegenüber vielen oralen Erkrankungen, insbesondere von Parodontalerkrankungen, überwiegend durch die zelluläre Immunität bereit gestellt wird (Plagmann 1998), führt die im Spätstadium zusammenbrechende Immunantwort bei HIV/AIDS auch zu einer erhöhten Prävalenz opportunistischer Infektionen der Mundhöhle. Unter dem Einfluss hochaktiver antiretroviraler Therapieregime lässt sich der natürliche Krankheitsverlauf durch eine viral clearence aus dem Blut chronifizieren. Dies führt zu einer messbaren Immunrekonstitution der Patienten und verhindert den Ausbruch so genannter AIDS-Indikator-Krankheiten (Brodt et al. 1997). Auch orale Manifestationen sind bei antiretroviraler Therapie rückläufig (Jordan et al. 2007), wenngleich auch Hinweise vorliegen, nach denen sie unerwünschte Auswirkungen auf die Mundgesundheit haben kann (Tomar et al. 1995).
Klassifikation
Die mit einer HIV-Infektion assoziierten oralen Manifestationen werden in der seit 1993 gültigen Classification and Diagnostic Criteria for Oral Lesions in HIV Infection nicht weiter nach ihrer Ätiologie eingeteilt, sondern nach ihrer Strenge der Assoziation zur HIV-Infektion (Axéll et al. 1993). Es werden drei Gruppen unterschieden (Abb. 1).
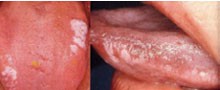
Die klassischen oralen Manifestationen bei natürlichem HIV-Erkrankungsverlauf finden sich überwiegend in der Gruppe 1, jenen Läsionen also, die die höchste Assoziation zur HIV-Infektion aufweisen. Neben dem oralen Kaposi Sarkom zählen hierzu die nekrotisierende ulzerierende Gingivitis und Parodontitis oder die orale Haarleukoplakie. Sie wurde erstmals von Greenspan beschrieben und scheint die einzige für die HIV-Infektion pathognomonische Erkrankung zu sein (Greenspan et al. 1984) (Abb. 2). Erkennbar ist sie an nicht-abwischbaren, zumeist beidseitig auftretenden weißlich-grauen Streifen am lateralen Zungenrand. Ihre Ätiologie durch das Eppstein Barr-Virus gilt als gesichert (Reichart 2003). Unter dem Einfluss einer antiretroviralen Therapie remittieren die Veränderungen in der Regel innerhalb weniger Wochen, wenngleich damit keine EBV-Erradikation verbunden ist. Das bedeutet im Umkehrschluss, dass bei einer Verschlechterung einer immunrekonstitutionellen Situation, wie beim Versagen einer HAART, die Reaktivierung der oralen Haarleukoplakie als klinisches Zeichen erwartbar sein kann.
Pathogenese
Die pathogenetischen Zusammenhänge oraler Manifestationen bei HIV wurden bereits frühzeitig erforscht und liegen in unterschiedlichen Alterationen immunologischer Kaskaden, die für die orale Infektionsabwehr wesentlich sind:
1Bereits im asymptomatischen Infektionsstadium ist die antimikrobielle und antivirale Potenz polymorphkerniger neutrophiler Granulozyten eingeschränkt, insbesondere die Chemotaxis, wohingegen die Phagozytosefähigkeit erhalten bleibt (Ras et al. 1984, Gabrilovich et al. 1991),
2die Aktivität von Monozyten | Makrophagen ist drastisch limitiert (Smith et al. 1984, Perno et al. 1998),
3bedingt durch eine ausgeprägte Disorganisation von Lymphozyten im gingival-parodontalen Gewebe ist die Differenzierung von Plasmazellen auf mitogene Reize gestört mit der Konsequenz einer ausbleibenden Produktion von Immunglobulinen (Steidley et al. 1992, Myint et al. 1999).
So ist die progressive HIV-Infektion in den wesentlichen immunologischen Abläufen sowie im zellulären und humoralen Arm negativ mit wirtseigenen Reaktionsvorgängen gegen pathogene Keime bzw. Vorgänge assoziiert.
4Zunehmende Bedeutung erlangen die spezifischen Aspekte der antiretroviralen Therapie für die Zahnmedizin, da sie unmittelbare Auswirkungen auf die Integrität oraler Strukturen haben kann (Tomar et al. 1995).
Chronische Parodontitis
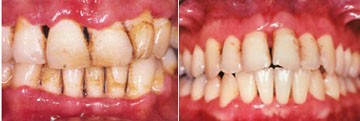
Weil die chronische Parodontitis als kumulative, opportunistische Infektionserkrankung des Zahnhalteapparates neben der Zahnkaries eine der oralen Haupterkrankungen darstellt, und somit auch bei Patienten ohne systemische Hintergründe in hoher Prävalenz auftritt, scheint sie in keiner besonderen Assoziation zur HIV-Infektion zu stehen. Vor dem Hintergrund der oben beschriebenen immunologischen Alterationen kann sie jedoch verstärkt im Zusammenhang mit einer HIV-Infektion auftreten. Daher zählt die American Association of Periodontology sie zu den oralen Risikoerkrankungen bei HIV-Infektion (Burt et al. 1996). Besonders mit der Entwicklung antiretroviraler Therapieoptionen und der damit verbundenen, deutlich verlängerten Überlebenszeit treten weiterhin die akuten Parodontalerkrankungen zu Gunsten chronischer Verlaufsformen in den Hintergrund. Eigene Untersuchungen konnten jedoch zeigen, dass eine konservative Behandlung der chronischen Parodontitis mit anschließender engmaschiger Erhaltungstherapie und überdurchschnittlicher häuslicher Plaquekontrolle im Vergleich zu einer HIV-seronegativen Kontrollgruppe zu ebenbürtigen mittelfristigen Ergebnissen führte (Jordan et al. 2005) (Abb. 3a/b). Inwiefern sich diese Therapieergebnisse langfristig sichern lassen, ist derzeit unbekannt und muss weiter erforscht werden. Die erfolgreiche, frühe Intervention der chronischen Parodontitis bei HIV-Infektion sowie eine unterstützende Parodontitis-Therapie können möglicherweise das Auftreten akuter oder aggressiver gingivoparodontaler Folgezustände bei späterer Immunsuppression verzögern, abmildern oder verhindern. Unter dem Einfluss einer potenten HAART mit Immunrekonstitution kann eine sichere zahnmedizinische Behandlung ohne systemische antibiotische Abdeckung durchgeführt werden, auch wenn es bei der therapeutischen Durchbrechung der Schleimhautbarriere zu einer transienten Bakteriämie kommt (Kinane et al. 2005).
Unerwünschte Arzneimittelwirkungen
Unerwünschte Arzneimittelwirkungen werden gemäß der Klassifikation oraler Erkrankungen in die Gruppe 3 eingestuft, die keiner besonderen Assoziation zur HIV-Infektion mehr unterliegen. Vor dem Hintergrund des klinischen Wandels der HIV-Infektion hin mit veränderten Folgen einer lebenslangen medikamentösen Therapie, scheint es sinnvoll, die Einstufung zu überprüfen. Dabei muss jedoch berücksichtigt werden, dass die Klassifikation zeitlich vor der Einführung der hoch-aktiven antiretroviralen Therapien eingeführt wurde – und seit dem keine Anpassung erfahren hat.
Neben grundsätzlichen zellulären Alterationen, die eine verlängerte Blutungszeit bei chirurgischen Eingriffen bedingen können, führen antiretrovirale Medikamente in verschiedenen Ausprägungen auch in der Mundhöhle zu unerwünschten Manifestationen. Die wissenschaftliche Datenlage hierzu ist allerdings unvollständig und bezieht sich häufig auf Fallberichte. Untersuchungen zeigen jedoch, dass ihr Auftreten die mundgesundheitsbezogene Lebensqualität beeinträchtigen (Yengopal und Naidoo 2008). Direkte unerwünschte Arzneimittelwirkungen antiretroviraler Medikamente auf die Mundhöhle lassen sich nicht auf bestimmte Wirkstoffgruppen reduzieren, insbesondere aufgrund möglicher potenzierender Wirkungen bei obligater Kombinationstherapie. Die bekannten Symptome umfassen:
Orale Ulzera
Orale Ulzera können bei der Einnahme von Abacavir ein Hinweis auf ein mögliches Überempfindlichkeitssyndrom sein. Daher ist eine unmittelbare Abklärung in dieser Kombination alternativlos (Stekler et al. 2006). Die Prävalenz des Überempfindlichkeitssyndroms wurde mit 5% als häufig vorkommende unerwünschte Arzneimittelwirkung angegeben. Dies gilt ebenso für die Kombinationspräparate, in denen der Wirkstoff enthalten ist. In vergleichbarer Prävalenz können orale Ulzera bei Ritonavir auftreten, welches als Booster bei Protease-Hemmer-Kombinationstherapien eingesetzt wird. Als Überempfindlichkeitssymptom sind sie ausschließlich bei Abacavir bekannt.
Speicheldrüsenerkrankungen
Zu dieser Gruppe oraler Manifestationen gehören die Hypersekretion, die Hypertrophie der Glandula parotis sowie die Xerostomie (Shetty 2005). Xerostomie hat sich als Risikoindikator für die Haupterkrankungen in der Zahnmedizin, Zahnkaries und Parodontitis, herausgestellt (Remick et al. 1983) und deren Prävention ist daher bei Patienten mit positivem HIV-Serostatus mit individuellen Maßnahmen der Individualprophylaxe zu bedenken.
Papillome
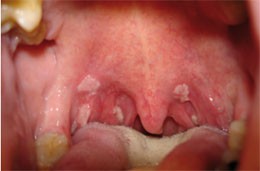
Abb. 4: Condylome am Gaumen
Weitgehend ungeklärt ist der Zusammenhang zwischen der signifikanten Zunahme von oralen Humanes Papillom Virus-Infektionen und antiretroviralen Therapien, die ohne intensive kurative Maßnahmen rasch in der gesamten Mundhöhle disseminieren und dann kaum kurierbar werden (King et al. 2002). Dennoch zeigte sich die Prävalenz bei der Einnahme antiretroviraler Therapiekombinationen inklusive Protease-Hemmer doppelt erhöht im Vergleich zu PI-freien Regimen und um das Sechsfache erhöht im Vergleich zu therapiefreien Patienten (Greenspan et al. 2001).
Dysgeusie
Geschmacksveränderungen im Zusammenhang mit antiretroviralen Therapien sind mit einer Prävalenz von bis zu 10% die häufigsten unerwünschten Arzneimittelwirkungen (Ammassari et al. 2001). Insbesondere die Wirkstoffgruppen Protease-Hemmer und Nukleosidanaloga und Kombinationen, in denen diese Wirkstoffe enthalten sind, scheinen mit Dysgeusien assoziiert zu sein.
Weitere unerwünschte Arzneimittelwirkungen können sein: (Peri)orale Parästhesien, Hyperpigmentierungen der Mundschleimhaut sowie die aphtöse Stomatitis.
Wechselwirkung mit zahnärztlich eingesetzten Arzneimitteln
Aufgrund der inhibierenden Wirkung – besonders der Protease-Hemmer – auf das Cytochrom P450-Isoenzym CYP3A4 können Wechselwirkungen von Bedeutung sein.
Wechselwirkungen mit in der Zahnheilkunde angewandten Präparaten sind bei den Protease-Hemmern sowie nicht-nukleosidalen Reverse Transkriptase-Hemmern zu beachten, die als Leitmedikamente einer hochaktiven antiretroviralen Therapie angehören können. Sie sind maßgeblich begründet in der kompetitiven Hemmung des Cytochrom P450-Isoenzyms CYP3A4. Vier medikamentöse Hauptgruppen sind von Bedeutung.
Psychopharmaka
Sedativa aus der Gruppe der Benzodiazepine, die als Prämedikation und zur Analgosedierung bei Zahnbehandlungsphobie Einsatz finden, werden ebenfalls über das P450-Isoenzym CYP3A4 verstoffwechselt. Die resultierende kompetitive Hemmung der Metabolisierung kann zu einem Anstieg der Plasmakonzentration dieser Arzneimittel führen mit schwerwiegender, lebensbedrohlicher Atemdepression, Vertiefung und Verlängerung der Sedation sowie Arrhythmien. Daher muss eine Personalunion von Anästhesist und Behandler vermieden werden und auch etwaige Prämedikationen durch einen Spezialisten überwacht werden.
Antimykotika
Weil das Auftreten einer Candida-Infektion unter dem Einfluss einer potenten antiretroviralen Therapie unwahrscheinlich ist (Jordan et al. 2007), kann sie insbesondere bei oesophagealer Ausbreitung als klinisches Zeichen auf eine versagende antiretrovirale Therapie hinweisen (Crommentuyn et al. 2004). Wegen Veränderungen in der Pharmakokinetik für Imidazole und deren Derivate unter HAART wird für oralmedizinische Indikationen eine maximale Tagesdosis bis 200 mg empfohlen.
Kortikoide
In der zahnmedizinischen Schmerzbehandlung werden im topischen Einsatz die antiinflammatorischen Wirkungen von Glukokortikoiden in der Endodontie und Parodontologie genutzt. Die über das P450-Isoenzym CYP3A4 metabolisierten Glukokortikoide erhöhen das Risiko systemischer kortikosteroider Wirkungen einschließlich M. Cushing und Suppression der Nebennierenfunktion (Nocent et al. 2004). Obwohl die bekannten Wechselwirkungen bei systemischer Anwendung bekannt sind, ermöglicht der Einsatz von Alternativpräparaten in der Endodontie und Parodontologie eine vergleichbare Akuttherapie und sollte bei Menschen mit therapierter HIV-Infektion vorgezogen werden.
Antiinfektiva
Nitroimidazol-Derivate, wie das in der Parodontologie lokal und als so genannter van Winckelhoff-Cocktail (van Winkelhoff et al. 1989) auch systemisch eingesetzte Metronidazol, können bereits unter geringem Alkoholeinfluss zu starken Unverträglichkeitsreaktionen führen, die auf der Blockierung des Enzyms Aldehyddehydrogenase beruhen. Die Metabolisierung von Alkohol durch die Alkoholdehydrogenase bleibt dann auf der Stufe von Acetaldehyd stehen, so dass sich die Symptome einer Aldehydintoxikation zeigen. Dieser Mechanismus wird als disulfiramartige Reaktion bezeichnet und leitet sich von dem Alkoholentwöhnungsmittel Tetraethylthiuramdisulfid ab. Einige antiretrovirale Kapseldarreichungen enthalten Ethanol in geringen Mengen; ob sie in Kombination mit Nitroimidazol-Derivaten zu einer klinisch relevanten Reaktion führen, ist nicht sicher. Es existieren jedoch für parodontologische Fragestellungen antibiotische Alternativpräparate, auf die ggf. ausgewichen werden sollte.
Mit der veränderten Klinik der HIV-Infektion erfahren auch orale Manifestationen eine Wandlung. Bei therapiefreien Patienten ist die Klassifikation oraler Läsionen bei der HIV-Infektion ein wichtiges diagnostisches Hilfsmittel. Für Patienten unter HAART scheint sie weniger klinische Relevanz zu besitzen. Die Kenntnisse zu unerwünschten Arzneimittelwirkungen sowie Wechselwirkungen haben in der Zahnmedizin dann eine größere Bedeutung.
Literatur
1 Ammassari A, Murri R, Pezzotti P, Trotta MP, Ravasio L, De Longis P, Lo Caputo S, Narciso P, Pauluzzi S, Carosi G, Nappa S, Piano P, Izzo CM, Lichtner M, Rezza G, Monforte A, Ippolito G, d‘Arminio Moroni M, Wu AW, Antinori A. Self-reported symptoms and medication side effects influence adherence to highly active antiretroviral therapy in persons with HIV infection. J Acquir Immune Defic Syndr. 2001;28:445-9.
2 Axéll T, Azul AM, Challacombe S, Greenspan D, Greenspan J, Hämmerle C, Laskaris G, Loeb I, Lucas-Tomas M, Monteil RA, Pindborg JJ, Reichart PA, Robinson P, Scully C, Swango PA, Syrjänen S, Thornhill H, van der Waal I, Williams D, Wray D. Classification and diagnostic criteria for oral lesions in HIV infection. EC-Clearinghouse on oral problems related to HIV infection and WHO Collaborating Centre on oral manifestations of the immunodeficiency virus. J Oral Pathol Med. 1993;22:289-91.
3 Brodt HR, Kamps BS, Gute P, Knupp B, Staszewski S, Helm EB. Changing incidence of AIDS-defining illnesses in the era of antiretroviral combination therapy. Aids. 1997;11:1731-8.
4 Burt BA, Armitage GC, Cochran DL, Cohen RE, Greenstein G, Mariotti A, Rethmann MP, Sommerman MJ, van Dyke TE, Dennison DK, Genco RJ, Hanes PJ, Page RC, Rees TD, Young L. Position Paper. Epidemiology of periodontal diseases. American Academy of Periodontology. J Periodontol. 1996;67:935-45.
5 Crommentuyn K, Mulder J, Sparidans R, Huitema A, Schellens J, Beijnen J. Drug-drug interaction between itraconazole and the antiretroviral drug lopinavir/ritonavir in an HIV-1 infected patient with disseminated histoplasmosis. Clin Infect Dis. 2004;38:73-5.
6 Gabrilovich D, Kozich A, Suvorova ZK, Ivanov VS, Moshnikov SA, Chikin LD, Kolezonkova OV, Pokrovsky VV. Influence of HIV antigens on functional activity of neutrophilic granulocytes. Scan J Immunol. 1991;33:549-52.
7 Gottlieb MS, Schroff R, Schanker HM, Weisman JD, Fan PT, Wolf RA, Saxon A. Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men: evidence of a new acquired cellular immunodeficiency. N Engl J Med. 1981;305:1425-31.
8 Greenspan D, Canchola A, MacPhail L, Cheikh B, Greenspan J. Effect of highly active antiretroviral therapy on frequency of oral warts. Lancet. 2001;357:1411-2.
9 Greenspan D, Greenspan JS, Conant M, Petersen V, Silverman S, de Souza Y. Oral „hairy“ leucoplakia in male homosexuals: evidence of association with both papillomavirus and a herpes-group virus. Lancet. 1984;348:831-4.
10 Jordan RA, Gängler P, Jöhren P. Clinical treatment outcomes of periodontal therapy in HIV-seropositive patients undergoing highly antiretroviral therapy. Eur J Med Res. 2005;11:232-5.
11 Jordan RA, Raetzke P, Gängler P. Prevalence of Oral Manifestations in HIV-seropositive Patients Undergoing Highly-active Antiretroviral Therapy. Ger Dent J. 2007;62:376-85.
12 Kinane DF, Riggio MP, Walker KF, MacKenzie D, Shearer B. Bacteriaemia following periodontal procedures. J Clin Peridontol. 2005;32:708-13.
13 King MD, Reznik DA, O´Daniels CM, Larsen NM, Osterholt D, Blumberg HM. Human papilloma-virus-associated ora warts among human immunodeficiency virus-seropositive patients in the era of highly active antiretroviral therapy: an emerging infection. Clin Infect Dis. 2002;34:641-8.
14 Mostofi RS, Lagroteria LB, Harris JE, Soltani K. Oral Kaposi´s sarcoma. An early manifestation of AIDS. Oral Health. 1985;75:59-62.
15 Myint M, Odden K, Schreurs O, Halstensen T, Schenck K. The gingival plasma cell infiltrate in HIV-positive patients with periodontitis is disorganized. J Clin Periodontol. 1999;26:358-65.
16 Nocent C, Raherison C, Dupon M, Taytard A. Unexpected effects of inhaled
fluticasone in an HIV patient with asthma. J Asthma. 2004;41:
793-5.
17 Perno C, Newcomb F, Davis D, Aquaro S, Humphrey R, Calió R, Yarchoan R. Relative potency of protease inhibitors in monocyte/macrophages acutely and chronically infected with human immunodeficiency virus. J Infect Dis. 1998;178:413-22.
18 Plagmann HC. Lehrbuch der Parodontologie. München: Carl Hanser Verlag; 1998.
19 Ras GJ, Eftychis HA, Anderson R, van der Waal I. Mononuclear and polymorphnuclear leucocyte dysfunction in male homosexuals with AIDS. S Afr Med J. 1984;66:806-9.
20 Reichart PA. Oral manifestations in HIV infection: fungal and bacterial infections, Kaposi´s sarcoma. Med Microbiol Immunol. 2003;192:165.
21 Remick R, Blasberg B, Patterson B, Carmichael R, Miles J. Clinical aspects of xerostomia. J Clin Psychiatry. 1983;44:63-5.
22 Shetty K. Dentistry. Implications and management of xerostomia in the HIV patient. HIV Clin. 2005;17:8-10.
23 Smith PD, Ohura K, Masur H, Lane HC, Fauci AS, Wahl SM. Monocyte function in the acquired immune deficiency syndrome. J Clin Invest. 1984;74:2121-8.
24 Steidley KE, Thompson SH, McQuade MJ, Strong SL, Scheidt MJ, van Dyke TE. A comparison of T4:T8 lymphocyte ratio in the periodontal lesion of healthy and HIV-positive patients. J Periodontol. 1992;24:823-9.
25 Stekler J, Maenza J, Stevens C, Holte S, Malhotra U, McElrath M, Corey L, Collier A. Abacavir hypersensitivity reaction in primary HIV infection. AIDS. 2006;12:1269-74.
26 Tomar SL, Swango PA, Kleinman DV, Burt BA. Loss of periodontal attachment in HIV-seropositive military personnel. J Periodontol. 1995;66:421-8.
27 van Winkelhoff A, Rodenburg J, Goené R, Abbas F, Winkel E, de Graeff J. Metronidazole plus amoxicilline in the treatment of Actinobacillus actinomycetemcomitans associated periodontitis. J Clin Periodontol. 1989;16:128-31.
28 Yengopal V, Naidoo S. Do oral lesions associated with HIV affect quality of life? Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;106:66.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
