Saleta Sierra
Aragon1, Nadine Lübke1, Thomas Lengauer2, Rolf
Kaiser1 und Alexander Thielen1
Maraviroc - Vom
Exot zum Bestandteil des klinischen Alltags
Die ersten Studien mit Maraviroc (MCV) MOTIVATE, 1029 und MERIT zeigten die antivirale Wirksamkeit des CCR5-Blockers bei HIV-1 infizierten Patienten. Da MVC jedoch nur R5-Viren hemmt, muss vor der Gabe von MVC eine Tropismustestung erfolgen. Dafür wurde in diesen Studien der phänotypische Trofile®-Test (Monogram) eingesetzt, dessen Validität durch die Studien belegt ist. Unzulänglichkeiten des Trofile®-Tests wurden bereits in der MERIT-Studie deutlich. In der ersten Auswertung dieser Studie war Maraviroc dem NNRTI Efavirenz bei therapienaiven Patienten im Hinblick auf die virologische Wirksamkeit unterlegen. Im Rahmen einer post hoc-Analyse wurden die Seren der Patienten mit einer verbesserten Version des Trofile®-Test erneut getestet und 107 Patienten, die nun duale oder gemischt-trope Viren aufwiesen ausgeschlossen. In der neuen Auswertung auf Grundlage der erneuten Testung erreichte Maraviroc die Nicht-Unterlegenheit. Zudem war die CD4-Zahl unter dem CCR5-Antagonist signifikant stärker angestiegen als unter Efavirenz. Zudem zeigte der Trofile®-Test bei seinem weltweiten Einsatz praxisrelevante Schwächen: die lange Dauer des Tests und die Verschickung der Proben zu einem einzigen zentralen Labor.
Tropismus-Test: phänotypisch oder genotypisch?
Wirkmechanismus CCR5-Antagonisten
Der Angriffspunkt von MVC
ist der HIV-Korezeptor CCR5 auf der Zelloberfläche. Um eine Zielzelle zu
infizieren, benötigt das Virus nicht nur den CD4-Rezeptor, sondern zusätzlich,
je nach Virus-Variante den Chemokinrezeptor CCR5 oder CXCR4. Die Virusvarianten
werden daher, je nach Korezeptorgebrauch, als R5, bzw. als X4-Viren bezeichnet.
Blockiert man CCR5, so können die R5-Viren nicht mehr in die Zelle eindringen
und sich somit nicht mehr vermehren. Einen vergleichbaren Effekt hat man bei
Patienten, die den Gendefekt delta32 aufweisen. Dieser Gendefekt tritt in etwa
10% der kaukasischen Bevölkerung auf. Dies bedeutet, dass ca. 1% der
Bevölkerung homozygot für diesen Gendefekt ist und somit ohne CCR5-Rezeptor
lebt. Die Blockade, bzw. das Fehlen des CCR5-Rezeptors hat keinen bekannten
negativen Einfluss auf zelluläre Effekte. Dies zeigt, dass die Funktion dieses
Rezeptors durch andere Rezeptoren übernommen werden kann. Für CXCR4 gibt es
keine solche Mutationskonstellation.
Versuche,
CXCR4-defiziente Mäuse zu züchten, schlugen fehl, die Mäuse waren nicht
lebensfähig.
Hier konnten aber einige virologische Labore auf grundlagenwissenschaftliche Erfahrungen zurückgreifen und noch vor Beginn des Expanded Access Program (EAP) von MVC alternative, genotypische Tests anbieten. Sowohl beim Trofile®-Test als auch beim genotypischen Korezeptor-Test wird zunächst ein Genbereich des Patientenvirus vervielfältigt, der für das Hüllprotein von HIV kodiert. Dieses Stück wird beim Trofile®-Test in ein HIV-Reporterkonstrukt eingebaut und in einer Zellkultur getestet. Im genotypischen Ansatz wird dieser Bereich auch mittels PCR vervielfältigt, aber dann lediglich sequenziert. Dadurch ist der genotypische Test ein standardisierbares und rasches Verfahren, wie es im Prinzip aus der HIV-Resistenztestung seit vielen Jahren bekannt ist. Die Schwierigkeit besteht, wie immer mit genotypischen Tests, in der Interpretation der genetischen Information. Obwohl die ersten genotypischen Verfahren für Tropismus und Interpretationen bereits 1994 und 2001 präsentiert wurden, fanden die Interpretationsverfahren erst 2007 mit der Einführung von MVC größere Beachtung. Leider sorgten die Diskussionen über die Testung anfänglich für eine gewisse Verunsicherung. Inzwischen ist ausreichend demonstriert, dass genotypische Testungen die gleiche Zuverlässigkeit zeigen wie phänotypische, um Patienten mit MVC zu therapieren (Harrigan et al. 2009 5th IAS, Cape Town; Reuter et al. 2010 Eur J Med Res 15 und darin erwähnte Referenzen).
In den meisten EU-Ländern ist die Testung flächendeckend durch die lokalen Labore verfügbar. In Deutschland hat HIV-GRADE die genotypische Testung koordiniert. In der Schweiz wird durch InPheno ein alternativer phänotypischer Test (PhenX-R) für die Routine zusätzlich angeboten.
Tropismus-Test bei nicht nachweisbarer Viruslast
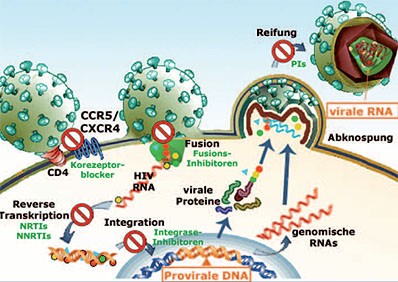
Abb. 1: Vermehrungszyklus des HI Virus. Die antiretroviralen Medikamente sind in rot markiert. Die Ziele für die Tropismusbestimmung sind in Orange gekennzeichnet.
Auch wenn die Viruslast unter der Nachweisgrenze liegt, ist es möglich aus der EDTA-Blutprobe eine Tropismus Untersuchung durchzuführen. Zurzeit wird aus dem Plasma der Tropismus des freien Virus bestimmt (virale RNA Testung). Ist die Viruslast gering oder gar unter der Nachweisgrenze, ist diese Analyse oft nicht möglich. Dann besteht aber die Möglichkeit aus den Leukozyten derselben EDTA-Blutprobe eine sogenannte provirale DNA Testung für den Korezeptorgebrauch durchzuführen. Diese DNA Analyse ist möglich, weil das Virus in seinem Vermehrungszyklus zunächst die virale Erbsubstanz (virale RNA) durch die Reverse Transkriptase in DNA (provirale DNA) umschreibt, und durch die Integrase in die zelluläre DNA einbaut (Abb. 1). Die praktische Durchführung der proviralen DNA Analyse ist dann identisch wie bei der RNA Analyse.
Umstellung bei kompletter Suppression
Die ersten klinischen Verläufe mit Umstellungen auf MRC aufgrund genotypischer Bestimmungen sind bereits in Kongressen veröffentlicht worden (Obermeier et al. 2009 7th European HIV Drug Resistance Workshop, Stockholm; Obermeier et al. 2009 EACS Köln; Sierra et al. 2009 EACS, Köln; Obermeier et al. 2010 8th European HIV Drug Resistance Workshop, Sorrent, #23; Sierra et al. 2010 8th European HIV Drug Resistance Workshop, Sorrent, #20; Knechten et al. 2010 XVIII IAC Vienna, #THPE0142) und als erste Publikation (Reuter et al. 2010 Eur J Med Res 15). Auch während des Virology-Education Satelite beim Welt-AIDS Kongress hat Jürgen Rockstroh, Bonn, einen Fall gezeigt, der aufgrund von Nebenwirkungen mit Hilfe der proviralen DNA-Analyse erfolgreich umgestellt werden konnte.
Von Monogram wurde auf der CROI 2010 ein Test zur Analyse proviraler DNA vorgestellt, welcher aber noch nicht kommerziell verfügbar ist. Eine Tropismusanalyse der viralen DNA ermöglicht Monagramm weiterhin durch den Trofile® ES-Test (ESTA). Dieser ist prinzipiell nur für Proben mit einer Viruslast ≥1.000 Kopien/ml verfügbar; in Ausnahmefällen werden auch Proben mit einer Viruslast ≥500 Kopien/ml analysiert.
Was sind cut-offs?
![Abb. 2: Output von geno2pheno[coreceptor] – A: FPR >20%: sichere Anwendung von MVC. – B: FPR 12,5% - 20%: MVC Verschreibung abhängig von der Patientensituation – C: FPR <12,5%: MVC nicht empfohlen](images/fobi_kaisermara-2-small.jpg)
Abb. 2: Output von geno2pheno[coreceptor] – A: FPR >20%: sichere Anwendung von MVC. – B: FPR 12,5% - 20%: MVC Verschreibung abhängig von der Patientensituation – C: FPR <12,5%: MVC nicht empfohlen![]() großes Bild
großes Bild
Genau wie bei der Resistenz-testung gibt es bei der Bewertung des Korezeptorgebrauchs auch intermediäre Formen. Bei der Resistenztestung können die Viren unterschiedliche errechnete Resistenzfaktoren erreichen. Aus der klinischen Erfahrung kann gefolgert werden, ab welchem Resistenzfaktor das Medikament keine ausreichende Wirkung mehr erzielt. In den Interpretationsystemen werden diese Werte in einer Graduierung „susceptible“, „limited susceptible“, „intermediate“ und „resistant“ ausgegeben und farbig (grün, gelb, rot) hinterlegt. In manchen Systemen werden auch numerische Werten (1->100) dargestellt. Analog wird bei der Bestimmung des Korezeptorgebrauchs verfahren. Auch hier gibt es nicht nur grün oder rot, entsprechend R5 oder X4, sondern auch Zwischenformen (Intermediate). Man kann die Wahrscheinlichkeit für den Korezeptorgebrauch auch berechnen. Das Resultat ist ein Prozentwert, der in geno2pheno[coreceptor] als „false positive rate“ (FPR) ausgedrückt wird. Je höher die FPR ist, desto wahrscheinlicher ist es ein R5 Virus (Abb. 2).
Derzeit ist bei 20% FPR ein „cut-off“ definiert worden, über dem der CCR5-Gebrauch als sehr sicher gilt. Im Bereich von 12,5% - 20% ist die Gabe in Abhängigkeit von der Patientensituation zu erwägen. Bei einer FPR unter 12,5% geben die Deutschen Richtlinien zurzeit keine uneingeschränkte Empfehlung für die Gabe von MVC.
Leitlinien
Seit Juni 2009 sind die Empfehlungen in den Deutsch-Österreichischen Therapierichtlinien (http://www.daignet.de/site-content/hiv-therapie/leitlinien1/Leitlinien%20zur%20Topismus_Testung%20Stand%20Juni%202009.pdf) zusammengefasst und werden regelmäßig diskutiert. Hier wird wie oben erwähnt eine Patienten-orientierte „cut-off“ Empfehlung gegeben. Bei limitierten Therapieoptionen wird der Einsatz von MVC auch bei niedrigen „cut-off“ Werten erlaubt. Andererseits wird für Patienten mit vielfältigen Therapieoptionen die Gabe von MVC nur bei einem hohen „cut-off“ empfohlen, so dass nur Patienten mit nachgewiesenen R5-Viren MVC bekommen. Bei der Analyse proviraler DNA für die Therapie-Umstellung unter der Nachweisgrenze wird ebenfalls ein hoher „cut-off“ empfohlen.
Auf internationaler Ebene wurden für die Korezeptor Testung auch Richtlinien veröffentlicht (Lancet Infectious Diseases, under revision) und als Beitrag auf dem Glasgow Congress 2010 präsentiert. Hier werden die genotypischen Testungen ebenfalls gleichberechtigt zur phänotypischen (Trofile®)-Testungen dargestellt. Es werden darin auch sehr detailliert technischen Schritte (Dreifach Testung, Anwendung der neue Sequenzierungmethode 454) zur Testung diskutiert. Diese Diskussionen werden helfen, die bereits auf hohem Niveau verfügbaren diagnostischen Methoden und Interpretationsysteme weiter zu verbessern.
Perspektiven
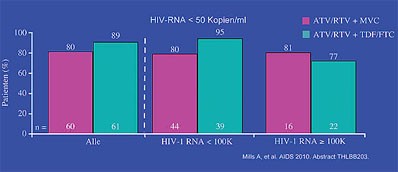
Abb. 3: 24 Wochen ATV/r plus MRC 150 mg OD vs. ATV/r plus TDF/FTC
Die Kombinationsmöglichkeiten mit
anderen Medikamenten, wie mit Raltegravir (RAL) und Etravirine (ETR) (Nozza et
al. 2010 AIDS 24), oder mit RAL, ETR und Darunavir (DRV) (Sterrantino et al.
2010 XVIII IAC Vienna, WEPE0042) wurden bereits mit einigen Veröffentlichungen
und auf Kongressen gezeigt. Maraviroc wird aktuell zudem in Nuke-freien Regimen
geprüft, (z.B. in Kombination mit Lopinavir/r oder Atazanavir/r) und kann
möglicherweise auch einmal täglich gegeben werden. In einer Phase-2-Studie war
der virologische Effekt von Maraviroc 150 mg OD und Tenofovir/Emtricitabin
jeweils in Kombination mit Atazanavir/r bei therapienaiven Patienten nach 24
Wochen vergleichbar (THLBB203 Mills A et al.) (Abb. 3).
Weitere interessante Aspekte sind die gute Verträglichkeit (hier ist australisch-europäische Switch-Studie in Vorbereitung) sowie ein möglicherweise günstiger Einfluss auf die Immunaktivierung (Vallejo et al. 2010 XVIII IAC Vienna, #TUPE0016). Eine Nachanalyse der MOTIVATE-Studie in Bezug auf die geringe Inzidenz von Malignomen in MVC-Arm führt auf diesem Gebiet zu größerer Aufmerksamkeit (Walmsley et al. 2010 XVIII IAC Vienna, TUPE0157). Die klinische Bedeutung der guten Liquorgängigkeit (Melica et al. 2010 AIDS 24) ist derzeit noch offen.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
