Nils von Hentig, Frankfurt
Plasmakonzentrations-Messung von Raltegravir und Maraviroc im Kontext von TDM in der HIV-Therapie
Aktuelle Behandlungsrichtlinien für die HIV Therapie im In- und Ausland empfehlen zwar Therapeutisches Drug Monitoring für besondere Patientengruppen, wie Kinder, schwangere Frauen und Leber- bzw Niereninsuffiziente Patienten, formulieren bislang jedoch keine Algorithmen für ein klinisch-pharmakologisches Management der HAART, welche Behandlern und Patienten den Weg entlang der Vielzahl miteinander in Zusammenhang stehenden pharmakologischen, virologischen und klinischen Größen weisen würden. Hinzu kommt die Frage, welche Empfehlungen derzeit für die neuen Substanzklassen CCR5-Inhibitoren bzw. Integrasehemmer gegeben werden können.
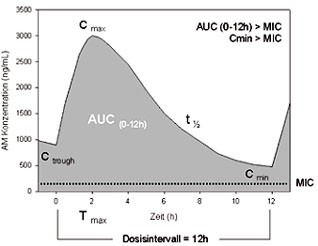
Abb. 1: Pharmakokinetische Parameter
Die Plasmaspiegel-Messung antiretroviraler Arzneimittel im Rahmen des Therapeutischen Drug Monitoring schließt verschiedene Parameter ein: Mithilfe der Minimalkonzentration im Dosisintervall, Cmin, bzw. der Wirkspiegel vor erneuter Arzneimittelgabe, Ctrough, wird ein Unterschreiten therapeutischer Wirkspiegel überprüft. Die Maximalkonzentration im Dosisintervall, Cmax, gibt Hinweise auf unerwünschte Wirkungen, die durch sehr hohe Arzneimittelspiegel bedingt sein können. Die Gesamtexposition eines Arzneimittels, die Fläche unter Konzentrations-Zeitkurve, AUC (Area Under the time-concentration Curve), kann sowohl mit der Wirksamkeit als auch Nebenwirkungen korelliert sein.
Generell werden bisher nur HIV-Protease Inhibitoren (PI), Nicht Nukleosidale Reverse Transkripase Inhibitoren (NNRTI), der Fusionsinhibitor Enfuvirtid sowie Maraviroc und Raltegravir in Plasma bzw. Serum gemessen. Nukleosidale Reverse Transkriptase Inhibitoren (NRTI) hingegen sind prodrugs und werden nach Resorption aus dem Magen-Darm-Trakt erst in der Zielzelle, mehrfach phosphorylliert, antiretroviral wirksam. Ein Zusammenhang zwischen Plasmakonzentration der prodrugs und intrazellulären Konzentrationen der wirksamen Substanzen besteht nicht, und sie werden deshalb auch nicht im Rahmen des Routine-TDM gemessen. Für PI, NNRTI sowie Maraviroc gibt es Empfehlungen für minimale bzw. im Patienten angestrebte effektive Konzentrationen im Plasma, welche entweder in Studien mit Therapie-naiven Patienten oder aus in-vitro-Daten generiert und extrapoliert wurden (Tab. 1, 1. Spalte).
Die neuen Substanzen
Die für Raltegravir und Maraviroc angegebenen minimalen Hemmkonzentrationen in vitro (bzw. in vivo) betragen 15 ng/mL (n.a.) und 0,57 ng (50 ng/mL) (http://www.ema.europa.eu/htms/human/epar/eparintro). In Patienten gemessene Plasmakonzentrationen beider Substanzen übersteigen die angegebenen Werte um ein Vielfaches. Inwieweit jedoch ein Tropismuswechsel CCR5QCXCR4 unter Maraviroc-Therapie konzentrationsabhängig stattfindet und eine Konzentrationserhöhung dies verhindern könnte, wurde bisher noch nicht gezeigt, so dass auch hier die Interpretation von Wirkspiegeln in Patienten kaum seriös möglich ist.
Insofern ist ein TDM bei Raltegravir- bzw. Maraviroc-naiven Patienten nicht indiziert, wenn die Dosierungsempfehlungen bei Komedikation mit anderen ARVs eingehalten werden.
Zur Frage, ob TDM auf lange Sicht das klinische Outcome der Patienten verbessern hilft, liegen anders als bei einigen älteren ARVs noch keine Daten vor.
Derzeit sind die Ergebnisse von sechs kontrollierten klinischen Studien publiziert, in welchen die Bedeutung des TDM für die Therapiesicherheit untersucht wurde. Zwei zeigen einen klaren therapeutischen Vorteil für den Patienten durch TDM (Anteil der Patienten mit niedriger Viruslast nach 48 Wochen größer als in der Vergleichsgruppe), vier weitere Studien verfehlten jedoch das Ziel, einen signifikanten Vorteil durch TDM der HAART zu zeigen6-8, wobei die jüngst veröffentlichte Studie von Best et al.4 zumindest einen deutlichen Trend hin zum besseren viralen Ansprechen durch TDM der Therapie mit anschließender Dosisanpassung zeigte. Eine Anzahl weiterer retrospektiver Analysen hat (Vorhersage-) Modelle für Therapieansprechen und/oder Nebenwirkungen entwickelt, welche die Pharmakokinetik der ARV als grundsätzlich relevant für den Therapieerfolg ansehen.9-15
Ein Vergleich empfohlener Arzneimittelkonzentrationen (Tab. 1, 2. Spalte) und eigener Daten aus der Frankfurter HIV-Kohorte zeigt, dass die in der Klinik gemessenen Durchschnittswerte von PI und NNRTI in Therapie-naiven Patienten generell ausreichend sind (Tab. 1, 3. Spalte). Bisher wurden allerdings erst wenige Daten bei besonderen Patientengruppen und den angesprochenen neuen Substanzen ermittelt (Tab. 1, 4. Spalte). Auch ist anzunehmen, dass für lange vorbehandelte und mit viralen Resistenzen belastete Patienten, nicht dieselben Zielgrößen gelten wie für Therapie-naive Patienten. Verschiedene Konzepte z.B. virale Resistenz mit Arzneimittelspiegeln zu verbinden, sind noch nicht ausgereift.
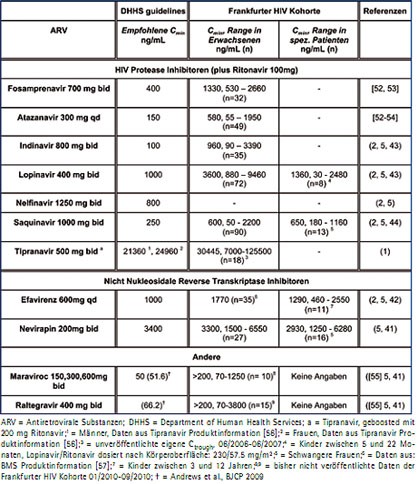
Tab. 1: Empfohlene Plasmakonzentrationen für antiretrovirale Substanzen in Patienten mit HIV-1 Wildtyp Virus und im Routine-TDM gemessene Minimumkonzentrationen, C min , von Patienten der Frankfurter HAART-Pharmakokinetik-Datenbank (Mittelwerte, Range, gerundet)
Klinische Szenarios für TDM
Schwangerschaft und Transmissionsprophylaxe
Grundsätzlich wird eine HAART in der Schwangerschaft durchgeführt, wenn Behandlungsbedarf besteht (http://www.daignet.de/media/SCHWANGER_2005_09.pdf). Ansonsten ist eine HAART bei Frauen, die während der frühen Schwangerschaft keine Medikamente nehmen müssen, generell erst ab der 28.-32. Schwangerschaftswoche zur Transmissionsprophy-laxe von HIV kurz vor oder unter der Geburt indiziert.16
Die Schwangerschaft geht mit physiologischen Veränderungen einher, welche die Arzneimittelspiegel der HAART z.T. erheblich beeinflussen können. Die Datenlage hierzu ist aufgrund der wenigen klinischen Studien mit schwangeren Frauen eingeschränkt. Einige Anwendungsbeobachtungen liefern jedoch Hinweise darauf, dass Gewichtszuname, ein verändertes Verteilungsvolumen, die erhöhte totale Clearance und verzögerte Resorption die Spiegel von beispielsweise Nelfinavir, Indinavir, Lopinavir und Nevirapin vor allem im letzten Trimenon der Schwangerschaft, deutlich verändern, so dass auch die Schwangerschaft unter HAART generell eine Indikation für TDM darstellt.17-21 Dieses gilt insbesondere beim Einsatz neuer Substanzen, deren pharmakokinetisches Verhalten in dieser besonderen Situation noch nicht ausreichend bekannt ist. Hier können die Daten aus TDM helfen, Informationen zu generieren, welche aus klinischen Studien in absehbarer Zeit nicht erhältlich sein werden.
Die Deutsch-Österreichischen Empfehlungen zur HIV-Therapie in der Schwangerschaft empfehlen die regelmäßige Talspiegel-Messung (Ctrough) während einer Behandlung in der Schwangerschaft (http://www.daignet.de/media/SCHWANGER_2005_09.pdf).
HAART im Kindesalter
Arzneimittelkonzentrationen in Kindern sind schwer vorherzusagen, da sich während der kindlichen Entwicklung Absorption, Verteilung, Metabolisierung und Ausscheidung ständig verändern. Verschiedene Dosierungsempfehlungen für PI oder NNRTI basieren zwar auf Anpassung entsprechend Körpergewicht oder Körperoberfläche der Kinder, es hat sich aber gezeigt, dass diese in der Realität oftmals ungenügende Arzneimittelspiegel zur Folge haben. Darüber hinaus zeigen eine Anzahl sehr heterogener Studien mit Efavirenz22, 23, Lopinavir24, Nelfinavir10, 25 und Indinavir26 eine sehr hohe intra- und interindividuelle Variabilität der pharmakokinetischen Zielgrößen mit dem Potenzial für suboptimale Arzneimittelspiegel.
Bei Kindern sollten daher bei unzureichendem Therapieerfolg, dem Auftreten viraler Resistenzen und von unerwünschten Arzneimittelwirkungen, Arzneimittelspiegel kontrolliert werden. Empfehlungen hierzu finden sich in der Leitlinie zur Aktuellen HIV-Therapie bei Kindern der Deutschen Pädiatrischen Arbeitsgemeinschaft AIDS (PAAD, http://www.kinder-aids.de/konsensus_leitlinie_hiv_paediatrie.htm).
HBV/HCV-Koinfektion
Pathophysiologische Änderungen unter HBV/HCV Koinfektion können die Arzneimittelspiegel der HAART erheblich beeinflussen, so dass eine Dosisanpassung von PI und NNRTI im Falle von Leberinsuffizienz notwendig werden kann. Daher ist die chronisch-replikative HBV/HCV-Koinfektion, auch ohne Hinweis auf eine eingeschränkte Leberfunktion, eine Indikation für TDM der HAART, auch bei den neuen Substanzen Maraviroc und Raltegravir.
Salvage-Therapien
Der Gebrauch ungewöhnlicher Kombinationen in der HAART bzw. individuell angepasster Dosierungen kann vor allem bei sehr lange vorbehandelten Patienten nötig werden. Da es bei einer Kombination von mehr als zwei Arzneimitteln, die über denselben Abbauweg verstoffwechselt werden, generell schwierig ist, Interaktionen vorherzusagen27, sind viele dieser Therapien eine Indikation für TDM. Generell benötigen diese Patienten relativ hohe Arzneimittelspiegel, um einer möglichen weiteren viralen Resistenzbildung vorzubeugen.6, 15, 28, 29 Die Empfehlungen von zu erreichenden Plasmakozentrationen für Raltegravir und Maraviroc beziehen sich speziell auf diese Patientengruppe. (DHHS Guidelines)
Arzneimittelinteraktionen
Pharmakokinetische Arzneimittelinteraktionen zwischen einzelnen antiretroviralen Substanzen bzw. mit der Begleitmedikation können in besonders niedrigen oder toxisch hohen Arzneimittelspiegeln resultieren. Alle PI und NNRTI werden über Cytochrom P450 (CYP), besonders CYP3A, verstoffwechselt. Internetseiten geben entsprechende Informationen und Handlungsanweisungen für den Fall vermuteter Interaktionen innerhalb der HAART (z.B. www.hiv-druginteractions.org/). Arzneimittelinteraktionen von PI und NNRTI, beispielsweise mit Antazida, Lipidsenkern, Psychopharmaka, Antiepileptika, Opiaten spielen in der Klinik eine bedeutende Rolle. Bis zu 50% der HIV-Patienten nehmen zumindest zeitweise H2-Rezeptorenblocker oder Protonenpumpeninhibitoren ein.
Interaktionen: Maraviroc
Gleiches gilt für die neue Substanz Maraviroc: Dosierungsanweisungen entsprechend der eingesetzten Komedikation deuten auf ein gehobenes Interaktionspotential hin, so dass die o.g. Gründe für ein mögliches TDM auch hier gelten. Resorptionsprobleme sind weniger zu erwarten, dafür ein Einfluss von CYP3A auf die Bioverfügbarkeit bzw. den Abbau von Maraviroc in der Leber. Da Maraviroc zum N-dealkylierten Produkt durch CYP3A bei einer K(m) von 21 microM und V(max) von 0.45 pmol pmol(-1) min(-1) metabolisiert wird, ist bereits eine deutliche Abbauhemmung durch einen zu Ritonavir verhältnismäßig wenig potenten CYP3A4-Inhibitor Ketoconazol gezeigt worden.30 Verschiedene Studien haben in diesem Zusammenhang Interaktionen mit vielen ARVs31, Rifampicin, Azolderivaten32, Clarithromycin (http://www.kompendium.ch) nachgewiesen, so dass eine Aufzählung der Interaktionen und Dosierungshilfen zu weit führen würde. Insofern kann auf Interaktionen mit ähnlichen Präparaten rückgeschlossen werden, so dass im Zweifelsfall hier ein TDM sowie Dosisanpassungen angebracht sind. Denkbar ist dies bei einer Reihe von Psychopharmaka, Antiepileptika, Antibiotika, schwach wirksamen Opioiden. Keine Dosisanpassungen bzw. TDM sind hingegen nötig bei gleichzeitiger Anwendung von Methadon/Buprenorphin, hormonellen Kontrazeptiva, Midazolam33, Statinen oder HCV-Therapie. Den Anhalt für nicht zu unterschreitende Plasmakonzentrationen bieten die Empfehlungen des Amerikanischen Gesundheitsministeriums mit 50 ng/mL in vivo. Eine lineare Dosis- bzw. eine Konzentrations-Wirkungsbeziehung liegt für Maraviroc jedoch nicht vor, was die Interpretation höherer Wirkspiegel, auch im Zusammenhang mit eventuellen Nebenwirkungen bisher unmöglich macht. Auch milde bis moderate Einschränkungen der Leberfunktion bedingen keine Empfehlung zum TDM von Maraviroc.34 Eine gute Übersichtsarbeit zum Thema ist 2009 in Antiviral Therapy erschienen.35
Interaktionen: Raltegravir
Raltegravir hingegen hat ein verhältnismäßig viel geringeres Interaktionspotential, da es über UGT und nur zu einem geringen Teil Cytochromoxidasen abgebaut wird. Insofern ist diese Substanz hochinteressant für den zukünftigen Einsatz in potenziell hoch interaktiven Therapien, wie z.B. bei TBC, Hepatitis C, Psychopharmaka, Epilepsien etc. Eine UGT-Hemmung durch die gleichzeitige Gabe von Atazanavir 300 mg BID erhöhte die Raltegravir-Plasmakonzentrationen um ~50%, was jedoch keine weiteren klinischen Konsequenzen haben dürfte.36 Allerdings scheint die gleichzeitige Gabe mit Antazida zumindest das Potenzial für eine Erniedrigung der Cmin bei gleichbleibender Cmax/AUC zu haben. Jedoch liegen Daten zunächst nur für die einmalige Gabe von Raltegravir vor und nicht in Patienten bei chronischer Einnahme im steady state.37
Weitere Interaktionsstudien konnten keine relevanten Interaktionen mit Pravastatin 38, Tacrolimus39, Cyclosporin40, Methadon41, Lamotrigin42 oder Tipranavir/Ritonavir43, Ritonavir und Efavirenz.44 Die gleichzeitige Applikation von Omeprazol hingegen erhöhte die Raltegravir-Spiegel aufgrund einer verbesserten Resorption bei erhöhtem Magen-ph-Wert.45
Wichtig ist auch die bisher nicht reproduzierbare Interaktion zwischen Raltegravir und Maraviroc in einer Studie von Andrews et al., welche eine beiderseitige Reduktion der Plasmakonzentrationen ~40% (Raltegravir) bzw. ~20% (Maraviroc). Ob dieses eine klinische Relevanz hat, ist derzeit nicht zu bestimmen. TDM sollte in dieser Situation angewendet werden, wenn zusätzliche Interaktionen mit Begleitmedikation erwartet werden.
Pharmakogenetik
Die Pharmakogenetik, d.h. die genetische Disposition von Patienten in Bezug auf den Arzneimittelstoffwechsel spielt bisher im klinischen Alltag eine untergeordnete Rolle in der antiretroviralen Therapie. Im Jahr 2002 konnten Fellay et al. zeigen, dass Polymorphismen des MDR-1 Gens einen direkten Einfluss auf den Erfolg einer Therapie mit dem Proteaseinhibitor Nelfinavir haben, welcher Substrat von P-Glykoprotein ist.46 Das MDR-1 Gen codiert für die P-Glykoprotein-Aktivität, einer Effluxpumpe, welche Arzneimittel aus vielen Zellen ausschleust. Patienten mit dem MDR-1 3435 TT-Subtyp hatten signifikant höhere Plasmaspiegel und einen stärkeren Anstieg der CD4 Zellen unter Therapie als Vergleichspatienten mit den MDR-1 3435 CC- oder CT-Subtypen. Die Arbeit von Fellay et al. konnte jedoch bis heute nicht auf andere HIV-Therapieregime übertragen werden.
Ein Raltegravir betreffender Polymorphismus betrifft theoretisch die Uridin-Glucoronosyl-Transferase (UGT)1A1, welche Bilirubin zu einer wasserlöslichen Substanz konjugiert, aber auch Raltegravir oder Morphin zu den jeweiligen Glucuroniden metabolisiert. Interaktionen mit Hemmern der UGT, wie z.B. Atazanavir spielen dennoch klinisch wahrscheinlich keine Rolle, da erhöhte Raltegravir-Konzentrationen bisher nicht mit dem Auftreten bestimmter Nebenwirkungen korreliert werden konnten. Jüngst publizierte Daten deuteten auch auf keinen relevanten Einfluss veränderter Rezeptorgenetik auf Raltegravir Plasmakonzentrationen hin. Die herabgesetzte Formation von Glucuronid-Metaboliten47 sowie die Steigerung der Plasmakonzentrationen um 41-92% bei Vorliegen eines UGT1A1*28/*28 Genotyps im Vergleich zu UGT1A1*1/*1 hatten keinerlei klinische Relevanz.48
Einen umfassenden Überblick über Interaktionen bietet das jüngst von David Burger veröffentlichte Review zum Thema .49
Konsequenzen für Klinik und Praxis
Der Talspiegel, Ctrough, wird in der Regel für die Überprüfung der Patienten-Compliance bzw. vermutete Resorptionsstörungen benutzt. Wiederholte Ctrough-Messungen dienen der Bestimmung der intra-individuellen Variabilität der Arzneimittelspiegel. Dabei ist zu beachten, dass Ctrough Cmin ist. Die Minimalkonzentration im Dosisintervall tritt bei vielen Patienten möglicherweise erst 1, 2 oder 4 Stunden nach Einnahme der Medikation auf, insbesondere bei verzögerter Resorption, z.B. in der Schwangerschaft.
- Die Maximalkonzentration, Cmax, wird genutzt, um einen Hinweis auf mögliche Toxizitäten zu bekommen. Der Zeitpunkt der Cmax, Tmax, liegt bei Raltegravir und Maraviroc zwischen 1 und 4 Stunden, so dass eine Messung um diesen Zeitpunkt herum geplant werden sollte. Bisher existieren jedoch für beide Substanzen keine Daten, welche hohe Plasmakonzentrationen mit Nebenwirkungen in Zusammenhang bringen.
- Zur Bestimmung der vollständigen Pharmakokinetik über das Dosisintervall im erwachsenen Patienten (einschließlich Konzentrations-Zeitkurve, AUC, oder totaler Clearance, Cltotal) haben sich die Messzeitpunkte 0, 1, 2, 4, 6, 9, 12 (24) Stunden bewährt. Bei Kindern reichen mindestens die Messzeitpunkte 0, 2, 4, 8, 12 Sunden aus.
- Generell ist es hilfreich, das Vorgehen in der Praxis zu standardisieren, um die Daten vergleichend interpretieren zu können. Die Messung sollte frühestens zwei Wochen nach Beginn der Therapie (im steady state) stattfinden. Der Zeitraum seit der letzten Einnahme der HAART bis zur Messung muss dokumentiert werden, sowie generell Begleitmedikamente.
- Die US-amerikanischen Behandlungsleitlinien empfehlen aus den oben genannten Gründen bisher kein TDM bei neuen Substanzen.50, 51 Die Deutsch-Österreichischen Leitlinien empfehlen TDM Situations- jedoch nicht Substanzabhängig. Insofern sind Maraviroc und Raltegravir genauso zu behandeln wie Proteaseinhibitoren und NNRTI.
Literatur bei Verfasser










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
