K. Jansen, B. Gunsenheimer-Bartmeyer, M.
Altmann, A. K. Meixenberger, O. Hamouda, C. Kücherer
Aktuelle Ergebnisse aus der HIV-1 Serokonverterstudie des Robert Koch-Instituts
Die HIV-1 Serokonverterstudie: Ziele und Design
Die HIV-1 Serokonverterstudie wird am Robert Koch-Institut in Kooperation der beiden heutigen Fachgebiete 18 (Zentrum für HIV und Retrovirologie) und 34 (HIV/AIDS und andere sexuell oder durch Blut übertragbare Krankheiten) seit 1997 durchgeführt. Als multizentrische, prospektive Langzeitbeobachtung hat die Studie das Ziel, Langzeitanalysen hinsichtlich des Verlaufs der Infektion bis zum Eintreten definierter Ereignisse und der Überlebenszeit für ein Studienkollektiv von Serokonvertern in Deutschland durchzuführen. Ein wichtiger Teil der Studie ist es, Trends in der Übertragung primär resistenter HIV und der Ausbreitung von Subtypen zu analysieren.
Wie aus ihrem Namen schon zu ersehen liegt die Besonderheit der Studie darin, dass der Infektionszeitpunkt der eingeschlossenen Patienten durch die erforderliche labordiagnostische Dokumentation der Serokonversion auf einen definierten Zeitraum eingrenzbar ist.
Patienten können eingeschlossen werden, wenn sie mindestens 18 Jahre alt sind und eine labordiagnostisch dokumentierte HIV-Infektion vorliegt.
Es werden nur Patienten in die Studie eingeschlossen, bei denen entweder
- eine dokumentierte Serokonversion vorliegt: Blutentnahmedatum des letzten negativen Antikörpertest und erster bestätigt positiver Antikörpertest mit einem maximalen Abstand von drei Jahren –
oder
- bei denen eine akute Serokonversion vorliegt: negativer/fraglicher HIV-ELISA und eine positiven Viruslast oder positiver HIV-ELISA und negativer/fraglicher Immunoblot (die vollständige Serokonversion muss durch Verlaufsuntersuchung im Immunoblot bestätigt werden).
Als beste Approximation an das Infektionsdatum wird entweder das Datum des ersten reaktiven Testes (akute Serokonverter) oder das arithmetische Mittel zwischen letztem negativem und erstem bestätigt positiven HIV-Test eingesetzt.
Die Patienten werden von ihren behandelnden Ärzten über die Studie aufgeklärt, die Teilnahme erfolgt nur auf das schriftliche Einverständnis des Patienten hin. Bei Einschluss werden neben einer Reihe soziodemographischer Daten detaillierte Angaben zur HIV-Serokonversion, Daten zum Erwerb der HIV-Infektion, zu anderen sexuell übertragbaren Erkrankungen, zur Hepatitis-Serologie, zur CDC-Klassifikation inklusive entsprechender klinischer Diagnosen, zur Viruslast und CD4-Zellzahl sowie zur antiretroviralen Therapie (ART) erhoben. Jährlich erfolgt mindestens ein Follow-Up, das insbesondere den Verlauf der HIV-bezogenen Labordaten sowie der ART erhebt. Bei Einschluss sowie bei den jährlichen Follow-up Proben werden 20ml EDTA-Blut des Patienten entnommen und am RKI auf genotypische HIV-Resistenz und Subtyp untersucht, Plasma sowie DNA wird asserviert.
Aktuell sind in der Studie Daten von insgesamt 2.276 HIV-1-Serokonvertern dokumentiert. Im Rahmen der Studie werden sowohl Einflüsse des Patienten (z.B. Infektionsweg, Alter und Geschlecht der Patienten, das Vorhandensein von STD und anderen opportunistischen oder AIDS definierenden Erkrankungen, HLA- und Korezeptor-Polymorphismen) wie auch virale Faktoren (Subtyp, virale Resistenz gegen antiretrovirale Medikamente, Persistenz der Resistenz ) auf den Krankheitsverlauf der HIV-Infektion sowie den Therapieerfolg untersucht. Ein Feld, das in den letzten Jahren immer mehr Bedeutung auch für den klinischen Alltag gewonnen hat, ist das Monitoring der Übertragung resistenter HIV-Stämme bei Serokonverter in Deutschland, sowie die Analyse von Unterschieden zwischen Patienten mit sensitiven und resistenten HIV auf die Krankheitsprogression und den Therapieverlauf. Dies ist insbesondere vor dem Hintergrund des Einsatzes neuer Medikamentenklassen im klinischen Alltag von hoher Bedeutung.
Die HIV-1 Serokonverterstudie auf dem DÖAK 2011
Im Folgenden berichten wir aktuelle Ergebnisse aus der HIV-1 Serokonverterstudie, die auf dem DÖAK 2011 vorgestellt wurden und die sich mit Fragen der HIV-Resistenz in Deutschland auseinandersetzen.
Altmann et al.1 untersuchten vor dem Hintergrund einer kontinuierlichen Abnahme von AIDS-Fällen und HIV-assoziierten Todesfällen sowie einem Auftreten von Resistenzen gegenüber der antiretroviralen Therapie, resistenz-assoziierter Toxizitäten sowie längerer Behandlungsdauer die Frage, ob sich die HIV-Progression (gemessen am ersten AIDS-Ereignis) in den letzten Jahren verlangsamt hat und welche epidemiologischen Faktoren die HIV-Infektion insgesamt und im Zeitverlauf beeinflussen. Es wurden Cox-proportional Hazard-Modelle mit dem ersten AIDS-Event als abhängiger Variable berechnet und kontrolliert für Kalenderperiode (<1997, 1997-2000, 2001-2004, 2005-2006, 2007-2010), Alter bei Serokonversion, Geschlecht, Infektionsweg sowie kurzes HIV-Testintervall. Die Ergebnisse zeigten eine Abnahme des AIDS-Risikos zum jeweiligen Beginn zweier vordefinierten Kalenderperioden, nämlich in 1997 sowie in 2007, sowie eine Gesamt-Abnahme des AIDS-Risikos von 80% innerhalb von 13 Jahren. Das Alter bei Serokonversion blieb ein bestimmender Faktor der Progression, die Abnahme des Risikos bei Drogengebrauchern war kleiner als für andere Infektionswege.
![Abb. 1 Gesamtprävalenz der TDR von 1996 bis 2009 – Die mittlere Prävalenz betrug 12,2% (195/1603), [KI95% 10.8-13.7], (p TREND =0,37). Abb. 2 TDR wird häufig verursacht durch singuläre Resistenzmutationen Die Prävalenzen der drei Resistenzklassen (NRTI, NNRTI, PI) sind angeben: verursacht durch eine Mutation (1) bzw. durch mehr als eine Resistenzmutation (>1)](images/mitt_rki-1.jpg)
Abb. 1 Gesamtprävalenz der TDR von 1996 bis 2009 – Die mittlere Prävalenz betrug 12,2% (195/1603), [KI95% 10.8-13.7], (p TREND =0,37).
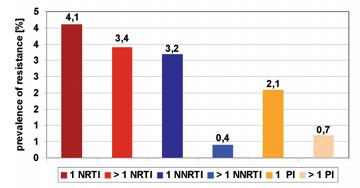
Abb. 2 TDR wird häufig verursacht durch singuläre Resistenzmutationen Die Prävalenzen der drei Resistenzklassen (NRTI, NNRTI, PI) sind angeben: verursacht durch eine Mutation (1) bzw. durch mehr als eine Resistenzmutation (>1)
Meixenberger et al.2 untersuchte im Rahmen der Serokonverterstudie Trends übertragener Resistenzen (transmitted drug resistance, TDR) gegen antiretrovirale Medikamente. Die Gesamtprävalenz der TDR betrug 12,2% unter 1.603/1.639 Serokonvertern, die bei Studieneintritt therapie-naiv waren und sich zwischen 1996 und 2009 infiziert hatten (Abb. 1). Die Übertragungshäufigkeit war stabil, es war kein statistischer Trend über die Zeit zu identifizieren. Übertragen wurden hauptsächlich Resistenzen gegenüber der Medikamentenklasse der NRTI (6,2%), gefolgt von NNRTI- (2,4%) und PI-Resistenzen (2,1%). Zweifach- bzw. multiple Resistenzen wurden nur bei 1,5% bzw. 0,3% der Patienten beobachtet. Die Prävalenz von NRTI-Resistenzen nahm über die Zeit ab (p=0,04), während die gegenüber NNRTI und PI stabil blieben (p=0,39 bzw. 0,20).
NRTI-Resistenzen wurden zu 81,5% durch Thymidinanaloge Resistenzmutationen (TAM) verursacht, 66% der TAM waren T215-revertante Substitutionen. Insbesondere NNRTI- und PI-Resistenzen waren häufig durch eine einzelne (singleton) Resistenzmutation verursacht (89,5% bzw. 73,0%) (Abb. 2). HIV-Stämme mit mehr als einer NNRTI-Resistenzmutation wurden erst seit 2002 beobachtet, demgegenüber nahmen HIV-Varianten mit mehr als einer PI-Resistenzmutation über die Zeit ab. Das Auftreten von TDR korrelierte mit dem HIV-1 Subtyp B (p>0.001).
Die Gesamtprävalenz von TDR blieb stabil über den Zeitverlauf, der vormals (1996-2007) national wie international beobachtete Anstieg von NNRTI-Resistenzen hat sich nicht fortgesetzt. Seit Einführung verbesserter antiretroviraler Therapieregime hat sich die Entwicklung von Resistenzen in behandelten Patienten verringert. Der gleichbleibende Anteil von TDR über die Zeit wird auf eine stetige Transmission resistenter HIV zwischen therapie-naiven, neu infizierten Patienten und der Fortdauer von HIV-Resistenzen in der infizierten Population zurückgeführt.
Bartmeyer et al.3 analysierten unter den Serokonvertern (Infektion zwischen 1996 und 2009) den Erfolg der antiretroviralen Therapie im Vergleich von sensitiven und resistenten HIV analysiert. Ein Behandlungserfolg wurde definiert als Messung einer Viruslast unter der Nachweisgrenze (500 Kopien/ml, Blips erlaubt) zwischen 6 und 12 Monaten nach Beginn der Firstline-Therapie, Therapieversagen als mindestens zwei aufeinanderfolgende Messungen einer Viruslast über 500 Kopien/ml zwischen 6 und 12 Monaten nach Beginn der Firstline-Therapie. In die Analyse wurden 214 Patienten aus dem Kollektiv der Serokonverterstudie mit vorhandenen Daten zur Firstline-Therapie und deren Therapieerfolg eingeschlossen, hiervon 175 Patienten mit sensitiven und 39 mit resistenten HIV.
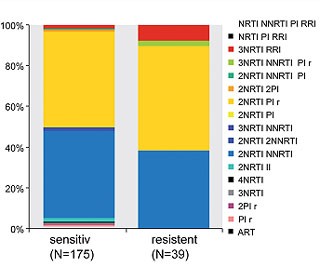
Abb. 3 Zusammensetzung der First-Line-Therapie in der Analyse der HIV-1 Serokonverterstudie
Zwischen Patienten mit sensitiven und resistenten HIV gab es nur geringfügige Unterschiede in der Zusammensetzung der antiretroviralen Firstline-Therapie (Abb. 3). Der Therapieerfolg in diesen beiden Gruppen war vergleichbar gut: 94,1% bei Patienten mit sensitiven HIV und 92,3% bei Patienten mit resistenten HIV (Unterschied nicht signifikant, p=0,713). Es wurde nur ein geringer Einsatz neuerer Medikamente bis zum Ende des Analysezeitraums (2010) festgestellt.
Kücherer et al.4 widmeten sich der Frage nach der Verbreitung von HIV-1-Subtypen im Kollektiv der HIV-Serokonverterstudie. Unter den 1.603 Patienten, bei denen die übertragene Resistenz analysiert worden war, und die sich zwischen 1996 und 2009 infiziert hatten, waren 7,7% HIV-1 Infektionen durch non-B-Subtypen verursacht (Analyse der pol-Sequenz). Am häufigsten waren die Subtypen CRF02_AG (endemisch in Zentral- und Westafrika), Subtyp C (endemisch in Süd- und Ostafrika, sowie Indien, China), CRF01_AE (endemisch in Thailand).
Die Gesamtprävalenz von non-B-Subtypen stieg über den Zeitverlauf von 0% auf 11,5% an (p=0,011). Heterosexuelle Kontakte waren das häufigste
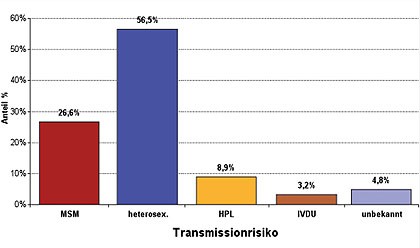
Abb. 4 Verteilung des Transmissionsrisikos in den analysierten Fällen mit non-B-Subtyp (n=124)
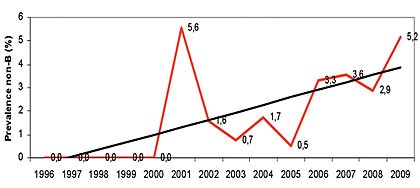
Abb. 5 Zunahme der non-B Infektionen in MSM Die Prävalenz der non-B-Subtypen in MSM der Studienkohorte ist pro Jahr der Serokonversion angegeben p TREND = 0,0129
Infektionsrisiko unter den analysierten Fällen mit
non-B-Subtyp (57,0% aller non-B-Infektionen), aber es wurden für alle
Transmissionsgruppen non-B-Infektionen identifiziert (Abb. 4). Insbesondere der
Anstieg von non-B-Infektionen unter MSM von 0% auf 5,2% (p=0,0129) ist
beachtenswert (Abb. 5), da die Studie für MSM repräsentativ ist. Vor dem Jahr
2001 (Infektionsjahr) wurden unter MSM des Studienkollektivs keine
non-B-Subtypen beobachtet. Die Aussagekraft für die heterosexuell übertragenen
Infektionen ist dagegen eingeschränkt, das sie im Studienkollektiv im Vergleich
zu den nationalen Meldedaten unterrepräsentiert sind (ebenso IVD).
65,3% (81/124) der mit non-B-Stämmen Infizierten waren Deutsche, gefolgt von 21% aus Subsahara-Afrika (Tabelle 1). 59,5% der Infektionen wurden wahrscheinlich in Deutschland erworben, weitere 17,7% in Subsahara-Afrika. 63,0% (51/81) der deutschen Patienten, die sich mit non-B-Subtypen infiziert hatten, erwarben ihre Infektion in Deutschland. Demzufolge sind HIV-Infektionen mit non-B-Subtypen in Deutschland endemisch und für Personen mit allen Transmissionsrisiken festzustellen. Sollte es Unterschiede in der Übertragungshäufigkeit oder Pathogenität bestimmter HIV-1 Subtypen geben, könnte dies in der weiteren Ausbreitungsdynamik der Subtypen innerhalb von MSM in der Zukunft erkenntlich werden.
Die HIV-Serokonverter-Studie kooperiert im Rahmen des vom Bundesministerium für Gesundheit geförderten Verbundprojekts „Monitoring von resistenten HIV bei frisch und chronisch infizierten HIV-Patienten in Deutschland“ eng mit der an den Universitäten Köln und Düsseldorf etablierten RESINA-Studie sowie dem Paul Ehrlich-Institut. Darüber hinaus beteiligt sie sich an den auf Serokonverter ausgerichteten europäischen Studienverbünden CASCADE und CHAIN.
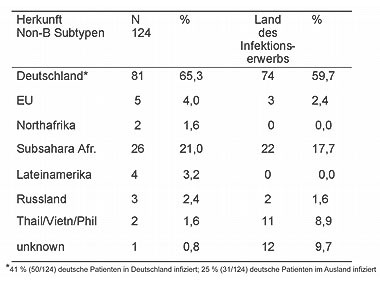
Tab. 1 Herkunft der HIV-1 Non-B Subtypen
Die hier beschriebenen Veröffentlichungen wie auch viele andere aus den letzten Jahren zeigen die hohe Bedeutung der HIV-1 Serokonverterstudie und des Verbundprojekts „Monitoring von resistenten HIV bei frisch und chronisch infizierten HIV-Patienten in Deutschland“ als zentrale Teile der HIV-Surveillance in Deutschland. Die Bedeutung der Daten und Analysen wird in Zukunft aufgrund neuer verfügbarer Therapieregime sowie der immer längeren Therapiedauern von älter werdenden Patienten weiter zunehmen.
Wir freuen uns daher sehr, wenn Sie weiterhin oder auch erstmals Patienten für die HIV-1 Serokonverterstudie rekrutieren. Das RKI kann Ihnen für eine Ersterhebung eine Aufwandsentschädigung von 50 €, für eine Follow-Up-Erhebung von 25 € erstatten. Seit dem 1.7.2011 führt Herr Dipl.-Psych. Klaus Jansen die Projektkoordination der HIV-1 Serokonverterstudie sowie des Projektverbundes Resistenzmonitoring durch. Sie können ihn in allen Belangen zur Studie sehr gerne ansprechen.
1 Altmann M., Scheufele R., Houareau C., an der Heiden M., Hamouda O., Bartmeyer B., on behalf of the German HIV-1 Seroconverter Study Group. The risk of AIDS-defining events is decreasing over time in the German HIV-1 Seroconverter Cohort (1996-2010). Abstract V30 auf dem Deutsch-Österreichischen AIDS-Kongress 2011, Hannover.
2 Meixenberger K., Kücherer C., Bartmeyer B., Scheufele R., Kollan C., Bieniek B., Dupke S., Jessen H., Schürmann D., Hamouda O., Seroconverter Study Group. Stable transmission rate of resistant HIV in Germany despite the introduction of new drugs in combination antiretroviral therapy. Abstract PW53 auf dem Deutsch-Österreichischen AIDS-Kongress 2011, Hannover.
3 Bartmeyer B., Scheufele R., Kücherer C., Meixenberger K., von Knyphausen F., Hamouda O., on behalf of the HIV-1 Seroconverter Study Group. Verteilung des Transmissionsrisikos in den analysierten Fällen mit non-B-Subtyp (n=124) Impact of transmitted drug resistance, TDR, on first line treatment success after the introduction of antiretroviral second generation drugs and new drug classes in 2007: up-date of the German HIV-1 Seroconverter Cohort (1997-2010). Abstract V137 auf dem Deutsch-Österreichischen AIDS-Kongress 2011, Hannover.
4 Kücherer C., Bartmeyer B., Meixenberger K., Scheufele R., Kollan C., Bieniek B., Dupke S., Jessen H., Schürmann D., Hamouda O., seroconverter study group. Increase of HIV-1 non-B subtype infections in men who have sex with men in Germany. Abstract PW54 auf dem Deutsch-Österreichischen AIDS-Kongress 2011, Hannover.
5 Poggensee G., Kücherer C., Werning J., Somogyi S., Bieniek B., Dupke S., Jessen H., Hamouda O.; HIV-1 Seroconverter Study Group. Impact of transmission of drug-resistant HIV on the course of infection and the treatment success. Data from the German HIV-1 Seroconverter Study. HIV Med. 2007 Nov;8(8):511-9.
6 Bartmeyer B., Kuecherer C., Houareau C., Werning J., Keeren K., Somogyi S., Kollan C., Jessen H., Dupke S., Hamouda O.; German HIV-1 Seroconverter Study Group. Prevalence of transmitted drug resistance and impact of transmitted resistance on treatment success in the German HIV-1 Seroconverter Cohort. PLoS One. 2010 Oct 7;5(10):e12718.
7 Spielmann N., Münstermann D., Hagedorn HJ., an der Heiden M., Houareau C., Gunsenheimer-Bartmeyer B., Kücherer C., Keeren K., Hamouda O., Marcus U.; German HIV-1 Seroconverter Study Group. Time trends of syphilis and HSV-2 co-infection among men who have sex with men in the German HIV-1 seroconverter cohort from 1996-2007. Sex Transm Infect. 2010 Oct;86(5):331-6.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
