HIV-Grade#
HIV-Resistenztestung aus proviraler DNA?
PRO und KONTRA im klinischen Alltag!*
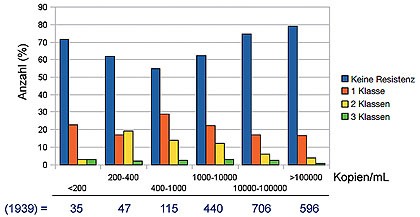 Abb.
1 Häufigkeit von Resistenzen in Abhängigkeit von der Viruslast. Bei
geringen Viruslasten ist nur die Häufigkeit übertragener Resistenzen
sichtbar. Bei sehr hohen Viruslasten sind ebenfalls wenig Resistenzen
nachweisbar (fragliche Compliance)2
Abb.
1 Häufigkeit von Resistenzen in Abhängigkeit von der Viruslast. Bei
geringen Viruslasten ist nur die Häufigkeit übertragener Resistenzen
sichtbar. Bei sehr hohen Viruslasten sind ebenfalls wenig Resistenzen
nachweisbar (fragliche Compliance)2
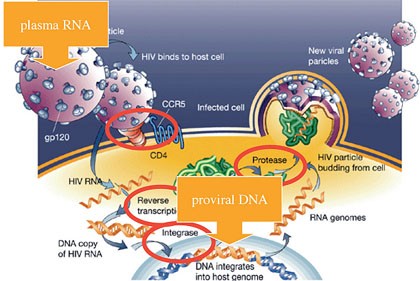 Abb.
2 Replikationszyklus mit viraler RNA in den freien Viruspartikeln und
der proviralen DNA im Zellkern der infizierten Zelle und antiretrovirale
Ziele von HIV3
Abb.
2 Replikationszyklus mit viraler RNA in den freien Viruspartikeln und
der proviralen DNA im Zellkern der infizierten Zelle und antiretrovirale
Ziele von HIV3
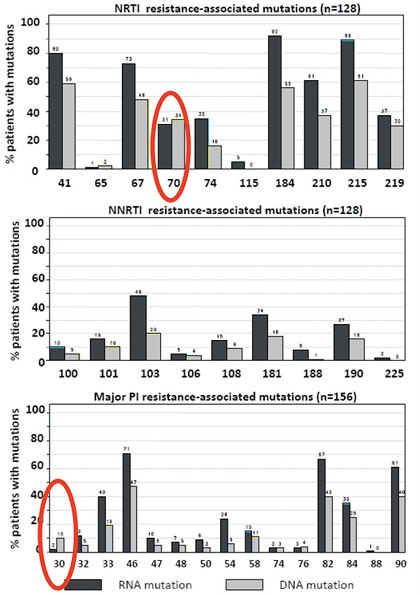 Abb.
3 Vergleich der historischen Daten aus Plasma (RNA) und den proviralen
DNA-Analysen bei supprimierter Viruslast im Plasma aus den Zellen des
peripheren Bluts. Die Mehrzahl der Resistenzmutationen lässt sich im
Plasma häufiger nachweisen als in der proviralen DNA-Analyse (Ausnahmen
siehe rote Markierungen).5
Abb.
3 Vergleich der historischen Daten aus Plasma (RNA) und den proviralen
DNA-Analysen bei supprimierter Viruslast im Plasma aus den Zellen des
peripheren Bluts. Die Mehrzahl der Resistenzmutationen lässt sich im
Plasma häufiger nachweisen als in der proviralen DNA-Analyse (Ausnahmen
siehe rote Markierungen).5
Die heutigen DAIG-Leitlinien definieren Therapie-Erfolg und -Versagen im Wesentlichen als HI-Viruslast <50 RNA-Kopien/ml bzw. >50 RNA-Kopien/ml. Bei einem Therapieversagen wird daher in den meisten Fällen nicht mehr gewartet, bis der Patient eine Viruslast >1.000 Kopien/ml hat, sondern eine Therapieumstellung erfolgt schon bei geringeren Viruslasten. Eine frühzeitige Umstellung folgt der Erkenntnis, dass die Anzahl der Resistenzmutationen mit der Zeitdauer der versagenden Therapie und der Höhe der Viruslast steigt.1 Bei niedrigen Viruslasten ist die Resistenztestung aus viraler RNA aufgrund geringer Kopienzahl oft nicht möglich oder aber die erfolgreiche Analyse weist häufig keine oder nur wenige Resistenzmutationen nach2.
Bei der Vermehrung von HIV im Patienten wird stets das provirale HIV-DNA Genom in die CD4+-Zellen eingebaut. Diese integrierten Viren können reaktiviert werden und bilden ein Reservoir für Resistenzmutationen tragende Viren. Als virales Gedächtnis stellt es eine Gefahr für das „Recycling“ antiretroviraler Medikamente dar. Archivierte resistente Viren können bei entsprechendem Selektionsvorteil, also der Resistenz gegen das eingesetzte Medikament, erneut selektioniert werden.
Die Testung aus proviraler DNA wird zunehmend angefragt und eingesetzt, um bei geringer oder nicht nachweisbarer Viruslast festzustellen, ob sich Resistenzmutationen unter der laufenden ART entwickelt haben und ob Resistenzmutationen von früheren Therapien im Virusgenom archiviert wurden.
Eine hohe Akzeptanz für die Sequenzierung der proviralen DNA gibt es bei der Tropismusanalyse aufgrund der guten Ergebnisse bei Vergleichsuntersuchungen zwischen klinischem Therapieansprechen und der auf proviraler DNA basierenden Tropis-musvorhersage. Wegen dieser guten Korrelation ist die Tropismusbestimmung aus proviraler DNA Bestandteil der DAIG-Leitlinien (www.daignet.de) und damit Standard in Österreich und Deutschland geworden.
Vergleich mit historischen Daten
Der Nutzen der proviralen DNA für die HIV-1-Resistenztestung ist dagegen noch nicht wissenschaftlich abgesichert. Es stellt sich die Frage der Wiederfindung aus früheren Analysen aus Plasma bekannter resistenter Varianten mittels proviraler DNA-Analyse. Mit anderen Worten, es ist zu prüfen, ob die Information aus historischen Resistenztests umfangreicher oder ob die Information aus der aktuellen, proviralen DNA ebenso informativ ist. In der Literatur gibt es dazu Arbeiten von Wirden und Delaguerre, die insgesamt weniger Resistenzmutationen in den proviralen Analysen aktueller Proben beschreiben als in früheren Analysen aus Plasma gefunden wurden.4, 5 Es ist derzeit jedoch noch unklar, wie relevant solche Unterschiede für das Therapieansprechen sind. Einzelne Mutationen in HIV-1-Resistenzanalysen (wie z.B. M184V oder K103N) können ausschlaggebend für eine vollständige Resistenz gegenüber Substanzen oder sogar Substanzklassen sein, oft ist jedoch eine Kombination von Mutationen für eine klinisch relevante Resistenz notwendig. Daher ist der Verlust des Nachweises einzelner Mutationen ggf. verschmerzbar, solange sich die Interpretation nicht deutlich verändert. Andererseits kann es zu einer deutlichen Unterschätzung der Resistenz führen. Auffällig ist auch, dass nachgewiesene Mutationen nicht gleichmäßig seltener in der proviralen DNA Analyse nachweisbar sind, sondern zwischen Substanzklassen und für einzelne Resistenzmutationen unterschiedlich sein können.
Weiterhin gibt es einen Zusammenhang zwischen der Zeit, die das resistente Virus zur Vermehrung zur Verfügung hatte und der Häufigkeit, mit der es in der proviralen DNA-Analyse nachgewiesen werden kann: Je länger der Patient unter einem versagenden Regime stand, desto häufiger gelingt der provirale Nachweis der resistenten Varianten.5 Letztlich scheinen aber weniger Resistenzmutationen anhand einer Analyse einer aktuellen proviralen DNA nachweisbar zu sein als in den historischen Daten sichtbar sind. Zu beachten ist dabei, dass die hier gezeigten Daten sich auf die proviralen DNA-Untersuchungen bei Patienten mit supprimierter Viruslast beziehen, also nicht zeitgleich durchgeführt wurden.
In Anbetracht der mittlerweile zur Verfügung stehenden Vielzahl an Medikamenten sowie der Bedeutung der Resistenztestung für die weitere Therapieentscheidung – gerade bei Patienten mit geringer, aber steigender Viruslast – mag es aber auch wichtig sein, zunächst vorsichtige Überlegungen anzustellen, um ein möglichst sicheres Vorgehen zu gewährleisten. Letztendlich werden weitere klinische Daten gebraucht, um diese Fragestellung zu klären.
Simultane Resistenz-Analysen
Bei der (simultanen) Analyse von viraler RNA und proviraler DNA muss zwischen Therapie-naiven und Therapie-erfahrenen Patienten unterschieden werden. Veröffentlichungen gibt es bislang von Therapie-Naiven. Hier sind Resistenzmutationen häufiger in der proviralen DNA nachweisbar. Die zwar bei geringen Fallzahlen erhobenen Befunde unterstützen die Resistenzanalyse auf Basis der Untersuchung proviraler DNA bei Therapie-Naiven.7, 8, 9 Bei Therapie-Erfahrenen gibt es keine publizierten Daten, aber es ist aus Studien von Li et al. und Doyle et al. bekannt, dass schon bei geringstem Viruslastanstieg Resistenzmutationen entstehen können.10, 11
RESINA-Daten
In Analysen der RESINA-Kohorte wurden 80 virämische Proben zufällig ausgewählt, um die Frequenz der Resistenzmutationen in der viralen RNA parallel mit denen aus der proviralen DNA zu vergleichen. Dabei waren 48 Proben von Therapie-Naiven (mediane Viruslast 102.982 Kopien/ml) und 30 von Therapie-Erfahrenen (mediane Viruslast 10.208 Kopien/ml), die gleichzeitig für virale RNA und provirale DNA untersucht werden konnten. Bei den Therapie-Naiven konnten die oben erwähnten Resultate bestätigt werden, also ein tendenziell häufigerer Nachweis von Resistenzmutationen in der proviralen DNA. Dies unterstreicht den potentiellen Nutzen der proviralen Resistenzanalyse bei Therapie-Naiven.
Bei Therapie-Erfahrenen ist dagegen ein häufigerer Nachweis von Resistenzen in der viralen RNA aus derselben Probe zu sehen. Eine detailliertere Statistik ist aufgrund der niedrigen Zahlen hier jedoch nicht angebracht. Ähnlich wie bei Wirden und Delaguerre beschrieben ist die Verteilung der Material-abhängigen Resistenzhäufigkeiten für die einzelnen Positionen unterschiedlich.4, 5 Bei NRTI-Mutationen beträgt die gemittelte Konkordanz 83,3% (60-100%; bei Delaguerre sind es 60%), bei NNRTIs 69,6% (40-100%, Delaguerre: 46%) und bei PIs 80,8% (50-100%, Delaguerre: 53%).
Diskussion
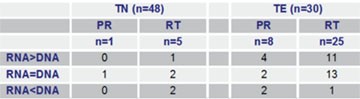 Tab. 1 Vergleich der Anzahl Resistenzmutationen in Protease (PR) und Reverse Transkriptase (RT) in viraler RNA und proviraler DNA in den Proben Therapie-Naiver (TN) und Therapie-Erfahrener (TE)12
Tab. 1 Vergleich der Anzahl Resistenzmutationen in Protease (PR) und Reverse Transkriptase (RT) in viraler RNA und proviraler DNA in den Proben Therapie-Naiver (TN) und Therapie-Erfahrener (TE)12
In der Zusammenschau der oben vorgestellten Daten stellt sich die Analyse der proviralen DNA im Rahmen der HIV-1-Resistenztestung als Ergänzung bei geringer oder nicht nachweisbarer Viruslast bzw. bei therapienaiven Patienten dar. Die Resistenztestung aus viraler RNA ist für Vortherapierte bei hohen Viruslasten (>1.000 Kopien/ml) „State of the Art“, da hier die Wiederfindungsrate in der viralen RNA der freien Viren höher ist als in der proviralen DNA und die Testsysteme zuverlässig PCR-Produkte als Basis der Auswertung liefern. Bei Viruslasten <1.000 Kopien/ml ist dagegen der Nachweis von Resistenzmutationen in der viralen RNA seltener erfolgreich als bei höheren Viruslasten und besonders bei Ergebnissen aus Proben <200 Kopien/ml2 ist in vielen Fällen keine Resistenztestung möglich.
Die Daten von historischen Resistenzanalysen liefern sehr wertvolle Hinweise und helfen erheblich, ein aktuelles Therapieversagen zu vermeiden. Diese hohe Relevanz ergibt sich möglicher Weise daraus, dass die Resistenzanalysen häufig in Bezug zu historischen Therapiedaten der Patienten stehen und so oft einzelne Substanzen oder Stoffklassen ausgeschlossen werden können. Die Information aus der Resistenztestung der proviralen DNA kann insbesondere dann wertvoll sein, wenn bei Vorbehandelten die Therapiehistorie und entsprechende Resistenztestungen nicht oder nur unvollständig vorliegen. Es ist auch nicht auszuschließen, dass seit dem letzten Resistenztest – auch bei geringer Viruslast – eine zusätzliche Resistenzentwicklung stattgefunden haben kann. Auch in diesem Kontext kann die provirale DNA Analyse ein nützliches Instrument sein und in Ergänzung mit den historischen Daten (soweit vorhanden) zusätzliche Sicherheit für die Wahl der neuen Therapiekombination bieten.
Dualer Test?
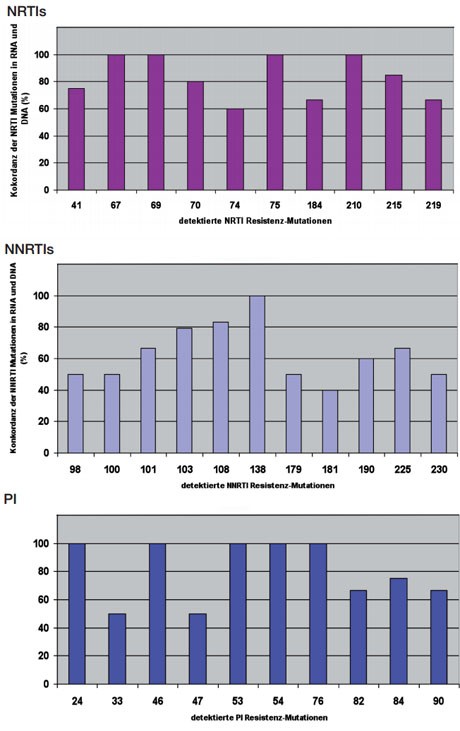 Abb. 4 a, b, c Konkordanz zwischen den viralen RNA und proviralen DNA Nachweisen bei Therapie-Naiven und Therapie-Erfahrenen. Der gleichzeitige Nachweis von Resistenzmutationen ist für die unterschiedlichen Aminosäurepositionen unterschiedlich12
Abb. 4 a, b, c Konkordanz zwischen den viralen RNA und proviralen DNA Nachweisen bei Therapie-Naiven und Therapie-Erfahrenen. Der gleichzeitige Nachweis von Resistenzmutationen ist für die unterschiedlichen Aminosäurepositionen unterschiedlich12
Wie schon erwähnt, stellt sich auch für die Therapie-Naiven aufgrund der Literatur und der Daten der RESINA-Kohorte die Frage, ob die provirale DNA Analyse die bisherige virale RNA Analyse ablösen könnte. Aus (labor-)technischen Erwägungen wäre zu diskutieren, ob die Analyse aus (EDTA-)Vollblut gemacht werden sollte, um gleichzeitig virale RNA (wenn vorhanden) und provirale DNA zu untersuchen. Dadurch würde die Zahl der Untersuchungen gegenüber dem bislang praktizierten Verfahren gleich bleiben. Das entsprechende Ergebnis bei Proben mit niedrigen Viruslasten wird maßgeblich durch die provirale DNA gesteuert, während die Ergebnisse bei Proben mit höheren Viruslasten wahrscheinlich von der viralen RNA bestimmt würden. Diese Einschätzung ergibt sich aufgrund der Mengenverhältnisse von proviraler DNA zu viraler RNA in den entsprechenden Proben.
Nächster Schritt: Standardisierung
Abschließend sollte noch einmal erwähnt werden, dass die Gründe für die unterschiedliche Nachweisraten einzelner Mutationen in proviraler DNA und aus viraler Plasma-RNA parallel entnommenen Proben weitestgehend unverstanden sind. Dies kann durchaus Einfluss auf die Interpretation der Analysen nehmen, z.B. erscheinen primäre Resistenzmutationen der Proteaseinhibitoren seltener konkordant aufzutreten als sekundäre. Solche Zusammenhänge in Bezug auf klinische Ansprechdaten erzeugen möglicher Weise den Bedarf, für die provirale Resistenztestung bei HIV ein spezifisches Interpretationssystem zur Bewertung der Resistenz-Situation bei dem jeweiligen Patienten zu entwickeln.
Um diesen Fragestellungen letztendlich auch mit einer statistisch relevanten hohen Fallzahl nachgehen zu können, wird HIV-GRADE das Thema weiter verfolgen und mit den deutschen und österreichischen HIV-Zentren zügig ein standardisiertes Vorgehen erarbeiten.
Literatur beim Verfasser
# Für HIV-Grade: Nadine Lübke1, Rolf Kaiser1, Thomas Berg2, Patrick Braun3, Martin Däumer4, Josef Eberle5, Robert Ehret2, Claudia Kücherer6, Harm Müller7, Christian Noah8, Martin Ober- meier2, Alexander Thielen4, Hauke Walter2, Eva Wolf9 und Martin Stürmer10
1 Institut für Virologie, Uniklinik Köln
2 Medizinisches Labor Dr. Berg Berlin
3 PZB Aachen
4 Labor Dr. Thiele Kaiserslautern
5 Max von Pettenkofer-Institut München
6 Robert-Koch-Institut, Berlin
7 Labor Dr. Fenner Hamburg
8 Labor Lademannbogen Hamburg
9 MVZ Karlsplatz, München
10 Institut für Medizinische Virologie, Nationales Referenzzentrum für Retroviren, Universitätsklinikum Frankfurt
* Dieses Thema und wesentliche Teile dieses Beitrags wurden auf dem DÖAK in Innsbruck im Rahmen eines Satelliten-Symposiums vorgestellt und diskutiert. Dieses Satelliten-Symposium erfolgte mit der freundlichen Unterstützung von GSK-Österreich und machte dieses konstruktive Arbeitstreffen von Mitgliedern von HIV-GRADE mit Kollegen und Kolleginnen aus Österreich, Schweiz und Deutschland möglich. In diesem Symposium wurde klar, wie eng die klinischen und diagnostischen Fragestellungen ineinander greifen. Die klinische Anforderung an die Diagnostik wird immer intensiver und die Rückkoppelung noch stärker als früher.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
